载顺铂的磁性纳米药物体系的制备及其抗肺癌活性研究
2021-03-04姚雪莲严志宏王一帆彭珊珊蔡瑛向汝群范嘉华江西中医药大学南昌330004江西省医学科学院南昌330006
★ 姚雪莲 严志宏 王一帆 彭珊珊 蔡瑛 向汝群 范嘉华(.江西中医药大学 南昌 330004;.江西省医学科学院 南昌 330006)
顺铂是一种重要的癌症化疗药物,广泛用于卵巢癌、宫颈癌、头颈癌及非小细胞肺癌的治疗[1]。但其全身毒性是治疗成功的主要障碍,受到包括肾毒性、呕吐和神经毒性在内的副作用的限制[2]。如何提高肿瘤病灶内的药物浓度以抑制肿瘤细胞生长,减少抗肿瘤药物的用量以减轻全身毒副反应,是目前肿瘤化学药物治疗中亟待解决的问题。
磁性药物载体具有磁靶向性,可使药物精准地输送到病灶部位,降低了药物的系统毒性,从而减少对正常细胞的毒性,提高肿瘤局部的药物浓度[3]。本研究拟采用共沉淀法制备Fe3O4MNPs,再进行包硅和氨基功能化,在此基础上装载抗肿瘤药物顺铂。以小鼠肺癌肿瘤细胞为研究对象,考察载顺铂的磁纳米药物体系对小鼠肺癌的抑制作用。
1 材料与方法
1.1 试剂与仪器 FeCl3·6H2O、FeSO4·7H2O、异丙醇、浓氨水、乙醇均为分析纯,均购自西陇科学股份有限公司;水合肼,分析纯,购自国药集团;硅酸四乙酯(TEOS,99 %)、3-氨丙基三乙氨基硅烷(APTES,99 %)、溴化钾、三乙胺、二甲基亚砜(DMSO)均购自罗恩试剂;丙酮,分析纯,购自天津市永大化学试剂开发中心;自制去离子水和蒸馏水;小鼠肺癌LLC细胞(CL-0140 Procell),购自中国典型培养物保藏中心(CCTCC)。
真空干燥箱(DZF-6020,宁国沙鹰科学仪器有限公司);电子分析天平(BS-214,北京赛多利斯仪器);恒温磁力搅拌器(85-2,上海司乐仪器有限公司);数显恒温水浴锅(HH-2,国华(常州)仪器制造有限公司);超声清洗仪(CSA-06BT,宁国沙鹰科学仪器有限公司);傅里叶变换红外光谱仪(Nicolet IS5型,美国Thermo公司);扫描电子显微镜(FEI Quanta250,美国FEI公司),透射电子显微镜(HT7800,日立HITACHI);紫外可见分光光度计(UV-I600PC,上海美谱达仪器有限公司)。CCK-8法细胞增殖检测试剂盒(KGA317,江苏凯基生物);Annexin V-APC/7-AAD apoptosis kit(AP105-100kit,MULTI SCIENCES 联科生物);全自动酶标(WD-2102B,北京六一生物科技);NovoCyte™流式细胞仪(NovoCyte 2060R,艾森生物<杭州>有限公司)。
1.2 方法
1.2.1 磁性纳米颗粒Fe3O4的制备称取10.9 g FeSO4·7H2O和4.0 g FeCl3·6H2O 溶解于30 mL去离子水中,通入氮气,在机械搅拌器的搅拌下,加入2 mL水合肼,再逐滴加入35 mL浓氨水,调节溶液pH为9。搅拌30 min后,将反应体系升温至80 ℃老化1 h,停止反应,用磁铁进行磁性分离,弃去上清液,用去离子水洗涤下层固体,再用无水乙醇洗涤,最后在真空干燥器中60 ℃干燥12 h,即得Fe3O4纳米颗粒。
1.2.2 包硅磁纳米颗粒(Fe3O4@SiO2)的制备取1 g上述制备的磁性Fe3O4纳米粒子分散于装有100mL异丙醇和8 mL去离子水的三颈烧瓶中,超声15 min后,缓慢滴加10 mL浓氨水调节pH 8。再加入8 mL TEOS,45 ℃下快速搅拌,反应12 h。反应结束后磁场分离出磁流体,分别用去离子水和无水乙醇反复洗涤。最后在真空干燥器中60 ℃干燥12 h,即得Fe3O4@SiO2纳米粒子。
1.2.3 包氨磁纳米颗粒(Fe3O4@SiO2-APTES)的制备取上述制得的Fe3O4@SiO2粒子6 g分散于80 mL无水乙醇,加入12 mL APTES,2 mL三乙胺,快速搅拌24 h,产物用去离子水和无水乙醇洗涤,洗涤后置于60 ℃真空干燥,即得Fe3O4@SiO2-APTES的棕褐色粉末。
1.2.4 载顺铂磁纳米药物体系的制备分别称取2 mg顺铂和20 mg Fe3O4@SiO2-APTES磁纳米粒子,共分散于5 mL丙酮中,60 ℃搅拌1 h,在外加磁场作用下得到产物,用去离子水反复洗涤后,置于真空干燥箱中干燥。
1.2.5 载顺铂磁纳米体系特征检测将真空干燥后的载顺铂纳米粒子与 KBr研磨混合并压片制得透明薄片,采用傅里叶变换红外光谱仪,分辨率4 cm-1,扫描次数70,扫描范围400~4 000 cm-1。将真空干燥的载顺铂纳米粒子置于电镜样品台上,分别采用扫描电镜和透射电镜观察其形貌、粒径。
1.2.6 载顺铂磁纳米体系的载药量及包封率的测定取载顺铂磁纳米粒子分散于DMSO中,离心,取上层清液2 mL,紫外分光光度计测定其在305nm波长下的吸光度值,绘制标准曲线计算出残液中顺铂药物的含量。按照公式计算其载药量和包封率并对比。载药量(%)=(顺铂总量-顺铂残余量)/载药纳米粒子总量×100 %;包封率=(顺铂总量-顺铂残余量)/顺铂总量×100 %[4]。
1.2.7 载顺铂磁纳米体系的体外药物释放将40 mg载顺铂磁纳米颗粒分散于8 mL磷酸盐缓冲液(PBS,pH 7.4)后转移到透析袋(分子截留量300.5)中,加入9倍体积PBS释放介质,并在37℃的恒温水浴中以100 r/min振荡, 分别于不同时刻取出2mL释放介质作为样品, 并加入等量新鲜介质,测定其在 305 nm下的吸光度值,取3次实验平均值,根据标准曲线计算出顺铂的累积释放量。
1.2.8 CCK8检测磁性纳米载体的细胞毒性培养LLC细胞系,接种于96孔板中(7×103个/孔)培养24 h,加入不同浓度的(6.25,12.5,25,50,100 µg/mL)载药磁纳米粒子,继续培养24 h后,将处理后的细胞每组换成相同培养基100 µL,每孔加入10 µL CCK8试剂,置于培养箱中孵育2 h;酶标仪在450 nm波长处检测每孔的吸光值。检测细胞的存活率,看各浓度下细胞的存活率,计算IC50值。
1.2.9 细胞凋亡检测LLC细胞以5×105/mL细胞悬液孔接种于6孔板内,培养至状态良好后造模组加入含有载药磁纳米粒子的培养液(75.36 µg/mL),培养24 h后胰酶消化收集所有细胞,PBS洗两遍,加500 µL预冷的1×Binding Buffe,每管各加入5 µL Annexin V-APC和10 µL 7-AAD轻微混匀后,室温避光孵育10 min上流式仪检测。
1.3 统计学方法 应用SPSS 20.0软件进行统计分析。所有实验重复3次,定量结果采用均数±标准差(±s)表示。两组之间定量数值比较采用独立样本t检验,多组之间定量数值比较采用单因素方差分析,两两比较采用S-N-K法。检验标准α=0.05。
2 结果
2.1 磁纳米药物载体的物理表征 磁纳米药物载体的红外光谱图见图1。可见,585 cm-1为Fe-O键伸缩振动所产生的峰,即Fe3O4的特征峰;1 090 cm-1为Si-O-Si所产生的特征峰;2 990 cm-1处的特征峰对应了-CH2-中碳氢键的不对称伸缩振动产生的峰;3 444 cm-1为-NH2中N-H的伸缩振动所产生的峰。

图1 红外光谱图
磁纳米粒子的电镜图见图2。图2(a)是Fe3O4粒子,可见其粒子外观呈球形,平均粒径约为10 nm;图2(b)是载顺铂的Fe3O4@SiO2-APTES纳米粒子,可见其粒子为球形,平均粒径为250 nm,分散良好。

图2 Fe3O4粒子的透射电镜图(a)和载顺铂磁纳米药物的扫描电镜图(b)
磁纳米药物载体的磁性表征的VSM图见图3。由图可知其磁饱和值分别为0.390 5 emu/mg,这个结果表明,该磁纳米药物体系有较好的磁响应能力,在外加磁场作用下能够快速有效地与基质分离,有较好的磁靶向性。

图3 磁纳米药物载体的VSM图
2.2 载药量及包封率测定 经紫外分光光度计测定,以顺铂浓度为横坐标、吸光度为纵坐标绘制线性回归曲线,得线性方程Y=0.360 5X-0.487 3(R2=0.9833)。根据载药率及包封率公式可以确定载药量,得出顺铂载药率为6.18 %,包封率为60.12 %。
2.3 载顺铂磁纳米体系的体外药物释放 载顺铂磁纳米体系的体外药物释放率见图4。从图中可见,该磁纳米粒子在1 h内迅速释放所载顺铂总量的50 %,剩余的顺铂在24 h内从纳米粒中缓慢释放达到89 %。
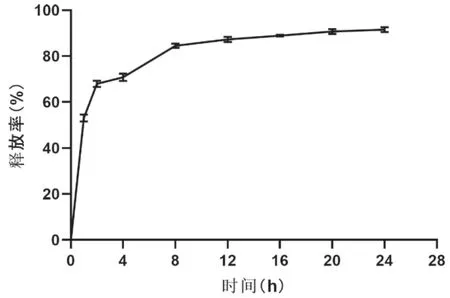
图4 累积药物释放率
2.4 CCK8检测结果 与正常组相比,加入不同浓度的载药磁纳米粒子作用细胞后细胞的存活率下降,且随着作用浓度的增加,细胞的存活率下降(P<0.05),半抑制浓度为75.36 µg/mL。见图5。

图5 细胞CCK8检测及IC50结果
2.5 流式检测结果 与空白组相比,加入载药磁纳米粒子作用细胞后,细胞的凋亡率显著增大(P<0.05)。见图6。

图6 流式检测凋亡结果
3 结论
本文制备了以Fe3O4为核心的磁纳米粒子,并进行包硅、氨基功能化修饰,然后装载抗肿瘤药物顺铂,并研究了纳米载药体系对化疗药物顺铂的运载率及纳米载药体系对小鼠肺癌细胞的凋亡情况。结果表明所设计的体系具有较高的生物相容性、良好的磁靶向性和体外抗肺癌活性,为进一步的体内治疗提供了实验依据。
