玉米RNA对小鼠脂肪沉积的影响
2021-03-03魏立民何家建习欠云张永亮
黎 梦 魏立民 陈 婷 何家建 习欠云 张 瑾 张永亮*
(1.嘉兴学院生物与化学工程学院,嘉兴 314000;2.华南农业大学动物科学学院,广州 510642)
肥胖是体内脂肪过度沉积的表现,与脂代谢紊乱密切相关。脂肪代谢的紊乱会引起脂肪细胞分泌因子的异常,炎症因子的分泌随之增高,从而引起机体的代谢疾病以及炎症反应[1]。肥胖人群中糖尿病、高血压、高血脂、心脑血管疾病以及一些癌症的发病率也显著高于普通人群。因此,对脂肪代谢调控的研究有助于预防和治疗肥胖及其引起的疾病。在畜禽生产中,肉品质更是人们关注的问题。脂肪作为影响肉品质的重要因素之一,其代谢调控的研究也可为肉品质的控制提供依据[2]。
脂肪组织的发育及调控受遗传、营养和环境等许多因素影响。核酸是一类具有生理生化功能的营养物质,其对机体调节作用早已为人们所关注。在机体生长发育过程中,可利用外源核苷酸或核苷酸片段合成新的核苷酸供机体使用[3]。食品中的核苷酸有助于抗腹泻和改善营养不良[4]。口服特定基因的RNA可以调节基因的表达,有助于增加小鼠骨骼肌发育[5]。减少饲粮中玉米RNA可以增加小鼠体重,单独灌服特定的玉米miRNA可以显著降低小鼠的增重[6],研究也证实了玉米miRNA可通过调节动物基因的表达参与机体调节[6-7]。但植物源核酸对脂肪的调节仍鲜有报道。因此,探究植物源核酸对脂肪代谢的调节作用,对了解植物源核酸的作用机制以及通过核酸类制剂进行疾病的治疗或提高畜产品品质等有积极意义。本试验通过给断奶小鼠灌服玉米RNA,探究其对脂肪代谢的调节,及对小鼠脂肪沉积和生长的影响,为植物源核酸调控动物脂肪沉积影响因素的探索提供新证据。
1 材料与方法
1.1 试验设计及饲粮
选取20只28日龄断奶的C57BL/6J小鼠随机分为2组,对照组灌服生理盐水,试验组灌服玉米RNA(100 μg/d),每组10个重复(公母各占1/2),每个重复1只,单笼饲养,进行12 h的光/暗循环。试验期4周。
每天提取3 g玉米的总RNA,将纯化的100 μg玉米RNA溶于300 μL生理盐水,并以300 μL生理盐水为对照,于每天08:00进行灌服。参考常规小鼠饲粮配方,将玉米淀粉代替饲粮中的玉米并保证饲粮与常规小鼠饲粮营养和能量均衡[7],配制成低玉米RNA饲粮进行饲喂,饲粮组成及营养水平见表1。

表1 饲粮组成及营养水平(干物质基础)
试验结束后检测小鼠抓握力,旷场试验检测焦虑情况,使用核磁共振成像仪(上海纽迈电子科技有限公司,MesoQMR23-060H)测定小鼠的体组成及体成像,最后小鼠采用断颈处死并按步骤采集样品。
1.2 测定指标及方法
1.2.1 生长性能测定
试验小鼠每周称重(08:00,空腹),计算每周及全期平均日增重;记录喂料量和余料量,计算各阶段及全期平均日采食量和累积采食量。
1.2.2 血清生化指标测定
在试验结束时,每组10只小鼠分别采集全血,室温倾斜静止1 h,室温条件下4 000 r/min离心10 min获取血清,-20 ℃保存备用。用全自动生化分析仪(美国贝克曼,AU5800)及中生北控试剂盒测定血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素(UREA)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量、白蛋白/球蛋白(A/G)及丙氨酸氨基转移酶(ALT)活性。
1.2.3 器官指数测定
小鼠颈部脱臼处死后,开腹分离完整干净的脾脏、心脏、肝脏、肺脏、肾脏、皮下脂肪和附睾脂肪等组织,分别进行称重,计算器官指数:
器官指数(%)=(器官重量/体重)×100。
1.2.4 旷场试验
旷场试验箱为1个100 cm×100 cm×50 cm的箱体,箱底画有25个相等的方格。旷场试验进行3 min,将小鼠置于试验箱中央格内,观察并记录其在总区域的活动距离、中心区域的活动距离、中心时间比、平均速度、位于中心次数和直立次数。
1.2.5 实时荧光定量PCR(qRT-PCR)测定
利用十六烷基三甲基溴化铵(CTAB)法提取玉米RNA,Trizol裂解法提取动物RNA。参照TaKaRa反转录试剂盒说明书将1 μg RNA以10 μL体系进行反转录,加40 μL水稀释备用。采用荧光定量PCR仪(美国伯乐,CFX96)检测附睾脂肪β-肌动蛋白(β-actin)、CCAAT增强子结合蛋白-α(C/EBP-α)、过氧化物酶体增殖剂激活受体-γ(PPAR-γ)、脂肪甘油三酯脂肪酶(ATGL)、激素敏感脂酶(HSL)和脂肪酸合成酶(FAS)mRNA相对表达量,反应体系为:cDNA 2 μL,10× Taq Polymerase Buffer 2 μL,dNTPs(2.5 mmol/L)2 μL,上游引物(10 μmol/L)0.4 μL,下游引物(10 μmol/L)0.4 μL,Taq Polymerase(5 U/μL)0.5 μL,加ddH2O补到20 μL;反应程序为:预变性 95 ℃ 2 min;变性95 ℃ 15 s,退火15 s,延伸72 ℃ 40 s,40个循环;最后95 ℃ 1 min,退火 30 s,95 ℃ 30 s,绘制相应的熔解曲线,反应设立无模板反转录样品为阴性对照(NTC)。以β-actin为内参基因,按照2-△△Ct法计算目的基因mRNA相对表达量,引物信息见表2。

表2 qRT-PCR特异性引物
1.3 统计与分析
本试验数据使用SPSS 17.0的one-way ANOVA程序进行方差分析,2组间采用t检验(t-test)进行比较,使用GraphPad 6.0制图,以P<0.05为显著性标准,P<0.01为差异极显著性标准。
2 结果与分析
2.1 玉米RNA对小鼠生长性能的影响
与对照组相比,在第1~2周,试验组小鼠累积采食量极显著上调(P<0.01),试验结束时保持一致(图1-A),平均日采食量无显著变化(图1-B,P>0.05);在第2~4周,试验组小鼠的体重显著低于对照组(图1-C,P<0.05),平均日增重有下降趋势(图1-D,P>0.05)。结果表明,灌服玉米RNA使小鼠增重减少。
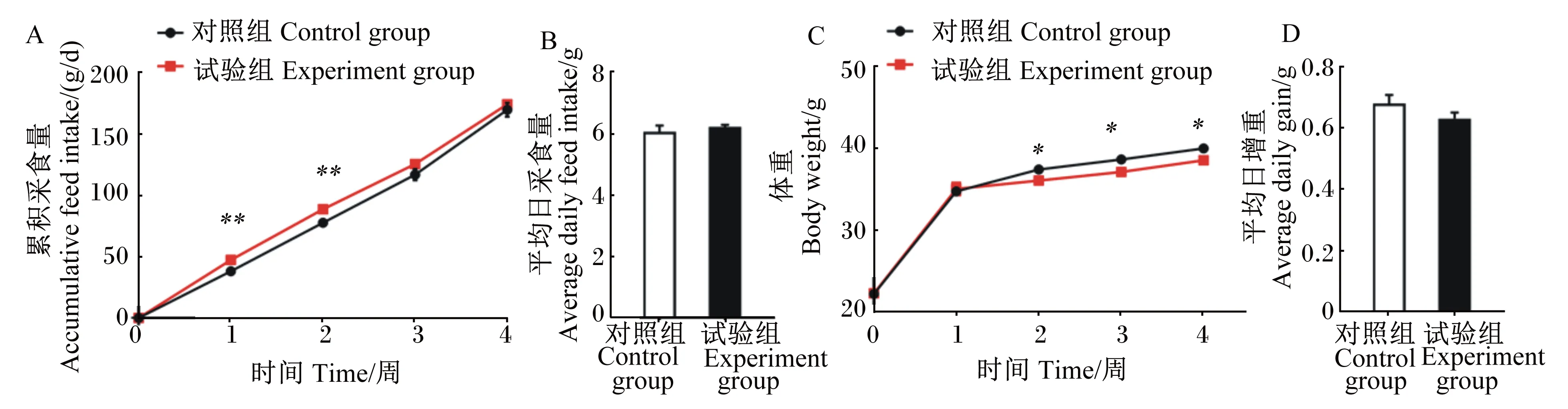
*:P<0.05;**:P<0.01。下表同。
为探究玉米RNA对小鼠精神的影响,采用旷场试验检测小鼠的自主行为和焦虑情况。如图2所示,与对照组相比,灌服玉米RNA后,小鼠运动距离、中央区域运动距离和时间、进入中心次数、速度和直立次数均无显著差异(P>0.05),提示玉米RNA对小鼠的自主行为活动和焦虑状况无显著影响,排除了产生焦虑对小鼠采食和能量代谢造成的影响而导致小鼠增重的减少。

图2 玉米RNA对小鼠精神的影响
2.2 玉米RNA对小鼠血清生化指标的影响
如图3所示,与对照组相比,试验组血清ALB、TP、尿素含量、A/G、ALT活性无显著差异(P>0.05),提示玉米RNA对小鼠肝功能和蛋白质代谢无明显影响;试验组小鼠血清GLB含量显著增加(P<0.05),HDL-C、LDL-C和TC含量极显著增加(P<0.01),即玉米RNA提高小鼠血脂水平,提示脂肪代谢增强。

图3 玉米RNA对小鼠血清生化指标的影响
2.3 玉米RNA对小鼠脂肪沉积的影响
如图4所示,与对照组相比,试验组小鼠相对肌肉含量极显著增加(P<0.01),检测小鼠的肌肉抓握力,并无显著差异(P>0.05),表明灌服玉米RNA对肌肉力量无显著影响。试验组小鼠相对脂肪含量下降,并对小鼠进行体成像分析发现,试验组小鼠相对脂肪含量明显减少,且附睾脂肪指数显著降低(P<0.05),提示玉米RNA减少小鼠脂肪沉积。

图4 玉米RNA对小鼠脂肪沉积的影响
2.4 玉米RNA对小鼠脂肪相关基因mRNA相对表达量的影响
如图5所示,与对照组相比,玉米RNA能极显著上调脂肪合成基因C/EBP-α、FASmRNA相对表达量(P<0.01)及显著上调PPAR-γ mRNA相对表达量(P<0.05);同时显著上调脂肪分解基因ATGL和HSLmRNA相对表达量(P<0.05)。结果表明玉米RNA能同时增加小鼠脂肪合成代谢和分解代谢。

图5 玉米RNA对小鼠脂肪相关基因mRNA相对表达量的影响
3 讨 论
脂肪的合成与分解始终处于一种动态的平衡状态,脂肪合成的同时也发生脂解作用,共同调节脂肪代谢。这个过程受到许多关键基因的调节,PPAR-γ、FAS和C/EBP-α等是参与脂肪细胞分化和脂肪酸合成关键的促进因子,是成脂标志性基因[8];ATGL和HSL是负责分解脂肪组织中TG释放游离脂肪酸的关键酶[9]。试验结果显示,玉米RNA促进附睾脂肪C/EBP-α、PPAR-γ、FAS、HSL和ATGLmRNA相对表达量,即同时促进机体脂肪的分解代谢和合成代谢。在白色脂肪中,脂质的合成与分解效率直接呈正相关[10]。在脂肪细胞分化早期和中期阶段,脂肪合成相关基因PPAR-γ、LPL和FAS等的表达量依次明显增高,细胞内的脂质合成加速,且HSL和ATGL的表达也会随之提高,细胞内脂肪分解也开始变得活跃[11]。通过节食或锻炼使体重下降,其HSL表达也随之下降,脂肪分解减少[12]。特异性敲除小鼠脂肪细胞的ATGL基因,在抑制脂解和降低血脂的同时,与脂肪合成相关基因表达也受到抑制[13]。当脂肪积累超出负荷,脂质分解会增加,引起游离脂肪酸升高、高甘油三酯血症,使人体糖脂代谢紊乱。因此在脂肪细胞减少脂质合成的同时,减少脂解更有利于维持更健康的能量代谢平衡。相应地,灌服玉米RNA促进脂解增加,同时适当的促进脂质合成增加,更有利于维持机体脂代谢的平衡。
核酸吸收、分布、代谢和清除的差异性以及不同的饮食摄入都会导致发挥作用的核酸摄入浓度的不同。研究表明,小肠RNA可酶解产生单独一种核苷酸、核苷和碱基的产物,灌服40 μg小肠RNA能修复辐射造成的肠腺损伤[14]。饲喂80 μg大米RNA能显著提高小鼠血清中的MIR168a的含量,并抑制靶基因低密度脂蛋白受体的表达;单独灌服3×10-10mol MIR168a能抑制小鼠肝脏低密度脂蛋白受体的表达,增加料重比[15]。用金银花熬制成水(MIR2911约6×10-13mol/g,浓度为1.2×10-10mol/L)饲喂小鼠能恢复因流感病毒造成的体重减轻[16]。本试验每天灌服3 g玉米提取的100 μg RNA,证实玉米RNA可以调节脂肪代谢,可作为控制脂肪沉积的有效成分。因此,推测在正常生理状态下,玉米RNA可以减少小鼠增重,合理控制体重;过度肥胖时,一定剂量范围内增加玉米RNA能减少脂肪沉积,减少体重。体重变化会涉及多方面的代谢及生理生化的调节,包括消化生理、器官形态及血液生化指标等[17]。试验组小鼠增重显著减少,呈现持续平稳的增长状态,平均日采食量和平均日增重无显著差异,表明其对摄食及消化吸收无显著影响;心脏、肝脏、脾脏、肺脏、肾脏和胃的器官指数无明显异常;旷场试验显示小鼠未出现焦虑状况,且血清生化指标显示小鼠的血清ALB、TP含量、A/G和ALT活性无显著差异,即小鼠肝功能正常,血清尿素含量无异常,即蛋白质代谢正常,表明玉米RNA对小鼠无明显有害影响。血清中HDL-C、LDL-C和TC含量显著增加,即脂代谢增强,体组成、体成像和附睾脂肪指数结果显示小鼠相对肌肉含量显著增加,内脏脂肪沉积明显减少。这些结果表明玉米RNA对小鼠无明显有害影响,能增强机体脂肪代谢,减少脂肪沉积。
RNA进入肠道可被各种酶降解为单核苷酸,最终被肠道内的碱性磷酸酶和核苷酸酶水解为核苷和磷酸,部分核苷可在核苷酶的作用下被进一步降解为游离的嘌呤或嘧啶碱基,供机体利用[18]。进入机体的核苷酸如腺嘌呤核苷酸(AMP)能刺激AMP激活的蛋白激酶(AMPK)调控能量和底物代谢,并通过刺激产生ATP抑制脂肪沉积[19]。不同的核苷酸对不同的脂肪组织功能不同,0.1%复合核苷酸能降低肝脏脂肪含量同时提高肌肉脂肪含量[20]。此外,RNA寡核苷酸药物已被开发为药物针进行疾病治疗。口服30 mg/kg特异性靶向Forkhead box O1(Foxo-1)的2’-O-甲基修饰的反义RNA寡核苷酸,可以显著抑制Foxo-1基因的表达及肌肉的重量[5]。玉米mRNA可能通过降解产生的短片段核酸或核苷酸调节脂肪的沉积。
RNA中的许多非编码RNA具有一定的稳定性,如siRNA[21]和miRNA[21]等具有2’-O-甲基化修饰,circRNA具有稳定的闭环结构[22],利于其吸收并发挥作用。动物miRNA广泛参与脂肪代谢的调节[23]。Sun等[24]报道lncRNA对脂肪代谢的调控作用,后有研究进一步挖掘和分析猪的9个组织,发现了147个脂肪circRNA[25],表明这些非编码RNA可能参与脂肪代谢的调控。研究表明,植物源功能性核酸miRNA可以跨界调节动物的生理过程[15-16],且在猪的包括脂肪在内的12个组织中检测到的18个玉米miRNA,均有不同程度的表达[26],提示玉米功能性RNA有可能被机体吸收调节脂肪的沉积。这些植物来源功能性RNA对于脂肪的调节有待进一步研究。尽管外源性RNA跨界调控作用仍然存在争议[27],研究存在极大的挑战,但是外源核酸通讯仍是目前研究的一个新的重要领域,具有广阔的前景。这一领域的突破进展将对于人类疾病和生活的影响具有重要的意义。
4 结 论
综上所述,玉米RNA在不影响小鼠正常生长的情况下能提高脂肪合成基因FAS、C/EBP-α、PPAR-γ和脂肪分解基因ATGL、HSL的mRNA相对表达量,增强机体脂肪代谢;脂肪分解作用大于合成作用,使脂肪沉积减少,增重减少。
