包膜丁酸钠对脂多糖刺激下断奶羔羊血清炎性细胞因子、肠道通透性及肠道组织形态的影响
2021-03-03王可鑫左丽君潘春媛李凌岩张爱忠
王可鑫 左丽君 陈 想 姜 宁 潘春媛 李凌岩 张爱忠
(黑龙江八一农垦大学动物科技学院,黑龙江省寒区饲料资源高效利用与营养调控重点实验室,大庆 163319)
近年来,舍饲养羊逐步走向现代集约化的道路。在现代化养羊生产中,由于早期断奶、饲养环境及疾病等原因,羔羊易受细菌、病毒等病原体及脂多糖(LPS)等非病原体的侵袭,激发羔羊产生免疫应激导致肠黏膜形态结构发生改变、肠道黏膜屏障功能受到破坏,从而引起消化功能紊乱、生长迟滞、腹泻等问题,给动物生产带来重大经济损失[1-2]。添加饲用抗生素及改善畜舍环境等方法成为缓解免疫应激的主要措施。全球约73%的抗生素是用于动物疾病的预防和治疗,但长期饲喂抗生素易引发细菌耐药性且抗生素滥用会损伤机体胃肠道屏障功能,破坏菌群结构,导致肠道稳态失衡[3]。
肠道健康发育是保障动物生长及发挥潜在生产性能的关键。肠道微生物在机体营养物质消化和肠道健康方面扮演着十分重要的角色。肠道微生物代谢产物短链脂肪酸主要包括乙酸、丙酸和丁酸。丁酸钠(SB)在动物胃肠道内水解形成丁酸,不仅是宿主肠上皮细胞的首选能量代谢原料和细胞增殖分化的主要调控因子,而且还具有抗炎、抗肿瘤、调控基因表达、调节肠道菌群平衡、改善肠道功能等重要作用;在临床上,丁酸也被认为是治疗肠炎的潜在治疗药物[4-5]。据报道,在饲粮中添加包膜丁酸钠(CSB)不仅可以提高反刍动物的生长性能[6],还可以促进肠道发育并改善肠道菌群的丰度[7]。有研究表明,CSB的添加可降低哺乳犊牛腹泻,缩短断奶持续时长[8]。Chang等[9]在饲粮中添加SB可以降低反刍动物体内LPS和促炎性细胞因子的含量,并减弱细胞凋亡途径的活化,从而阻止乳腺细胞凋亡和维持乳腺健康。Górka等[10]研究发现,饲粮中外源SB的添加不仅会影响瘤胃的水解活性,而且对绵羊小肠发育也有积极影响。但是在免疫应激状态下,CSB对羔羊肠道健康的影响还鲜见报道。因此,本研究拟从营养与免疫相结合的角度,探讨CSB对LPS应激羔羊肠道免疫及组织形态的影响,为CSB缓解幼龄反刍动物细菌性疾病感染、维持羔羊肠道稳态、减少或杜绝饲用抗生素的添加提供数据支持,为其缓解羔羊免疫应激提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用CSB中的SB含量为30%,由某进出口有限公司提供;055∶B5型大肠杆菌LPS(L2880)购自美国Sigma Chemical公司。
1.2 试验设计
本试验在黑龙江八一农垦大学动物科技学院动物试验中心进行。试验选用(42±1)日龄、平均体重为(11.79±0.54)kg的“德国美利奴×杜泊”断奶公羔羊24只,按体重相近原则随机分为4组:空白组(CON组)、LPS组、CSB2L组、CSB3L组,CON和LPS组饲喂基础饲粮,CSB2L和CSB3L组在基础饲粮中分别添加2和3 g/kg CSB,每组6个重复,每个重复1只羊。CON组在屠宰前3 h腹腔注射无菌生理盐水,其余各组腹腔注射100 μg/kg BW 055∶B5型LPS。预试期7 d,正试期28 d。试验期间于每日07:00和17:00饲喂等量的饲粮,羔羊自由饮水和采食。试验第28天,从每组中选取3只羔羊进行屠宰。
1.3 试验饲粮
为满足断奶羔羊的营养需要,按照《肉羊饲养标准》(NY/T 816—2004)配制不含抗生素的基础饲粮,其组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)
1.4 样品采集
于试验第28天,在羔羊屠宰前进行颈静脉采血,室温下3 000 r/min离心10 min,-80 ℃保存待测。沿腹部中线快速切开腹腔,用棉线结扎断奶羔羊小肠和大肠交界处。取小肠组织中段,立即用冰磷酸盐缓冲液冲洗3次。将肠道组织保存在4%多聚甲醛中,用于肠道组织形态分析。
1.5 指标测定及方法
1.5.1 生长性能
每天准确称量羔羊的投喂量和剩料量,于试验第28天对羔羊进行空腹称重(LPS刺激前),计算平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。计算公式为:
ADG=(末重-始重)/试验天数;ADFI=总采食量/试验天数;F/G=ADFI/ADG。
1.5.2 血清促炎性细胞因子
用酶联免疫吸附试验(ELISA)试剂盒测定血清中炎性细胞因子——肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-8(IL-8)和白细胞介素-10(IL-10)的含量,试剂盒由艾莱萨生物科技有限公司提供。用iMark酶标仪(Bio-Rad,美国)检测在450 nm处的吸光度。
1.5.3 肠道通透性
按生产厂家提供的方法,用商品试剂盒(艾莱萨生物科技有限公司)测定血清中D-乳酸(DLA)含量和二胺氧化酶(DAO)活性。
1.5.4 肠道组织形态
为了确定肠道组织形态,将组织样品脱水并用石蜡包埋,然后切成6 μm厚度,并用苏木精和曙红染色。使用光学显微镜系统(Olympus Corporation,日本)观察组织切片。用ImagePro plus 6.0测定肠绒毛高度(绒毛顶端至绒毛与隐窝交界处)和隐窝深度(肠绒毛交界处至肠腺底部的垂直距离),并计算绒毛高度/隐窝深度。
1.6 数据分析
使用SAS 9.2软件的GLM程序进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较。试验结果均以平均值±标准误表示,P<0.05为差异显著。
2 结 果
2.1 CSB对断奶羔羊生长性能的影响
由表2可知,与CON组相比,饲粮中添加CSB可显著提高断奶羔羊的ADFI(P<0.05),CSB3L组ADG显著高于CON和LPS组(P<0.05),CSB2L组ADG与其他各组无显著差异(P>0.05)。各组间的F/G差异不显著(P>0.05)。
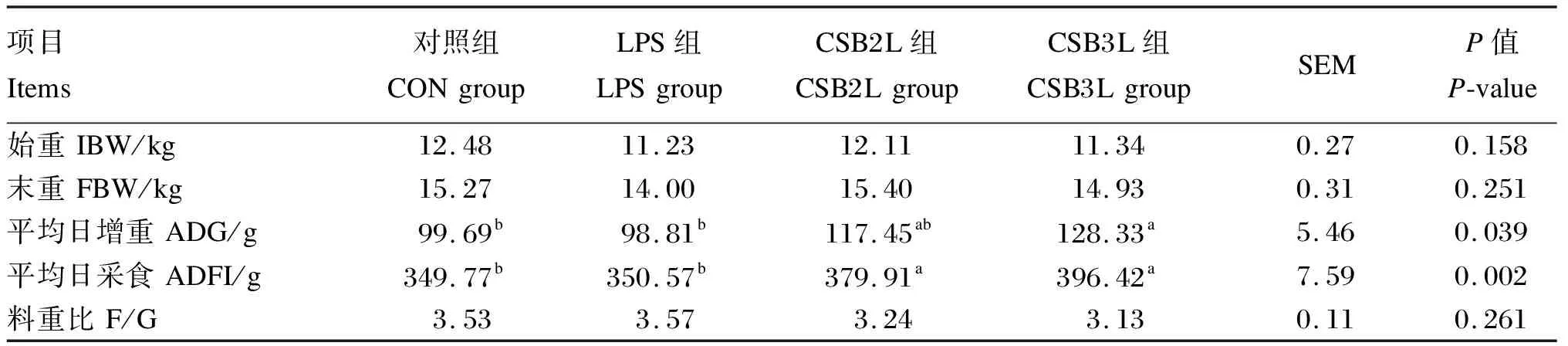
表2 CSB对断奶羔羊生长性能的影响
2.2 CSB对LPS刺激下断奶羔羊血清炎性细胞因子含量的影响
由图1可知,断奶羔羊经LPS刺激后,血清中TNF-α、IL-1β和IL-8含量显著升高(P<0.05)。CSB2L和CSB3L组血清TNF-α和IL-1β含量均低于LPS组(P<0.05),血清TNF-α含量显著高于CON组(P<0.05)。CSB3L组血清IL-8含量显著低于LPS组(P<0.05),CSB2L组血清IL-8含量与各组差异均不显著(P>0.05)。与CON组相比,LPS组血清中IL-10含量无显著差异(P>0.05),CSB2L和CSB3L组血清IL-10含量显著高于LPS组(P<0.05)。CSB2L和CSB3L组间血清炎性因子含量无显著差异(P>0.05)。

数据柱形标注不同小写字母表示差异显著(P<0.05)。图2同。
2.3 CSB对LPS刺激下断奶羔羊肠道通透性的影响
由图2可知,断奶羔羊血清中DLA含量和DAO活性在LPS刺激下显著升高(P<0.05)。饲粮中添加2和3 g/kg CSB可显著降低LPS注射后断奶羔羊血清DLA含量和DAO活性(P<0.05)。CSB2L和CSB3L组间断奶羔羊血清DLA含量和DAO活性差异不显著(P>0.05)。

图2 CSB对LPS刺激下断奶羔羊肠道通透性的影响
2.4 CSB对LPS刺激下断奶羔羊肠道组织形态的影响
染色观察各组断奶羔羊小肠组织形态(图3),CON组肠黏膜形态结构完整且绒毛排列整齐;注射LPS后,十二指肠有轻微水肿,空肠和回肠绒毛排列紊乱,高矮不一,绒毛呈现出变短且略微肿胀、脱落现象;CSB2L和CSB3L组空肠和回肠绒毛形态较完整且排列整齐,肿胀程度降低,上皮轻度脱落。
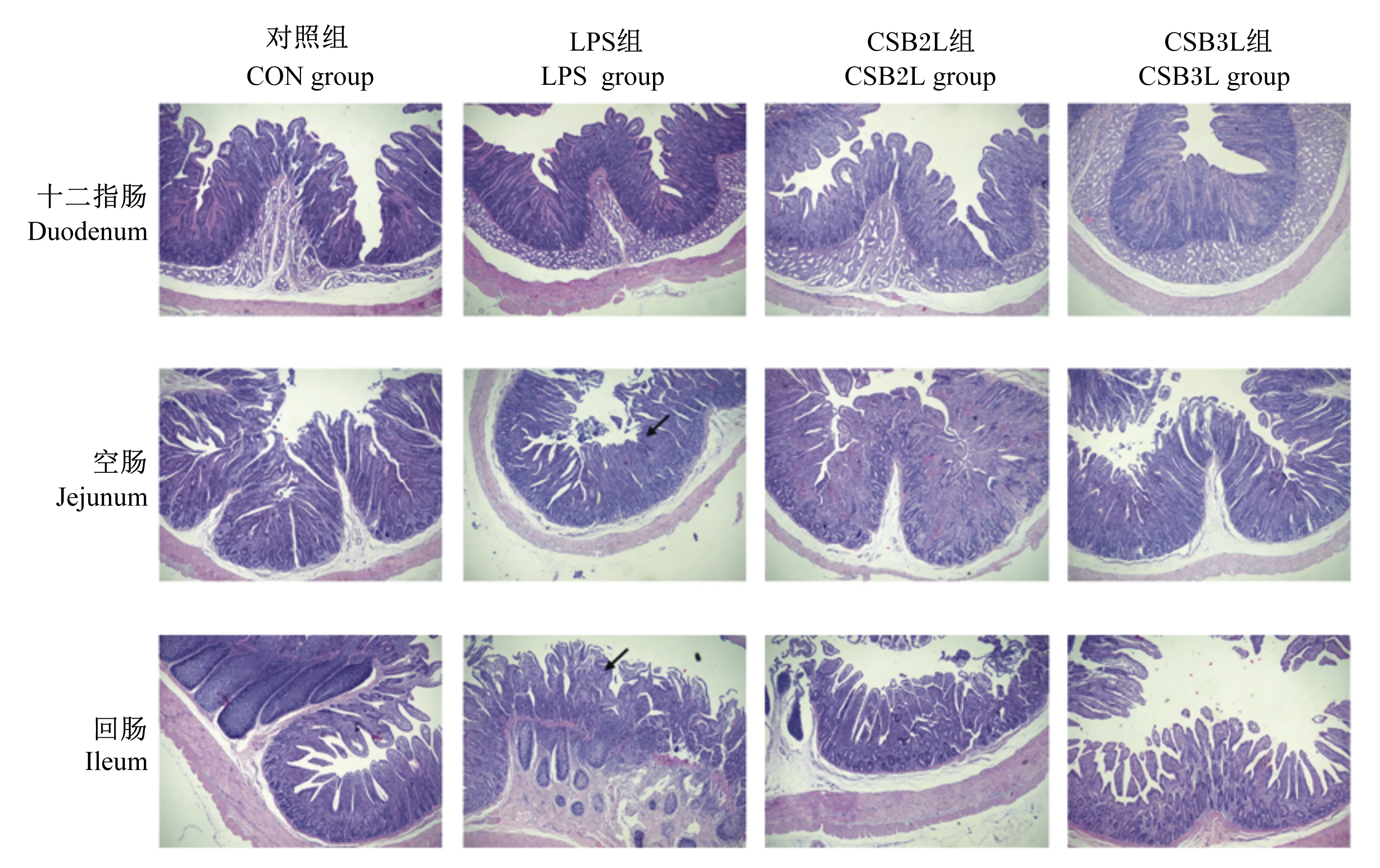
图3 断奶羔羊小肠组织形态
盲肠和结肠形态如图4所示,CON组肠组织整体结构正常,肠绒毛排列较整齐。LPS组盲肠部分肠绒毛上皮脱落,腺体排列紊乱,结肠绒毛略微脱落。CSB2L组盲肠和结肠有轻微水肿,CSB3L组盲肠和结肠绒毛上皮未见明显脱落和水肿。
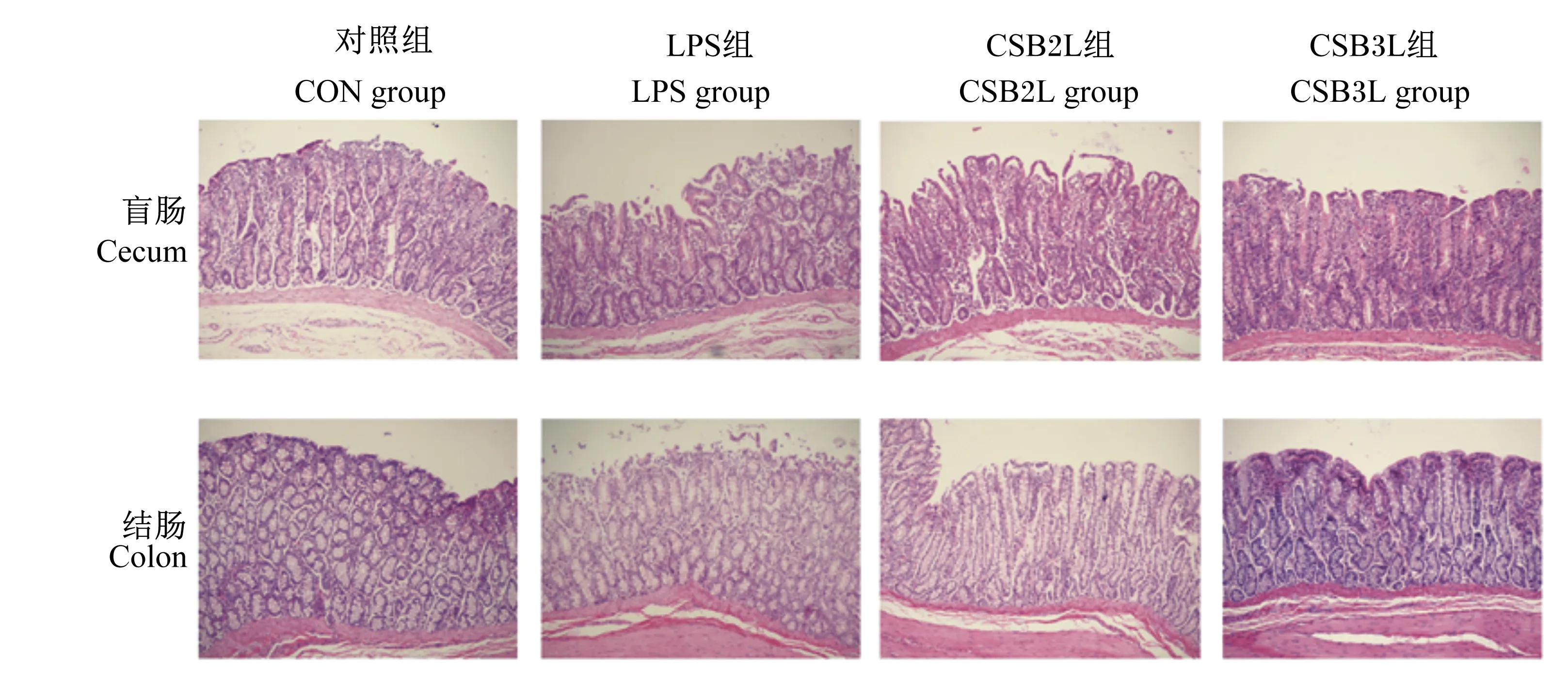
图4 断奶羔羊盲肠和结肠组织形态
由表3可知,与CON组相比,LPS刺激显著降低了空肠和回肠绒毛高度和绒毛高度/隐窝深度(P<0.05),对十二指肠绒毛高度和绒毛高度/隐窝深度无显著影响(P>0.05),且对小肠各肠段隐窝深度均无显著影响(P>0.05)。与CON组相比,饲粮中添加CSB后,空肠和回肠绒毛高度降低和绒毛高度/隐窝深度降低均得到缓解(P<0.05)。CSB2L和CSB3L组十二指肠绒毛高度显著高于CON组和LPS组(P<0.05),CSB3L组回肠绒毛高度和绒毛高度/隐窝深度显著高于CON组(P<0.05),而CSB2L组回肠绒毛高度、隐窝深度和绒毛高度/隐窝深度与CON组均无显著差异(P>0.05)。
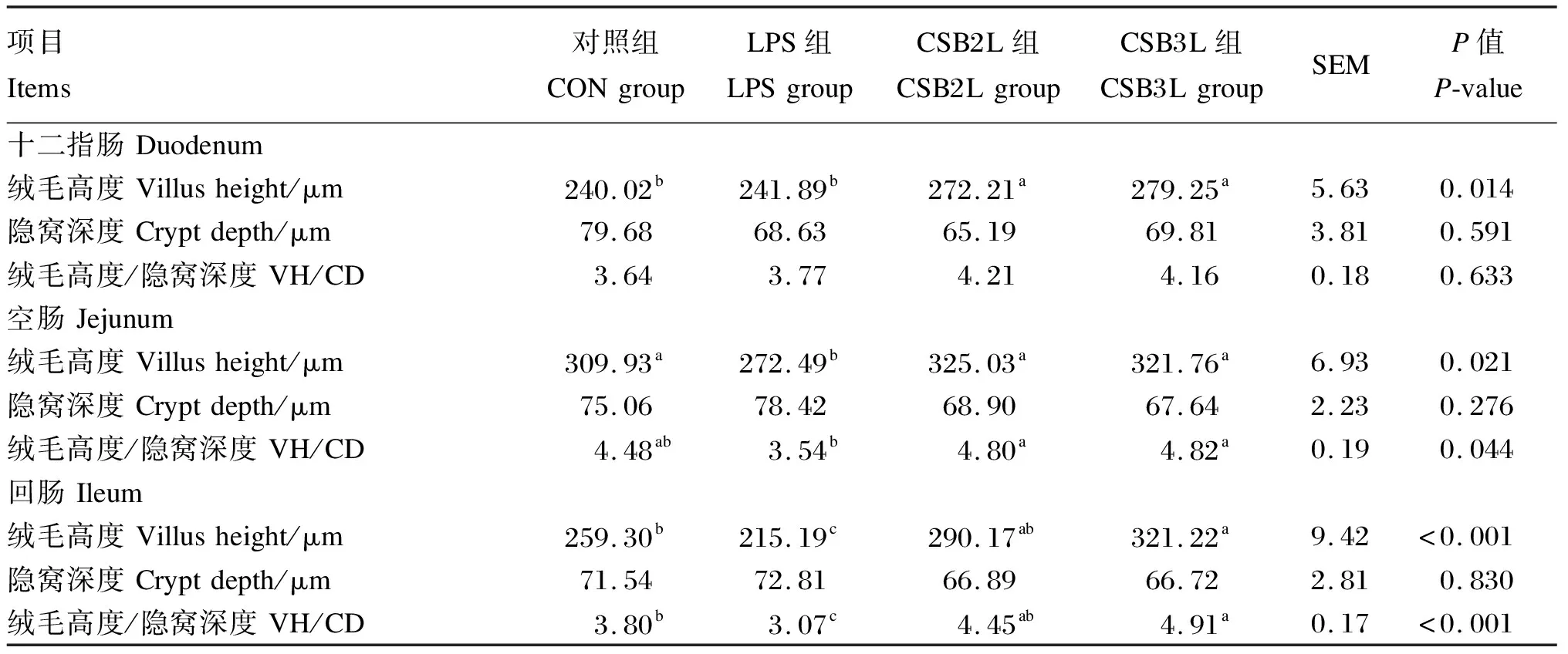
表3 CSB对LPS刺激下断奶羔羊肠道组织形态的影响
3 讨 论
SB作为一种饲料添加剂在动物饲粮中广泛应用。熊海涛[11]研究发现,在饲粮中添加2 g/kg的SB可以提高仔猪的ADG和ADFI。邴新帅等[6]研究也证实,在饲粮中添加0.5%的CSB可以显著提高羔羊的ADG。本试验研究发现,在饲粮中添加CSB可显著提高羔羊的ADFI,且添加3 g/kg的CSB可显著提高羔羊的ADG,但对F/G无显著影响,这与上述结果基本一致。SB有一种脂臭味,而CSB可以掩盖这种异味并促进动物采食量的增加,进而促进羔羊的生长发育。在转录组学水平上研究发现,丁酸可以促进绵羊小肠葡萄糖摄取和糖酵解途径上调以及线粒体功能相关基因的表达[12]。丁酸可以促进营养物质在肠道的吸收,进而促进肠道营养物质代谢相关基因的表达,使羔羊的生长性能得到提高。
在本试验中,LPS注射后,断奶羔羊表现出精神沉郁、站立不稳、腹腔内腹水等情况。LPS是位于革兰氏阴性菌细胞壁最外层的类脂多糖,可直接或间接诱导细胞凋亡调控机体免疫反应,当机体受到LPS等微生物抗原的刺激时会刺激体内巨噬细胞、单核细胞和内皮细胞释放一系列细胞因子、氧自由基和组胺等炎性介质等引起炎症反应,降低屏障功能[13-14]。经典的LPS细胞因子级联系统包括IL-1β和TNF-α等,TNF-α能够激活中性粒细胞和淋巴细胞,是炎症反应过程中出现最早、最重要的炎性介质,参与核转录因子-κB(NF-κB)的活化和程序性细胞凋亡过程,且与诱导型一氧化氮合成酶的上调有关,可促进一氧化氮的生成,在机体的免疫应答过程中发挥重要的作用[15-16]。IL-1β可由单核细胞和巨噬细胞释放,在炎症反应过程中IL-1β最初以前体形式产生,响应Toll样受体配体,并通过炎性小体成熟进而调控炎症[17]。IL-8是一种多细胞来源的细胞因子,在细胞的多种炎症反应中起调节作用[18]。IL-10是由巨噬细胞分泌的一种抗炎细胞因子,能够通过阻止NF-κB的活化来抑制其他炎性细胞因子的产生[19]。众多研究表明,SB能够缓解炎症反应。Zhang等[20]研究表明,LPS应激可显著升高肉鸡血清IL-1β、IL-6和TNF-α含量,饲粮中补充SB可抑制血清中IL-6和TNF-α含量的升高。饲粮中补充SB可显著降低葡聚糖硫酸钠模型肉鸡血清中IL-1β含量,升高IL-10含量[21]。有研究表明,大肠杆菌攻毒能够显著升高仔猪血清中促炎性细胞因子的水平,饲喂SB可以缓解这一现象[11]。SB能够抑制LPS诱导的炎症反应引起的促炎性细胞因子含量的升高[22-23]。本试验结果显示,LPS刺激能使断奶羔羊血清中促炎性细胞因子TNF-α、IL-1β和IL-8含量上升,CSB2L和CSB3L组能抑制血清TNF-α、IL-1β和IL-8含量上升,促进IL-10含量升高。这表明饲粮中添加CSB可缓解LPS激发断奶羔羊产生的炎症反应。原因可能是CSB水解的丁酸可以通过抑制LPS诱导的NF-κB通路的活性,进而抑制促炎性细胞因子的释放缓解炎症反应。
保持肠道的完整性和功能性是维持肠道发挥正常屏障功能的前提,小肠受到损伤会引起肠上皮细胞数量下降,肠道通透性增加。DLA主要是乳酸杆菌、大肠杆菌等肠道细菌的代谢和裂解产物。由于哺乳动物体内不具有直接分解DLA的D-乳酸脱氢酶,当机体发生严重创伤、感染后引起肠黏膜缺血缺氧时,DLA可在肠黏膜受损早期透过肠黏膜进入血门静脉循环,引起DLA含量上升[24-25]。DAO是一种含有脱氨的腐胺和组胺的有较高活性细胞内酶,大约有95%存在于哺乳动物小肠黏膜和柱状上皮细胞中,其活性与肠绒毛高度和黏膜细胞内核酸蛋白的合成有关,当肠黏膜屏障受损时,其进入血液和淋巴导致其在血液中的活性升高[26-28]。因此,检测外周血中DLA含量和DAO活性可反映肠黏膜损伤、修复和通透性变化情况。有研究表明,适当浓度的丁酸盐能够保护单层细胞不被破坏,改善肠屏障的功能[29]。Zou等[21]研究发现,补充300 mg/kg SB可显著降低葡聚糖硫酸钠模型肉鸡血清中DLA含量。本试验结果显示,LPS刺激可以使断奶羔羊血清DLA含量和DAO活性上升,说明LPS刺激破坏了肠道屏障,但饲粮中添加CSB可以缓解肠道通透性的升高。这可能是由于SB可以通过促进小肠黏膜紧密连接蛋白的表达,抑制炎性细胞因子的表达,从而降低对肠道黏膜屏障的损伤。此外,有研究表明,SB可以通过与细胞表面的G蛋白偶联受体结合激活调控免疫反应的信号转导途径维护肠道屏障功能[30]。本研究表明,CSB能够降低LPS诱导的断奶羔羊血清TNF-α和IL-1β的释放,并进一步验证了其可对肠道通透性的改变产生积极影响,然后通过染色从病理形态学角度探讨了CSB对肠道形态的改善作用。
有研究表明,在饲粮中添加CSB可降低坏死性结肠炎模型组肉鸡肠道病变评分,能够减轻肉鸡坏死性肠炎[31]。Dou等[32]研究发现,口服丁酸钠可减轻小鼠结肠炎的严重程度。在本试验中,通过组织切片观察可知LPS组回肠和盲肠绒毛脱落、水肿且伴有炎性细胞浸润增加(如图3黑色箭头所示)。而CSB2L和CSB3L组肠绒毛损伤较轻,说明CSB能够减轻LPS对肠黏膜的刺激,对肠绒毛的完整性起到一定的保护作用,使断奶羔羊在应激情况下能够缓解肠黏膜损伤。但是,从切片来看LPS刺激对回肠损伤更为严重,盲肠和结肠损伤较小。可能是由于LPS刺激时间较短或剂量较小。也可能是由于后肠道含有大量微生物,具有更有效的杀灭移位细菌的能力。此外,与小肠相比,结肠具有更高的电阻,对离子被动运动的渗透性较低[33]。先前有研究表明,一氧化氮合酶的基因表达沿着肠的纵轴存在差异性调节,其中在回肠中最为突出[34]。有报道表明,回肠对LPS更敏感,回肠细菌移位发病的阈值比结肠低[35-36]。
小肠的绒毛高度、隐窝深度及绒毛高度/隐窝深度是评价动物消化道对养分消化吸收的重要指标。肠绒毛高度越大表明肠上皮细胞发育越好,绒毛高度影响养分吸收能力的强弱,相反,隐窝深度越浅表明肠上皮细胞成熟率越高。绒毛高度/隐窝深度降低表明吸收功能受到损伤,进而导致腹泻的可能性增加[37]。徐磊[38]研究发现,内源性LPS的产生可导致奶牛瘤胃和盲肠出现炎性损伤,上皮完整性遭到破坏。此外,有研究发现LPS刺激会引起肠道损伤,导致小肠绒毛高度下降,隐窝深度变大,二者比值下降[39-41]。短链脂肪酸已被证明可以为肠上皮细胞提供最直接、最有效的能量物质,促进肠上皮细胞分化和增殖,有效维持肠道形态。邴新帅[6]研究表明,饲粮中添加0.5%的CSB可以提高断奶羔羊小肠绒毛高度和绒毛高度/隐窝深度。Wang等[42]研究表明,饲喂SB提高了断奶仔猪的空肠绒毛高度和绒毛高度/隐窝深度。本试验结果表明,饲喂CSB能够抑制LPS刺激引起的小肠绒毛高度及绒毛高度/隐窝深度的降低,与上述报道结果相一致。因此,SB对肠黏膜的免疫屏障的保护作用对于减少机体炎症反应的发生、维护机体免疫平衡起着重要的作用,可能原因如下:1)CSB在肠道内水解成丁酸,不仅可以为肠上皮细胞提供能量促进肠上皮细胞的增殖分化,而且作为营养活性物质可以促进肠上皮组织中生长因子的表达,促进小肠的成熟速度及肠上皮对营养物质的吸收。2)有研究表明,肠道内短链脂肪酸含量升高可下调消化道上皮中胰岛素结合蛋白3的基因表达,进而促进胰岛素样生长因子1的表达量增加,可促进肠上皮细胞的生长[43]。3)SB能够使细胞线粒体免受LPS刺激引起氧化应激造成的损伤,进而抑制肠上皮细胞凋亡速率,进而维护肠黏膜的完整性。4)丁酸抑制LPS与Toll样受体结合,抑制炎性细胞因子产生。炎性细胞因子的释放减少会导致小肠绒毛脱落和屏障功能受损程度降低[44]。此外,我们还需要进一步对肠道基因及肠道微生物的表达情况进行研究,以探讨其机制。
4 结 论
饲粮中添加3 g/kg的CSB可显著提高羔羊的ADG。添加2种剂量的CSB均可抑制LPS刺激引起的血清促炎性细胞因子含量的升高,改变肠道通透性,并在一定程度上改善肠道组织形态,减少肠道损伤,缓解应激并改善肠道健康。综合来看,2和3 g/kg的CSB对LPS刺激下羔羊的影响基本一致。
