亚急性瘤胃酸中毒对反刍动物瘤胃生理功能及物质吸收转运的影响
2021-03-03姜雅慧张雅岚王之盛
姜雅慧 代 鹏 张雅岚 王之盛*
(1.四川农业大学动物科技学院,成都 611130;2.四川农业大学动物营养研究所,成都 611130)
为提高反刍动物的生产性能以及获得最大的经济产出,反刍动物饲喂大量以谷物淀粉为主要能量饲料的高精料饲粮。反刍动物大量采食富含快速发酵的碳水化合物饲粮后会引起瘤胃挥发性脂肪酸(volatile fatty acid,VFA)蓄积,瘤胃液pH降低,瘤胃菌群紊乱,引发亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)。瘤胃酸中毒的发生不仅会影响反刍动物的采食量和动物副产品如肉、奶的产出量,而且会打破瘤胃微生物区系间的平衡而使反刍动物对饲料的消化和营养物质代谢减弱,并伴随有腹泻、消化道损伤和炎症、肝脏脓肿、蹄病以及乳脂下降综合征等病征[1]。Stefańska等[2]对波兰9个牛场213头奶牛检测发现约14%奶牛患有SARA。我国在育肥牛、羊和奶牛养殖中SARA发病率在19%~26%,严重制约了我国反刍动物养殖业的发展[3]。瘤胃上皮不仅是反刍动物营养物质消化吸收的重要部位,还是瘤胃微生物附着、生长以及瘤胃微生物代谢的主要部位,瘤胃上皮的结构完整性以及功能的保护对于反刍动物健康养殖至关重要。本综述从生产中常见的营养代谢疾病SARA入手,围绕反刍动物瘤胃上皮结构、功能以及上皮细胞中参与物质转运相关载体等进行综述,以期对反刍动物SARA的调控提供理论基础和技术支持。
1 SARA状态下瘤胃发酵模式及瘤胃菌群的变化
1.1 瘤胃发酵模式变化
Gozho等[4]定义反刍动物瘤胃液pH下降至5.6以下并持续3 h以上则处于SARA状态。在相同饲粮和同一饲养管理方式下,不同牛只对SARA的敏感性不同[5],反刍动物减少咀嚼和反刍时间导致唾液分泌量降低,进而增大牛只患SARA的风险。Nagata等[6]通过饲粮诱导荷斯坦公牛SARA后发现,饲喂高谷物饲粮会导致瘤胃液pH急剧下降,瘤胃内VFA和氨态氮浓度升高,乙酸比例降低,而丁酸比例升高。SARA会改变瘤胃发酵模式和VFA的产量,降低乙酸/丙酸,瘤胃中乙酸/丙酸由3.07下降到1.74,瘤胃中脂多糖(LPS)含量升高[2,7]。SARA耐受性高的山羊瘤胃对丁酸、酮体和质子的转运速率更快,进而改变血液代谢通量[8],SARA还会改变瘤胃中硫胺素浓度,瘤胃中硫胺素浓度与瘤胃液pH和乙酸浓度呈正相关,而与瘤胃中乳酸浓度呈负相关[9]。
1.2 瘤胃菌群的变化
Mao等[10]对患SARA奶牛微生物区系分析发现,SARA会降低瘤胃微生物的多样性,从门水平上看,SARA会降低变形菌门和拟杆菌门丰度,而厚壁菌门和放线菌门丰度有所增加;从属水平分析,奶牛患SARA后,瘤胃中普雷沃菌属、厌氧支原体属、密螺旋菌属、不动杆菌属、乳酸杆菌属和一些未分类的细菌丰度降低,而瘤胃中球菌属、奇异菌属、双歧杆菌丰度升高。SARA会改变瘤胃中普雷沃菌属和乳酸杆菌属数量,也会改变瘤胃固相微生物区系结构[11]。高谷物组牛瘤胃内普雷沃菌属、真杆菌属和颤螺旋菌属丰度低于高粗料组,而瘤胃球菌属丰度则相反[6]。随瘤胃内pH降低,瘤胃内真杆菌属和未分类梭菌科(unclassified Clostridiaceae)的丰度逐渐降低,但随着SARA的反复发生会引起瘤胃部分微生物如真杆菌属和unclassified Clostridiaceae的丰度逐渐增加,但具体机制尚需进一步研究[6]。反刍动物处于SARA状态下会抑制瘤胃中纤维的降解并伴随着瘤胃内参与纤维降解的白色瘤胃球菌和产琥珀酸丝状杆菌的丰度降低,而普雷沃菌属、乳酸菌属、埃氏巨球型菌属的丰度增加。SARA还会严重抑制瘤胃内甲烷的产生,但对瘤胃内产甲烷菌无影响[12]。Plaizier等[13-14]通过诱导奶牛发生SARA后比较其瘤胃内微生物区系变化发现,SARA会改变瘤胃内微生物的丰度、多样性和稳定性,饲粮中增加谷物含量会降低瘤胃中拟杆菌的丰度,SARA会增加瘤胃内埃氏巨型球菌属和厚壁菌门数量,瘤胃微生物90个分类单元中有9个分类单元也受SARA的影响。通过对比围产期前后SARA对荷斯坦奶牛影响研究中发现,SARA并不是引起瘤胃内微生物区系的直接原因,而可能通过对微生物区系在瘤胃中参与的功能途径改变来影响微生物区系的丰度和多样性[15]。SARA会改变瘤胃微生物区系丰度和多样性,但是否直接影响瘤胃微生物的生长以及与外界环境和动物生理状态的相互影响还有待探究。
2 SARA对瘤胃上皮细胞形态结构和功能的影响
2.1 瘤胃上皮细胞生长和形态结构变化
瘤胃上皮由黏膜向浆膜面分为角质化细胞层、颗粒层细胞、棘状细胞层和基底层。反刍动物瘤胃内VFA的积累会诱发SARA的发生,SARA会导致瘤胃上皮细胞损伤[16]。早期,Nocek等[17]研究表明精粗比太高会使瘤胃乳头形态异常。近年研究也表明,SARA可使瘤胃壁黏膜出现不同程度的脱落,使瘤胃上皮基底层、颗粒层、棘突层和瘤胃上皮变薄,上皮细胞间紧密连接结构变得松弛[16,18-20]。SARA会使瘤胃上皮角质层变厚,棘状层细胞线粒体出现降解并出现空泡,各层细胞如角质层、颗粒层、棘状层和基底层细胞甚至出现损伤和坏死,细胞间连接破坏,细胞间隙增大,棘突层出现气泡,线粒体降解,细胞界限模糊,上皮细胞通透性增加[20-23]。邬宇航[24]通过分子水平检测发现SARA会使瘤胃上皮细胞微绒毛排列不整齐,线粒体肿胀,染色质边集化,并出现较多的凋亡小体,抑制瘤胃上皮细胞增殖。短链脂肪酸会上调瘤胃上皮细胞中细胞周期蛋白依赖性激酶抑制剂1A,引起细胞周期蛋白依赖性激酶和周期蛋白的表达降低,使瘤胃上皮细胞从G1期到S期受阻,抑制瘤胃上皮细胞生长,但短链脂肪酸(short-chain fatty acids,SCFA)对瘤胃上皮细胞增殖影响的详细机制还需进一步探究[25]。
2.2 瘤胃上皮屏障功能
瘤胃的黏膜屏障由瘤胃上皮细胞及其连接所组成的机械屏障、化学屏障、生物屏障及免疫屏障组成[26]。瘤胃上皮屏障能有效抵挡瘤胃中产生的有害物质如组胺、内毒素等进入机体组织,同时又可允许营养物质、水等进入机体。瘤胃上皮通透性是反映瘤胃上皮屏障功能最直接的标志,屏障功能受损则瘤胃上皮通透性升高。饲粮在瘤胃内快速发酵引起瘤胃内VFA积累,长期低pH的酸性环境刺激会改变瘤胃上皮细胞的组织结构形态,瘤胃上皮紧密连接蛋白降解或其在瘤胃上皮细胞上的表达分布改变,细胞连接破坏,上皮细胞各部分受损,影响瘤胃的屏障功能,导致有害物质如LPS、内毒素等通过细胞进入血液,引起动物机体炎症反应或诱发系列疾病[27-28]。Penner等[29]研究表明,在低pH时会使瘤胃上皮组织结构改变,血液渗透压升高,上皮细胞屏障功能受损;另外,短暂瘤胃酸中毒可能不影响上皮细胞屏障功能,但长期低pH刺激下,瘤胃上皮通透性增加,使其屏障功能减弱。刘军花[21]还进一步验证了SARA影响瘤胃屏障的具体机制,发现SARA可以激活丝裂原活化蛋白激酶(MAPK)/细胞外信号调节蛋白激酶1/2(ERK1/2)信号通路,低pH和LPS含量会提高ERK1/2磷酸化比例,引起瘤胃上皮细胞紧密连接蛋白表达下降,进而影响瘤胃上皮屏障功能。利用尤斯室法研究SARA对细胞屏障功能的影响发现,SARA会增强瘤胃上皮细胞组织的导电性能,降低单位时间通过上皮组织的电荷流量,进而影响瘤胃细胞屏障功能[29]。SARA会引起瘤胃上皮细胞的短路电流、组织导电性升高,而跨膜电位差则降低[18,20]。但在,Aschenbach等[30]和Penner等[29]分别以体外调节环境酸度和灌注葡萄糖诱导SARA发现,组织导电性增加,但短路电流降低。综上可知,SARA会以破坏上皮细胞组织结构和导电性使瘤胃上皮细胞屏障功能受损,改变瘤胃上皮对LPS、内毒素等的屏障隔离作用。
3 SARA对瘤胃上皮细胞物质转运及相关载体表达的影响
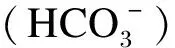
4 SARA引起瘤胃内代谢异常反应
刘军花[21]对山羊诱导SARA发现,SARA会激活瘤胃上皮免疫反应,引发瘤胃上皮细胞炎症反应。张瑞阳[38]通过代谢组学研究发现,高精料诱发奶牛SARA会导致瘤胃中LPS、乙醇胺、生物胺和戊二酸等异常代谢物或促炎物含量增加,通过基因芯片技术研究分析,促炎症相关因子白细胞介素-1β(IL-1β)、白细胞介素-2(IL-2)、白细胞介素-22(IL-22)、趋化因子CCL19、趋化因子CCL8、趋化因子CX3C受体1(CX3CR1)和CXC趋化因子配体6(CXCL6)等的表达量显著上调,抗炎症因子如白细胞介素-6(IL-6)和白细胞介素-15受体拮抗剂(IL-15RA)的表达量显著下调,表明SARA触发了瘤胃上皮局部炎症反应,并且瘤胃上皮炎症因子与瘤胃环境因子(pH和LPS)存在相关性,LPS会使瘤胃上皮细胞中IL-1β、IL-2、IL-6和白细胞介素-8(IL-8)的表达量显著上调,而低pH会提高瘤胃上皮细胞肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的表达量。Zhang等[39]通过对比饲喂高精料和低精料饲粮奶牛瘤胃上皮细胞中炎症相关基因表达,也发现促炎症相关因子表达上调,而且LPS促使瘤胃上皮细胞中IL-1β、IL-2、IL-6和IL-8的表达量升高,同时低pH处理会使TNF-α的表达升高。Stefanska等[40]通过分析来自13个牧场的305头泌乳奶牛瘤胃液pH、瘤胃内发酵产物和瘤胃内毒素含量以及相关基因表达,发现白细胞中LPS受体功能相关基因[如白细胞分化抗原14(CD14)、Toll样受体4(TLR4)、髓样分化蛋白2(MD2)]的mRNA相对丰度出现差异,而且酸中毒组与健康组奶牛相比,血液中的高密度脂蛋白、血清淀粉样蛋白A、钙和结合珠蛋白含量均出现显著差异,以及LPS结合蛋白含量也有显著差异。同时,瘤胃pH与LPS受体功能相关基因表达量以及血浆高密度脂蛋白含量有负相关性,而与血浆钙含量有正相关性,表明降低瘤胃液pH会增加瘤胃中LPS的释放并激发LPS相关受体的表达和相应的免疫反应,进而导致血浆高密度脂蛋白含量升高,血浆Ca含量降低。
发生SARA的牛只瘤胃上皮细胞中核转录因子-κB p65(NF-κB p65)、核因子转录-κB抑制蛋白α(IκB-α)和氨基末端激酶(c-jun N-terminal kinase,JNK)以及EKB1/2的磷酸化水平显著高于正常生理状态牛只,发生SARA的牛只瘤胃上皮细胞中核转录因子-κB(NF-κB)、MAPK调控的炎症因子、TNF-α、IL-6和IL-1β的mRNA和蛋白表达量均高于正常牛只,同样发生SARA的牛只血浆中TNF-α和IL-6含量也显著升高[41]。SARA发生可以产生溶血磷脂酸(LPA)和组胺等异常代谢产物,这些产物能作为信号分子激活NF-κB和MAPK信号通路,通路中的关键蛋白如IκBα、NF-κB p65、JNK和ERK1/2磷酸化水平增高,进一步诱导促炎症因子靶基因转录,增加了促炎症因子表达,引发瘤胃上皮及其他相关组织炎症反应。
5 小结与展望
反刍动物发生SARA,会改变瘤胃发酵模式,降低乙酸/丙酸,瘤胃内LPS含量增加,瘤胃内微生物区系的稳定性和多样性也会发生改变。对于瘤胃上皮细胞而言,会破坏其结构的完整性,主要表现为细胞间连接破坏、各层细胞厚度发生改变以及细胞通透性增加,导致瘤胃上皮屏障功能受损。瘤胃上皮细胞对营养物质吸收、转运和代谢发生改变。同时患SARA会诱发瘤胃上皮细胞的局部炎症反应,激活瘤胃上皮细胞免疫反应,引起上皮细胞中炎症相关基因表达变化。瘤胃上皮细胞中营养物质的吸收、转运和代谢过程以及引发的炎症反应受多种调控因子的影响,这些因子还参与瘤胃上皮细胞的增殖调控,调控因子可以通过不同信号通路影响瘤胃结构和功能。反刍动物发生SARA后,瘤胃上皮细胞调控因子受哪些信号通路调控以及具体的调控机制还需深入研究,以明确SARA对反刍动物生产性能影响的具体机制,便于饲养管理者在生产实践中进行理论指导,最大程度减少和避免SARA发生对动物生产带来的损失。
