伴刀豆球蛋白A诱导肝细胞损伤的磷酸化蛋白质组学研究
2021-03-03杨卓一白思益帕梅拉帕尔哈提侯敬丽袁运生
杨卓一,陈 会,白思益,帕梅拉·帕尔哈提,侯敬丽,袁运生
1.上海交通大学药学院细胞工程及抗体药物教育部研究工程中心,上海200240;2.上海交通大学分析测试中心,上海200240
蛋白质的翻译后修饰(post translational modifications,PTM)广泛存在所有生物体内。人和动物体内的蛋白翻译后修饰,如蛋白的糖基化、泛素化、乙酰化和磷酸化等对于调控蛋白质的功能、活性和稳定性等方面发挥着重要的作用[1]。其中,蛋白的磷酸化修饰是最早发现的蛋白翻译后修饰之一,通过体内的蛋白激酶和蛋白去磷酸化酶系统进行调控;蛋白磷酸化水平的改变直接影响细胞内信号转导网络的功能,并参与调控功能蛋白的泛素化修饰来间接调控蛋白质的稳定性[2-3]。在人和动物体内,苏氨酸、丝氨酸和酪氨酸是最常见的磷酸化氨基酸,细胞中它们各自被磷酸化的比例分别为84%、15%、<1%[4]。肝脏是人体能量代谢、维持生命活动的重要器官[5],已有文献[6]报道蛋白质磷酸化修饰在影响肝功能、肝细胞再生以及肝细胞癌方面具有重要作用。酪氨酸磷酸化在肝再生中对细胞内途径进行调节;肝部分切除(partial hepatectomy,PH)后,雷帕霉素可降低肝增殖速率[7]、增加肝细胞凋亡的速率[8];磷脂酰肌醇3-激酶/蛋白质丝氨酸苏氨酸激酶(phosphatidylinositol-3-kinase/protein-serine-threonine kinase,PI3K/AKT)途径在肝癌中被广泛研究。上述这些都说明蛋白质磷酸化修饰在肝病研究中的重要意义。
小鼠静脉内注射植物凝集素伴刀豆球蛋白A(concanavalin A,ConA)是广泛使用的急性免疫介导的肝炎模型[9],ConA 可以通过激活T 淋巴细胞诱导特定的急性肝损伤。由于T 细胞免疫[10-11]的参与,且与人类自身免疫性肝炎的相似性,该模型也被认为是人类自身免疫性肝炎的良好模型。近年来已有很多研究者采用ConA诱导的肝损伤模型对肝细胞再生等进行研究,但ConA 诱导的肝损伤模型的蛋白质磷酸化组学研究还未见报道。本研究建立ConA 诱导的肝实质细胞AML12 细胞的损伤模型,通过液相-质谱联用的方式,采用非标定量法检测模型细胞中发生磷酸化修饰的蛋白,并寻找差异性调控的磷酸化修饰位点,以期为肝脏疾病的研究提供相关通路以及靶标信息。
1 材料与方法
1.1 主要试剂和仪器
小鼠正常肝细胞AML12细胞株(中国科学院细胞库)。DME/F12细胞培养基(HyClone,美国),胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗(Gibco,美国)。尿素、碳酸氢铵、二硫苏糖醇、碘乙酰胺、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、丙酮、脱氧胆酸钠(Na-deoxycholate)、3-[(3-胆酰胺丙基)‐二甲氨基]‐丙磺酸{3‑[(3-cholamidopropyl)‑dimethylammonio]-1-propanesulfonate,CHAPS} 均购自美国Sigma 公司。甲酸、乙腈、C18 微量层析柱(Thermo Fisher Scientific,美国)。支原体检测试剂盒(南京诺唯赞,中国),Bradford蛋白定量试剂盒(上海碧云天,中国),10 kD 超滤离心管(Sartorius,德国),胰蛋白酶(Promega,美国),二氧化钛(岛津,日本),脱氧胆酸钠(上海麦克林,中国),硒酸钠(中国医药集团,中国),转铁蛋白(上海源叶,中国),胰岛素(苏州礼来,中国),地塞米松(安徽丰原,中国)。接触式超声波破碎仪(Bio-Rad,美国),高速冷冻离心机和离心浓缩仪、纳升液相-四极杆超高分辨轨道阱质谱联用仪(Thermo Fisher Scientific,美国)。
1.2 方法
1.2.1 AML12 细胞培养及分组 AML12 细胞培养在含有10% FBS 的DME/F12 培养基中,添加1%青霉素-链霉素双抗、0.005 mg/mL 胰岛素、0.005 mg/mL 转铁蛋白、5 ng/mL 硒元素、40 ng/mL 地塞米松。培养条件为37 ℃、5% CO2、饱和湿度。建立肝损伤模型时,将细胞按每皿1×106个接种于6 个10 cm 培养皿,设置为对照组和ConA组,每组3个培养皿。于培养箱培养3 d,取20 μL培养基上清,用支原体检测试剂盒并按照说明书步骤进行检验。确认细胞无污染后,每盘ConA 组细胞中加入10 μg/mL ConA,对照组添加等体积的磷酸缓冲盐溶液,继续培养12 h 后消化收集细胞至15 mL 离心管,每管细胞数约为2×107个。将细胞转移至1.5 mL 离心管,冻存于-80 ℃冰箱备用。
1.2.2 蛋白质组样品制备 自细胞裂解液提取蛋白,每100 mL 添加4 mL Tris-HCl (1 mol/L,pH 7.4)、64 g 尿素、4 g CHAPS、1 mL 乙二胺四乙酸(100 mmol/L)、5 mL 乙二醇双(2-氨基乙基醚)四乙酸(10 mmol/L)。使用前按1∶100 加入磷酸酶抑制剂A 和磷酸酶抑制剂B、6.5 mL 二硫苏糖醇(1 mol/L)、1 mL 苯甲基磺酰氟(1 mol/L)。每管细胞样品加1 mL 细胞裂解液,于冰上用接触式超声波破碎仪低温裂解15 min。细胞破碎后于4 ℃离心机13 800×g 离心20 min 后取200 μL 上清液,向其中加入5 倍体积的蛋白沉淀剂,混合均匀,于-20 ℃沉淀过夜。次日取出样品于4 ℃、13 800×g 离心1 h,沉淀用90%丙酮洗3遍后继续离心10 min。将蛋白沉淀于室温晾10~15 min。沉 淀 干 燥 后 加 入100 mmol/L NH4HCO3、8 mol/L 尿素溶液重新溶解蛋白,并用Bradford 试剂盒测定蛋白浓度。取400 μg/200 μL 蛋白,每个样品3 管,总蛋白共1.2 mg,加入8 μL 1 mol/L 二硫苏糖醇,于37 ℃孵育1 h后,每管加入40 μL 1 mol/L碘乙酰胺,室温下避光孵育40 min。将蛋白转移到10 KD超滤管中,13 800×g、4 ℃离心30 min 后弃滤液。往超滤管中加入100 μL 50 mmol/L NH4HCO3,13 800×g、4 ℃离心20 min 后弃滤液,重复3 次。得到的蛋白按照酶和蛋白质量比1∶25 加入胰蛋白酶,于37 ℃酶解过夜。酶解的蛋白于4 ℃、13 800×g 离心20 min 后收集滤液,加入50 μL 50 mmol/L NH4HCO3,13 800×g、4 ℃离心20 min,并与上步滤液合并后,于35 ℃离心浓缩仪中干燥。3 管酶解的肽段分别用50 μL上样缓冲液溶解并合并成1管。
1.2.3 TiO2富集磷酸化肽段 多肽冻干后用100 μL 上样缓冲液(65%乙腈、2%三氟乙酸)溶解于1.5 mL 离心管中。 金属氧化物亲和色谱(metal oxide affinity chromatography,MOAC)珠(TiO2beads),用1 mL 上样缓冲液室温涡旋孵育20 min(多肽∶beads 的质量比为1∶2~1∶8)。4 ℃、1 000×g 离心,弃去上清液,加入第1 份新鲜的1 mL 活化的beads 溶液,室温涡旋30 min,收集上清液和beads。上清液加入第2 份新鲜的1 mL 活化的beads溶液,室温涡旋30 min,4 ℃、1 000×g离心,弃去上清液,收集beads,并与上步收集的beads合并。用800 μL冲洗缓冲液1(65%乙腈、0.5%三氟乙酸)洗涤beads,室温涡旋15~30 min,4 ℃、1 000×g离心,弃上清液;加入800 μL 冲洗缓冲液2(65%乙腈、0.1%三氟乙酸)洗涤beads,室温涡旋15~30 min,4 ℃、1 000×g 离心,弃上清液;加入300 μL洗脱缓冲液1(300 mmol/L NH4OH、50%乙腈),室温涡旋15~30 min,4 ℃、1 000×g 离心,取上清液;加入300 μL 洗脱缓冲液2 (500 mmol/L NH4OH、60%乙腈),室温涡旋15~30 min,1 000×g 离心取上清液,并与上步骤的上清液合并。合并的上清液于4 ℃、15 000×g 下离心10 min 后,于离心浓缩仪室温干燥,再用20 μL 0.1%甲酸水溶液重溶、脱盐、干燥。
1.2.4 纳升液相-四极杆超高分辨轨道阱质谱联用仪分析 富集的磷酸化样品用NanoLC-Oribtrap-MS 进行检测。脱盐后的样品用10 μL 0.1%甲酸溶液复溶,取9 μL 上机测试。液相色谱仪型号为Easy-nLC1200,色谱柱为75 μm×150 mm,3 μm particle C18 column 自制柱。流动相A 为0.1%甲酸水溶液;流动相B 为含0.1%甲酸的80%乙腈水溶液,流速为300 nL/min。采用120 min 梯度洗脱样品:0~3 min,2%~6% B;3~98 min,6%~22% B;98~108 min, 22%~32% B; 108~110 min, 32%~100%B;110~120 min,100%B。
四极杆超高分辨轨道阱质谱仪型号为Q-Exactive Plus。离子源为nano-ESI,喷雾电压1.8 kV,毛细管温度275 ℃。一级扫描的质荷比(m/z)范围为350~1 800,最大注入时间(maximum ion injection time,MIT)50 ms。选取丰度前20 的肽段进行二级碎裂(loop count=20,MSX count =1,TopN =20),碎裂模式为高能碰撞解离(high energy collisional dissociation,HCD),碰撞能量(normalized collision energy,NCE)设置为28。离子排除(charge exclusion):排除电荷数为1、7、8 以及大于8 的离子。动态排除时间30 s。
1.2.5 蛋白质数据库 原始数据用Proteome Discoverer 2.3(Thermo Fisher Scientific,美国)软件进行搜库分析,搜索引擎为SEQUEST。小鼠的蛋白数据库下载自UniProt 2019_11 (https://www.uniprot.org/)。搜库参数采用固定修饰为“Carbamidomethyl(C)”,可变修饰为“Oxidation (M)、 Deamidation (NQ)、 Acetyl (N terminal)、Phosphorylation(STY)”。母离子质量容差(precursor mass tolerance)为1×10-5,二级谱图质量容差(fragment mass tolerances)为0.050,允许最大漏切位点(max missed cleavages)为2,肽段和蛋白的错误发现率(false discovery rate,FDR)均≤1%。
1.2.6 肽段和蛋白的定量和分析方法 本实验采用非标定量法,以蛋白和肽段的峰面积对蛋白和肽段进行相对定量分析,满足差异倍数为2以及多肽和蛋白的FDR≤1%的蛋白确定为表达差异蛋白。蛋白的鉴定通过对多个不同肽段与数据库中蛋白质序列预测的碎片离子的比对得到,肽段的序列主要通过对b 离子和y 离子的捕获进行鉴定[12]。利用String 11.0(https://string-db.org/)软件进行基因本体数据库(Gene Ontology,GO)分析,方法和P值计算参考文献[13],结果从String 11.0 软件导出。通过String 11.0 软件对鉴定到的77 个磷酸化蛋白进行蛋白互作网络构建,并使用Cytoscape 3.7.2软件使互作网络可视化。热图由Proteome Discoverer 2.3软件导出。
1.3 统计学分析
采用GraphPad Prism 7.0 软件对研究数据进行统计分析。样本间关系采用Spearman 相关性分析,肽段间关系采用Pearson 相关性分析的方式,以及采用聚类后缩放(complete 算法)的聚类方法,对磷酸化修饰肽段进行聚类分析,颜色比对范围从-1.5~2.0。通过非配对的双侧Student's t 检验,统计2 组哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化肽段含量间的差异。P<0.05表示差异具有统计意义。
2 结果
2.1 差异磷酸化蛋白质组学肽段和蛋白质分析
从细胞表型上看,加入10 μg/mL ConA 作用12 h 后的AML12 细胞生长间隙较对照组变大,细胞干瘪、光泽度降低,并出现少量死亡细胞漂浮的现象。经过细胞蛋白裂解、酶解、肽段富集、脱盐、质谱检测后共收集到磷酸化修饰肽段11 200条,根据ConA 组与对照组肽段的峰面积值和2组间峰面积比值的P 值筛选出可定位定量的肽段2 685 条,其中差异性调控的磷酸化修饰肽段共83条,去除种属来源非小鼠的1 条,对应磷酸化蛋白77 个。82 条肽段中上调的磷酸化肽段20 条,下调的磷酸化肽段62 条。磷酸化位点在蛋白上的分布结果及各种磷酸化修饰的比例统计结果如图1A、B 所示。磷酸化修饰蛋白中有1个磷酸化修饰位点的有68个,2个磷酸化修饰位点的有8 个,3 个磷酸化修饰位点的有1 个蛋白。而这些磷酸化修饰86%发生在丝氨酸位点,7%发生在苏氨酸修饰位点。热图结果如图1C所示,ConA 组与对照组的3个样品组间聚类趋势相同,ConA 组的磷酸化肽段大部分被下调,少部分被上调。
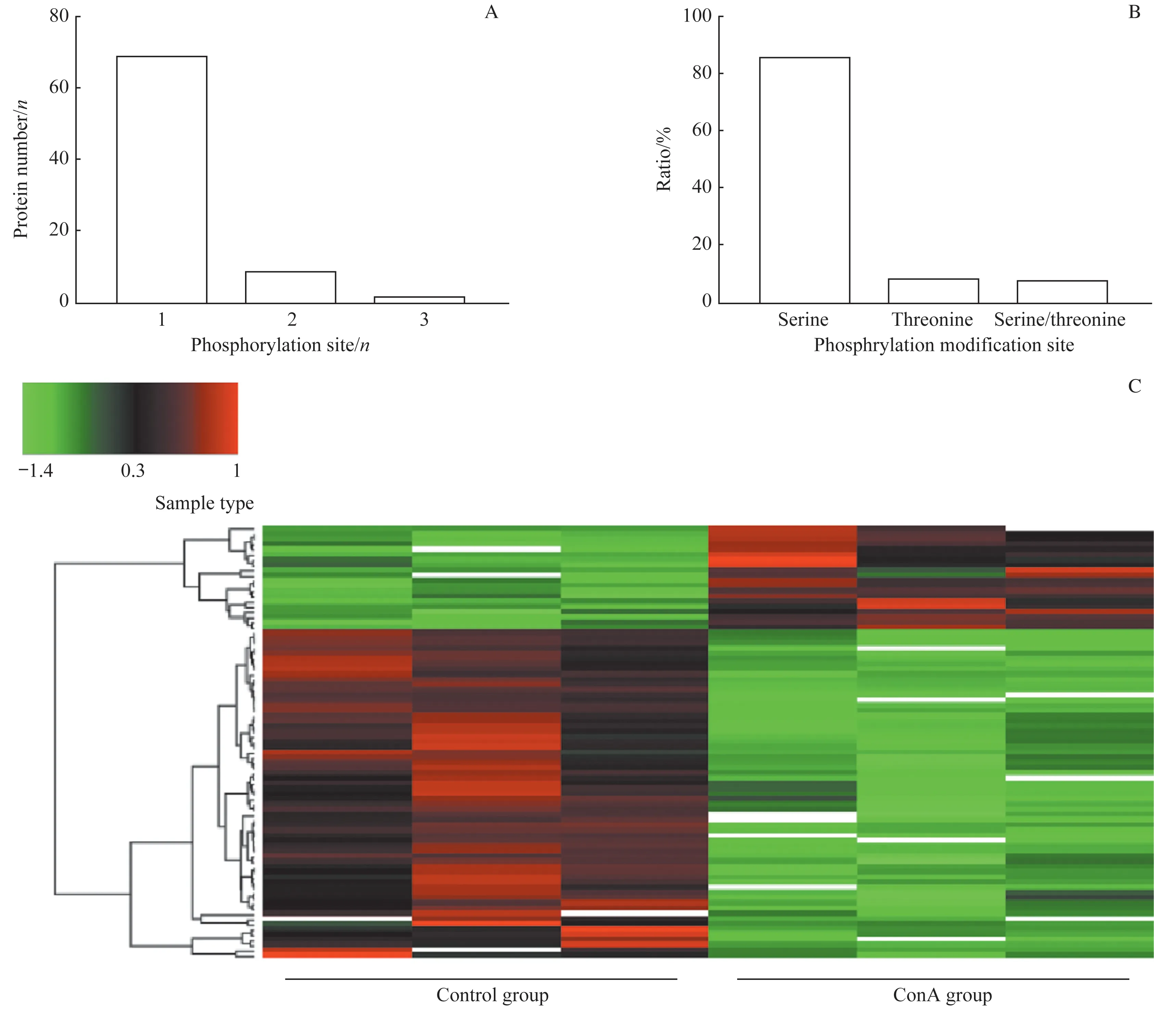
图1 差异磷酸化蛋白质组学的鉴定及定量结果Fig 1 Results of identification and quantification of differentially phosphorylated proteomics
2.2 磷酸化修饰位点的确定
本研究获得了ConA 诱导肝细胞损伤的所有差异性调控的磷酸化肽段的序列、对应的蛋白、磷酸化修饰方式和个数、磷酸化修饰位点在蛋白上的位置等信息。磷酸化变化最大的前10个蛋白的信息见表1。在ConA诱导AML12细胞损伤过程中,磷酸化修饰变化最大的10个蛋白分别是过氧化物还原酶5(peroxiredoxin 5,Prdx5)、mTOR、真核细胞翻译起始因子4E(eukaryotic translation initiation factor 4E, eIF4E)、 RNA 输 出 磷 酸 化 适 配 器(phosphorylated adaptor for RNA export,Phax)、具有序列相似性的家族蛋白76 成员B (family with sequence similarity 76,member B,Fam76b)、磷酸葡萄糖突变酶1(phosphoglucomutase 1,Pgm1)、丝氨酸/精氨酸重复基质蛋白1(serine/arginine repetitive matrix 1,Srrm1)、真核细胞翻译起始因子5B(eukaryotic translation initiation factor 5B,eIF5B)、AMP 激活的β1 非催化亚基蛋白激酶(protein kinase, AMP-activated, beta 1 non-catalytic subunit, Prkab1)、 膜 联 蛋 白 A13 (annexin A13,Anxa13)。
mTOR 可响应激素、生长因子、营养素、能量和应激多种信号,是细胞代谢、生长和存活的主要调节剂[14-15],直接或间接调节至少800 种蛋白的磷酸化[16-17]。已知在动物模型中,雷帕霉素通过抑制淋巴细胞活化来预防ConA 引起的肝损伤[18]。在本实验模型中mTOR 发生磷酸化修饰的肽段序列为[K].LHVSTINLQK.[A],磷酸化发生在肽段序列的第4个丝氨酸位点上,二级质谱图见图2A。从二级质谱图可以看出,b₄⁺(-P)419.24069 和b₅⁺(-P)520.29572 均发生了磷酸化。而从mTOR 2 组间磷酸化肽段的含量比较(图2B)可以看出,mTOR 的磷酸化水平在ConA 诱导的AML12 细胞损伤过程中被上调(P=0.049 5)。

表1 前10个差异磷酸化修饰肽段序列和修饰位点信息Tab 1 Top ten differentially phosphorylated peptide sequences and modification site information

图2 mTOR磷酸化修饰肽段二级质谱和2组间含量比较结果Fig 2 Secondary mass spectrum of mTOR phosphorylation modified peptides and comparison between the two groups
2.3 差异磷酸化修饰蛋白质功能分析
根据前述条件筛选出的磷酸化修饰肽段,通过UniProt 2019_11 找到对应的磷酸化蛋白的官方基因代码,在String 11.0 上对这77 个蛋白进行生物进程、分子功能的GO分析,结果如图3所示,图中罗列了筛选的前12位结果。分析结果发现,在ConA 诱导的AML12 细胞损伤过程中,差异磷酸化修饰的蛋白主要与蛋白质结合、杂环化合物结合、DNA 结合、RNA 结合、酶结合等细胞功能相关。另外这77 个磷酸化修饰蛋白主要参与肝细胞损伤过程中细胞的蛋白质定位,细胞骨架、细胞核、细胞成分组织,以及mRNA 代谢、细胞代谢过程的调节。可见在肝损伤过程中磷酸化修饰参与了细胞中众多的细胞内结合和细胞内成分的调节过程。
2.4 ConA 诱导的AML12 细胞损伤中差异磷酸化蛋白网络构建
通过String 11.0 对鉴定到的77 个差异磷酸化蛋白进行蛋白互作网络构建,并使用Cytoscape 3.7.2软件使互作网络可视化,结果如图4所示。从蛋白互作关系网络可以发现该模型所鉴定到的磷酸化蛋白中,与凋亡相关的mTOR、Crebbp、Bcl2L11、Prkab1、Snip、Taok1 等蛋白处于一个大家族通路上,mTOR 蛋白与多个蛋白具有相互作用关系,处于一个相对重要的位置。而与RAS 激酶通路相关的Ksr1、Ptk2b、Sorbs2、Rab12 等蛋白在另一个家族通路上。mTOR 相关通路和RAS 激酶通路在细胞凋亡的调节中起着重要作用。mTOR 是促细胞存活因子,在细胞凋亡中起着抑制剂的作用。细胞在压力应激下,随着mTOR 的消耗,抑制细胞生长和增殖,并增加细胞自噬和凋亡的发生[19-21]。RAS 蛋白可能同时具有促凋亡和抗凋亡功能,具体取决于RAS 效应子途径和凋亡的机制[22]。研究结果发现ConA 诱导肝细胞损伤过程中磷酸化蛋白的主要互作关系与凋亡和RAS 激酶通路相关,这一结果的发现为研究肝损伤药物的通路机制提供了参考。

图3 差异磷酸化修饰蛋白GO分析结果Fig 3 Results of GO analysis of differentially phosphorylated modified proteins
3 讨论
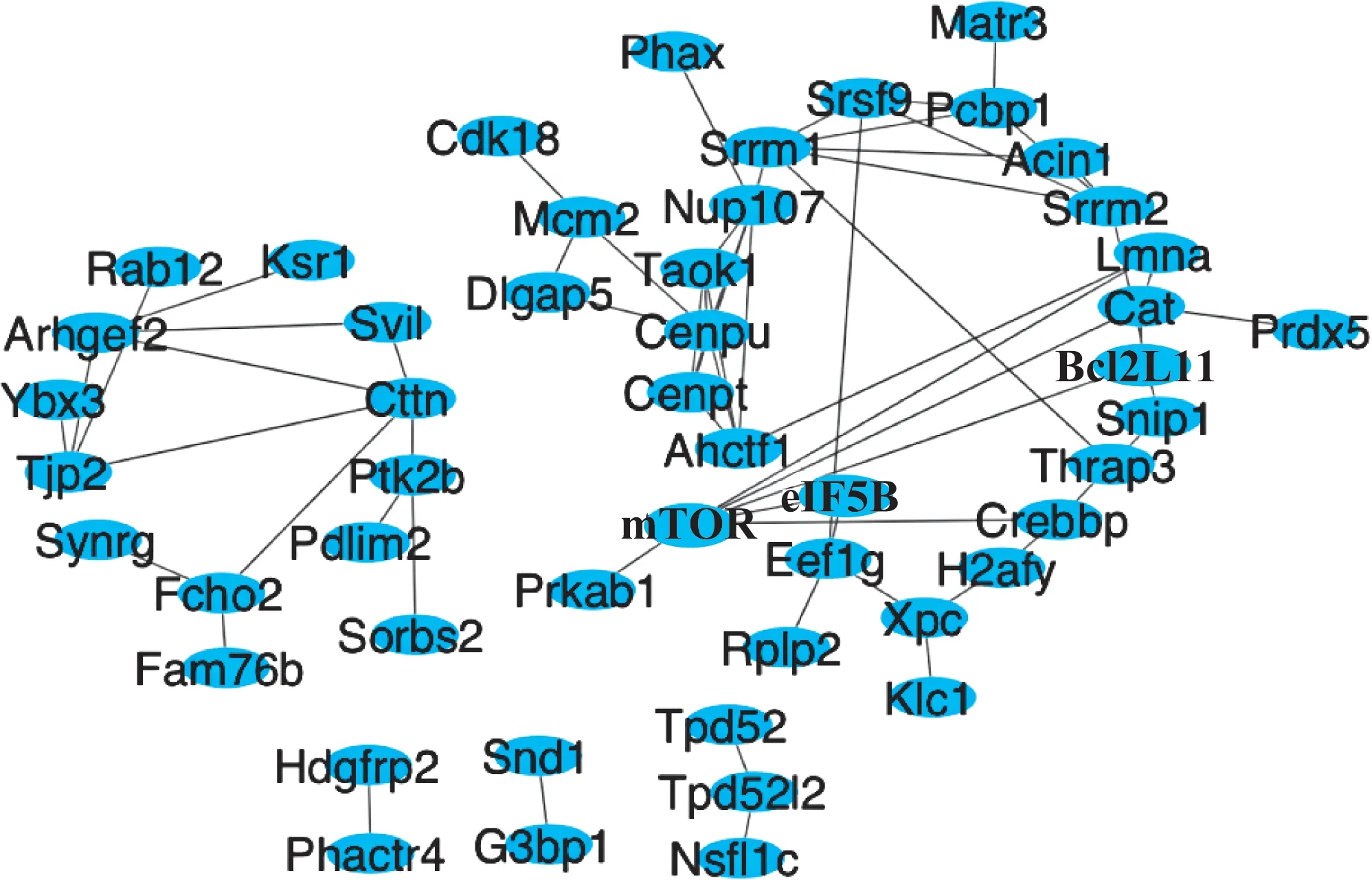
图4 差异磷酸化修饰蛋白质互作关系网络图Fig 4 Interaction network of differentially phosphorylated modified proteins
肝脏磷酸化蛋白质组学的研究方法近年来已趋于成熟,本研究建立了ConA 诱导的肝实质细胞损伤的细胞模型,定位、定量在ConA 诱导的肝损伤过程中发生差异磷酸化修饰的蛋白以及挖掘潜在的磷酸化修饰位点,为肝脏疾病的研究提供新的研究靶点以及通路信息。ConA 是一种多克隆有丝分裂原,可通过激活T 淋巴细胞诱导特定的急性肝损伤。许多小鼠谱系易受ConA 影响而产生肝炎。单次注射ConA 可引起肝实质细胞中CD4+淋巴细胞、巨噬细胞和其他炎症细胞浸润,导致多种细胞因子和炎症介质的释放,并通过特定的炎症介质诱导肝细胞损伤[23-24]。mTOR 作为关键的能量传感器和细胞生长调节剂,通过形成功能独特的复合物mTORC1 和mTORC2 来控制蛋白质的合成、自噬和许多重要的细胞过程[25-26]。在ConA 诱导的肝损伤动物模型中,mTOR 通过抑制促炎细胞因子γ 干扰素(interferon-γ,IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的产生抑制肝脏内淋巴细胞的增殖[18],达到保护肝损伤的效果。本研究发现在ConA 诱导的AML12 细胞损伤过程中,mTOR 的磷酸化水平被上调,猜测该过程可能参与了保护ConA 引起的肝细胞损伤,具体机制有待进一步的研究。
肝损伤过程中包括cAMP 依赖性蛋白激酶(protein kinase A,PKA)、PI3K/AKT/mTOR、蛋白激酶C 异构体(protein kinase C, PKC)、 丝 裂 原 活 化 蛋 白 激 酶(mitogen-activated protein kinase, MAPK)、 Jun 激 酶(Jun kinase,JNK)和p38激酶(p38 kinase,p38K)等在内的蛋白可以通过可逆的磷酸化和去磷酸化过程来调节细胞的增殖、凋亡和自噬[27]。对蛋白质功能调控相关的磷酸化修饰进行研究,可以发现细胞在受到ConA 刺激之后的信号转导和功能蛋白活性发生改变;该发现对于进一步研究ConA 诱导的肝损伤动物模型具有重要参考价值。从富集到的差异磷酸化修饰蛋白的互作网络可以看出肝细胞损伤过程中差异磷酸化修饰主要发生在凋亡通路以及RAS 激酶通路上,提示我们在对肝损伤保护药物的开发研究中可以参考该蛋白互作关系进行针对性研究。mTOR 蛋白在该蛋白互作关系网络中处于关键的位置,且在ConA 动物模型中对肝损伤具保护作用,提示可以在将来的研究中将mTOR 蛋白以及凋亡通路中其上下游蛋白列为重点研究对象。由于非标定量法未对靶点进行标记,存在定量上的缺陷,未来的研究中我们将采用靶向蛋白定量的方法对结果进行进一步的验证。
本研究提供了肝实质细胞在肝损伤过程中发生差异磷酸化修饰的蛋白的分子功能、生物进程、相互作用关系网络以及磷酸化修饰位点的信息,可为肝脏疾病的研究提供靶点信息。
