IL-32联合终末期肝病模型对HBV相关慢加急性肝衰竭患者预后的预测价值
2021-03-03赵卫峰甘建和
顾 静, 王 艳, 孙 蔚, 赵卫峰, 甘建和
苏州大学附属第一医院 感染科, 江苏 苏州 215006
慢加急性肝衰竭(ACLF)是由多种病因导致的肝细胞大量坏死造成的急性肝功能失代偿,以黄疸、凝血功能障碍、腹水、肝性脑病为主要表现的临床症候群[1]。在我国,HBV感染是ACLF的主要病因[2]。ACLF病情进展迅速,预后极差,肝移植是目前唯一确切有效的措施[3]。早期发现常规内科治疗可能无法恢复的患者对临床决策至关重要,这些患者应尽快列入肝移植等待队列,因为许多患者在等待肝移植的过程中死于疾病进展[4]。因此,HBV-ACLF患者精准的预后评估具有重要意义。终末期肝病模型(MELD)评分是临床应用最为广泛的评估肝病预后的评分,但也存在许多不足之处,亟需筛选出更为准确的无创性生物学指标来提高MELD评分在HBV-ACLF患者预后中的预测价值[5]。大量研究[6]证实,ACLF患者体内存在过度炎症反应,表现为患者血清中促炎细胞因子水平的升高和免疫细胞活化标志物表达的上调。IL-32作为一种新型的促炎细胞因子,在病毒感染性疾病中发挥了重要作用,如禽流感、艾滋病、乙型肝炎、丙型肝炎和人乳头状瘤病毒[7]。研究[8]表明,HBV感染后,IL-32一方面促进TNFα、IL-1β、IL-6、IL-8的释放形成细胞因子网络造成肝细胞免疫损伤,另一方面诱导肝细胞凋亡加剧肝细胞坏死。因此本研究探讨IL-32联合MELD评分对HBV-ACLF预后的预测作用,以期为早期准确评估HBV-ACLF预后提供更为充分的理论依据。
1 资料与方法
1.1 研究对象 收集2015年1月—2018年12月在本院住院治疗的92例HBV-ACLF患者的临床资料。HBV-ACLF的诊断符合《肝衰竭诊疗指南(2018版)》[2]。排除标准:(1)年龄<18岁;(2)HBV以外其他病因所致的肝衰竭,如自身免疫性、酒精性、药物性、遗传代谢性及其他不明原因;(3)有肝脏或其他脏器恶性肿瘤患者;(4)妊娠期女性;(5)住院时间短于48 h;(6)入院前6个月使用免疫抑制剂治疗者。HBV-ACLF患者经过为期3个月的随访,根据预后分为存活组(n=40)和死亡组(n=52),其中死亡组包括住院期间病情无好转死亡、病情恶化自动出院放弃医学治疗及转为肝移植者。
1.2 研究方法 收集患者入院时的基线资料,包括年龄、性别、合并基础疾病;入院24 h内的实验室指标:WBC、PLT、红细胞比积(HCT)、TBil、ALT、AST、Alb、SCr、PT、INR、HBV DNA等。所有患者入院第2天清晨空腹留取血标本,-4 ℃低温离心机下2000 r/min离心10 min,收集血清立即储存于-70 ℃冰箱,用作IL-32检测。记录HBV-ACLF患者住院期间发生的并发症情况。MELD评分=9.6×ln[SCr(mg/dl)]+3.8×ln[TBil(mg/dl)]+11.2×ln(INR)+6.4×病因(病因:胆汁性或酒精性0,其他1)[9]。
1.3 仪器与方法 全自动定量酶标仪(日本Macro-plat公司)、台式低温高速离心机(瑞典Electrolux公司)、医用低温冰箱(SANYO公司)。IL-32 ELISA检测试剂盒(Biolegend公司)、去离子水、洗涤液等。所有受试者血清标本检测前提前取出置于室温下复融。根据试剂盒说明书配置相应浓度的试剂,严格按照说明书实验步骤进行检测。
1.4 伦理学审查 本研究经苏州大学附属第一医院伦理委员会审批,批号:(2020)伦研批第159号,所有患者均签署知情同意书。

2 结果
2.1 一般资料 死亡组52例患者中男32例,女20例,平均年龄(51.76±10.23)岁;存活组男28例,女12例,平均年龄(52.55±11.69)岁。两组间HCT、PLT、TBil、SCr、PT、INR、HBV DNA、IL-32、MELD评分比较差异均有统计学意义(P值均<0.05)(表1)。

表1 两组患者一般资料比较
2.2 相关性分析 结果显示,IL-32与TBil(r=0.952,P<0.001)、MELD评分(r=0.850,P<0.001)均呈显著正相关(图1、2)。

图1 IL-32与TBil相关性分析
2.3 HBV-ACLF患者预后相关的危险因素 单因素分析结果显示,HCT、PLT、TBil、PT、INR、HBV DNA、IL-32、MELD评分与患者预后相关(P值均<0.05);对单因素分析有意义的变量进行多因素logistic回归分析发现,IL-32和MELD评分是HBV-ACLF患者死亡的独立危险因素(P值均<0.05)(表2)。
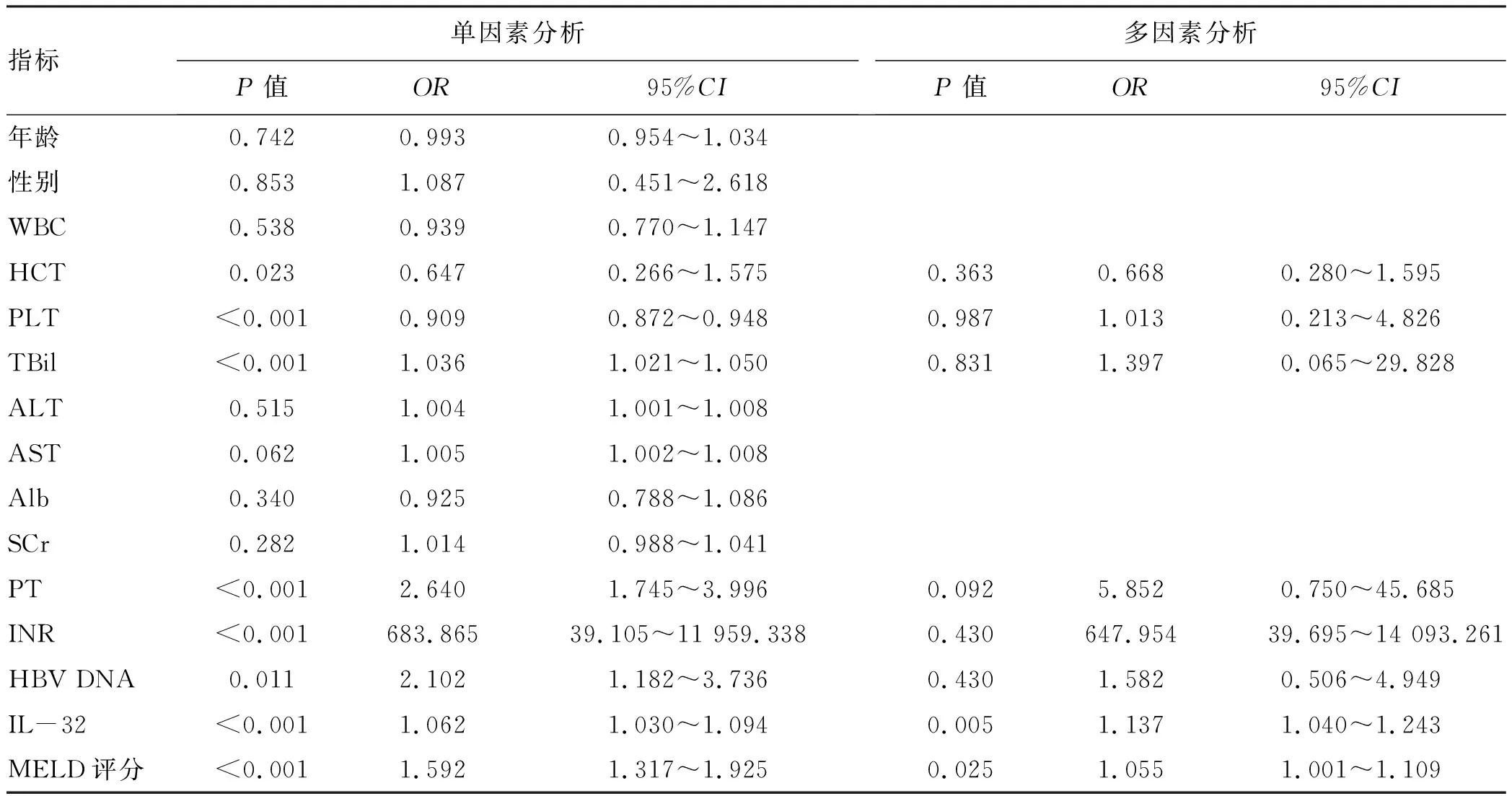
表2 HBV-ACLF患者预后相关因素分析
2.4 IL-32对HBV-ACLF预后的预测价值 ROC曲线结果显示,IL-32联合MELD评分(AUC=0.992,95%CI:0.981~1.000)的AUC高于IL-32(AUC=0.984,95%CI:0.964~1.000)和MELD评分(AUC=0.877, 95%CI:0.798~0.956),差异均具有统计学意义(Z值分别为2.265、3.182,P值均<0.05),说明IL-32联合MELD评分对HBV-ACLF患者预后的预测价值最高 (图3)。

图2 IL-32与MELD评分相关性分析
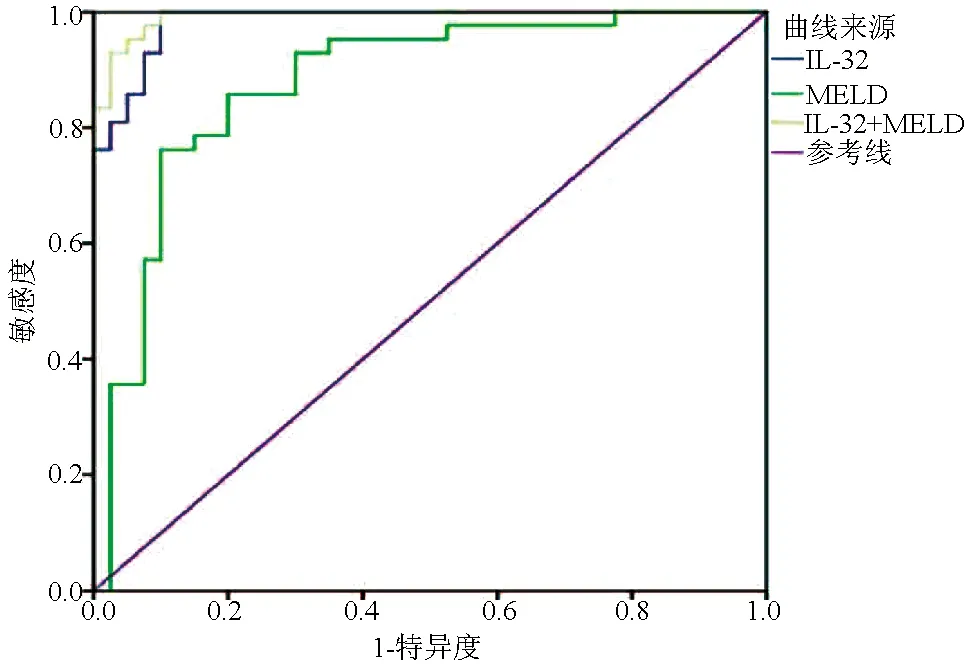
图3 IL-32、MELD评分、IL-32联合MELD评分的ROC曲线
3 讨论
病原相关分子模式和损失相关分子模式可启动先天性免疫系统,抵抗外来病原微生物的入侵,然而宿主过度的炎症反应可导致组织损伤、器官功能障碍等[10]。免疫系统过度激活引起的系统性炎症反应是HBV-ACLF发生发展的标志[11]。CANONIC大队列研究[12]显示,细胞因子风暴在系统性炎症反应中发挥重要作用。研究[13]发现,ACLF患者的WBC、C反应蛋白、IL-6、IL-1、IL-8水平显著高于非ACLF患者,且随着病情的严重程度而升高。因此,细胞因子的检测对于ACLF疗效及预后评估具有重要意义。
IL-32是一种新型的促炎细胞因子,参与了多种疾病的发生发展,如糖尿病、非酒精性脂肪肝、类风湿性关节炎、冠心病、系统性硬化、肺动脉高压、结核等[14-18]。它主要表达于自然杀伤细胞(NK细胞)、T淋巴细胞、上皮细胞和单核细胞中,可以活化核转录因子(NF-κB)、p38丝裂原活化蛋白(p38MAPK)信号通路,诱导TNFα、IL-1β、IL-8、IL-6的释放从而放大炎症级联反应[7,19]。Tian等[20]发现CHB患者外周血IL-32、IL-1、IFNγ水平均高于健康志愿者。Xu等[8]研究证实,IL-32的表达水平与CHB患者的肝脏炎症活动和纤维化程度相关。Zou等[19]研究显示,HBV-ACLF患者IL-32的表达水平与病情严重程度呈正相关,并且发现NK细胞配体B7-H6与自然细胞毒受体NKP30相互作用可以上调IL-32的表达,加剧了HBV所致的肝损伤。本研究共入组了92例HBV-ACLF患者,死亡组的IL-32水平明显高于存活组,与Zou等研究结果相一致。
2019 亚太肝病学会发布的慢加急性肝衰竭共识建议[1]推荐ACLF患者预后评估应贯穿诊疗全程,强调早期预后评估的重要性,对于常规内科治疗无望的患者推荐早期选择肝移植治疗,以便降低脓毒症和多器官功能衰竭的发生率。众所周知,TBil是反映肝衰竭严重程度的重要指标之一,且与短期病死率显著相关[21]。Malinchoc和Kamath等于2000年建立MELD评分,由于其客观性、连续性、简便性等优点,是目前应用最广泛的评估终末期肝病预后的模型之一[7]。本研究中,相关性分析显示IL-32与TBil、MELD评分呈显著正相关,二元logistic回归分析发现,IL-32和MELD评分是HBV-ACLF患者死亡的独立危险因素。ROC曲线分析显示,IL-32联合MELD评分对HBV-ACLF患者预后的预测价值最高(AUC=0.992),优于IL-32(AUC=0.984)和MELD评分(AUC=0.877),说明IL-32联合MELD评分用于评估HBV-ACLF患者预后具有良好的临床价值。众多学者对细胞因子在ACLF患者预后中的预测价值进行了探讨,如张鸿等[22]发现IL-8预测HBV-ACLF患者60 d病死率的AUC为0.817;汪静等[23]研究结果显示,IL-26对预测HBV-ACLF患者90 d病死率的AUC为0.846;Fischer等[24]也进行了类似的研究,表明IL-6预测ACLF患者90 d病死率的AUC为0.779。将来,联合多种无创性指标来构建更为实用准确的联合评估模型将是研究的热点之一。
综上所述,IL-32可作为HBV-ACLF患者死亡的独立危险因素;与MELD评分相比,IL-32联合MELD评分具有更高的死亡预测能力。然而本研究也存在一些不足之处,如样本例数较少,随访时间过短,且为单中心研究。未来将进一步开展前瞻性、多中心、大样本的研究来进一步阐明IL-32在HBV-ACLF发病机制中的意义及临床应用价值。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献申明:顾静负责课题设计,资料分析,撰写论文;王艳、孙蔚参与收集数据,修改论文;赵卫峰、甘建和负责拟定写作思路,指导撰写文章并最后定稿。
