原发性肝癌放射治疗专家共识(2020年版)
2021-03-03中国医师协会肝癌专业委员会精确放疗学组中国研究型医院学会放射肿瘤学专业委员会肝癌学组中国研究型医院学会肿瘤放射生物与多模态诊疗专业委员会中国生物医学工程学会精确放疗分会肝癌学组
中国医师协会肝癌专业委员会精确放疗学组,中国研究型医院学会放射肿瘤学专业委员会肝癌学组,中国研究型医院学会肿瘤放射生物与多模态诊疗专业委员会,中国生物医学工程学会精确放疗分会肝癌学组
原发性肝癌是我国发病率较高的恶性肿瘤之一,据报道,2015年我国原发性肝癌新发患者46.6万例,死亡42.2万例,超过世界原发性肝癌发病总例数的一半[1]。为此,很多肝癌治疗相关学会都制订了原发性肝癌(主要是肝细胞癌)的诊治指南、共识或规范。原发性肝癌放射治疗已经得到这些学会的认可,并写入指南、共识或规范。本学组在2016年组织撰写了《2016年原发性肝癌放射治疗共识》,作为国内首部原发性肝癌放疗相关的共识,受到业内的高度重视和好评,有效地规范了原发性肝癌的放射治疗。此次根据临床实际情况,结合近年来肝癌放疗的最新研究进展,尤其是随机对照的高循证级别的研究,在2016年版的基础上进行了更新。
1 原发性肝癌放疗概况
放射治疗(简称放疗)分为外放射治疗(外放疗)和内放射治疗(内放疗)。外放疗是利用放疗设备产生的射线(光子或粒子束),经体外聚焦到体部肿瘤,从而破坏肿瘤细胞的DNA,导致肿瘤细胞死亡,达到控制肿瘤的目的。内放疗是利用放射性核素,经肌体管道或通过针道植入肿瘤内,使肿瘤受到来自内部的射线照射,在我国常由介入科医生操作。
原发性肝癌包括肝细胞癌和肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC), 这两种病理类型的放疗处理原则不同:(1)肝细胞癌淋巴结转移少见,而ICC淋巴结转移较常见。肝细胞癌外放疗通常无需行预防性淋巴引流区照射,而肝内胆管癌外放疗有时需考虑是否行照射淋巴引流区。(2)肝细胞癌动脉血供丰富,不能手术切除的肝细胞癌接受肝动脉栓塞化疗(介入治疗)的效果好,而ICC动脉血供欠丰富,碘油栓塞效果欠佳,其介入治疗对综合治疗的贡献有限。(3)肝细胞癌较ICC常见,放疗的临床经验较多。因此,本共识分别论述这两种不同病理类型的原发性肝癌。
2 共识形成过程
(1)共识的目的和适用群体:本共识的目的是让从事肝癌诊治的临床医生了解放疗在肝癌综合治疗中的作用,清楚肝癌患者的疾病进程中,哪个阶段需要应用放疗。特别是让从事放疗的医务工作者清楚肝癌放疗的适应证、放疗实施过程的具体问题,从而使更多的肝癌患者能从放疗及综合治疗中获益。(2)文献查找:本共识的引用文献通过Medline搜索引擎,以MeSH Terms“hepatocellular carcinoma(HCC)”或“cholangiocarcinoma”,和“radiation therapy(RT)”或“radiotherapy”查阅至2019年12月的发表论文(包括在线发表)。 (3)循证级别:本共识采用循证医学等级(表1),将证据级别和推荐强度相结合,证据级别可信度从高到低分为A、B、C,推荐强度从强到弱分为1和2。推荐强度主要考虑证据的质量、患者对治疗效果的关注程度、治疗方法的利弊和简便程度、治疗费用和资源获取等[2]。
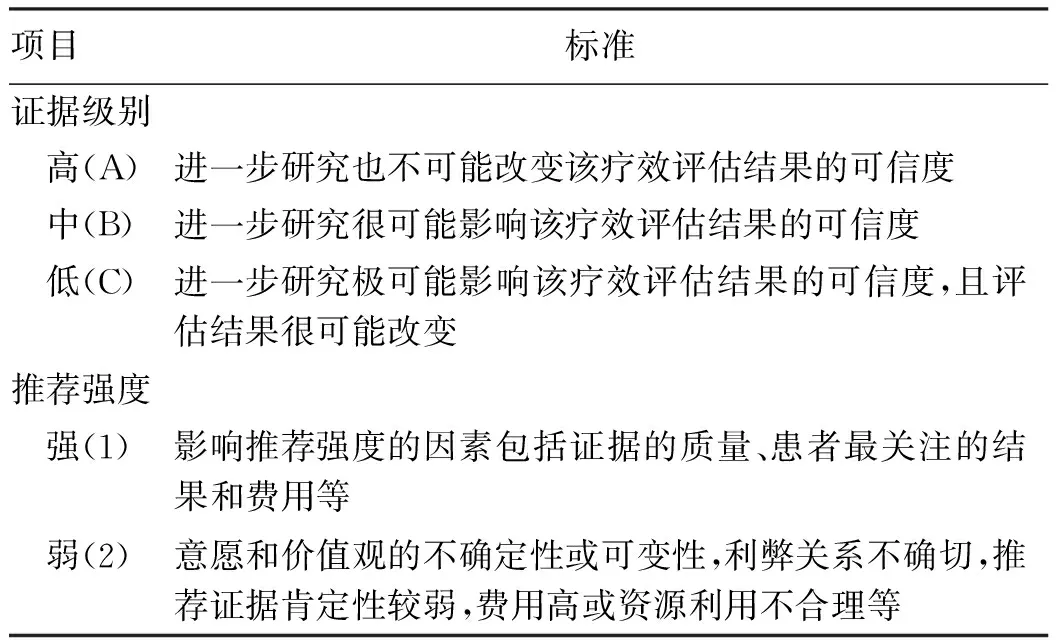
表1 循证级别和推荐强度
3 肝细胞癌
3.1 肝细胞癌的外放疗
3.1.1 对不同病期的肝细胞癌都可以获益
3.1.1.1 小肝癌的体部立体定向体部放疗(SBRT) 肝内肿瘤的立体定向放疗主要针对小的肝细胞癌(小肝癌)。日本Sanuki等[3]报道185例直径<5 cm的肝细胞癌接受立体定向放疗,3年局部控制率和总体生存率分别为91%和70%。我国报道的5年总体生存率为64%[4],与文献报道的小肝癌外科手术切除或肝移植的生存情况相似[5]。美国报道224例不能手术的小肝癌,其中161例接受射频消融,63例接受SBRT,结果显示射频消融和SBRT组的1、2年生存率分别是70%和74%、53%和46%,两组差异无统计学意义[6]。近几年,肝癌SBRT相关临床研究结果均显示了生存获益,如2017年Su等[7]发表在InternationalJournalofRadiationOncology,BiologyPhysics上的研究,比较SBRT与手术切除对Ⅰa期肝细胞癌的疗效差异,结果发现SBRT与手术切除患者的1、3、5年总生存率分别为100%、91.8%、74.3%与96.7%、89.3%、69.2%,两组差异无统计学意义。而另外一项2020年发表在Hepatology上的研究则比较SBRT与射频治疗的生存差异,结果发现SBRT与射频治疗的3年总生存率相似,分别为70.4%与 69.1%,但3年局部复发率分别为5.3%与12.9%,显示了SBRT较射频治疗更具有优势[8]。
3.1.1.2 肝移植前的放疗 符合肝移植适应证的肝细胞癌患者,原位肝移植是最有效的治疗手段。但由于肝脏供体数量有限,许多患者在较长的肝源等待过程中发生肿瘤进展,从而丧失最佳的治疗机会。因此,在肝源等待过程中的衔接治疗就显得非常重要。美国Rochester大学医学中心和密西根William Beaumont医院报道18例移植前接受立体定向放疗的肝细胞癌患者[9],放疗后中位肝源等待时间为6.3个月,其中12例患者成功接受肝切除或肝移植术;术后中位随访时间为19.6个月,患者均存活。关于肝癌肝移植前放疗的报道还有很多[10-11]。一项意向性人群分析,比较了包括SBRT、经肝动脉化疗栓塞(TACE)、射频消融3种治疗手段作为肝移植前的桥接治疗的安全性和有效性,结果显示SBRT与TACE和射频消融比较,其安全性和有效性相似[12]。因此,SBRT是肝癌患者肝移植前肝源等待期间的一种安全有效的衔接治疗,能够在移植前缩小或控制肿瘤,提高生存获益,应受到更多重视。
3.1.1.3 与介入治疗结合,作为巩固或转化治疗 临床研究证实,对局限于肝内的不能切除的肝细胞癌病灶,如果TACE后碘油沉积不佳,结合外放疗可以提高疗效[13-15]。尤其是肿块>5 cm的病灶,往往存有肝动脉与门静脉的双重血供,TACE即使将肿瘤的供血动脉完全栓塞,但门静脉血供仍存在,不能完全阻断肝内肿瘤供血,致使肿瘤残留,而残留的肿瘤细胞则是日后复发、转移的根源。因此,TACE结合放疗可以弥补单纯TACE的不足,提高临床疗效。国内Zeng等[13]回顾性研究显示,TACE结合外放疗与单纯TACE比较,2年和3年生存率分别是42.3%和26.5%、24.0%和11.1%(P=0.026),在TACE的基础上联合外放疗明显提高疗效。韩国的研究同样也显示,TACE结合外放疗与单纯TACE比较,可以改善生存,2年生存率可以从单纯TACE的14.3%提高到36.8%(P=0.001)[14]。综合国内外研究结果,TACE联合外放疗的肝细胞癌患者,3年生存率为24%~44.6%,3年生存率较单纯TACE提高10%~28%[15]。一项发表于JAMAOncology的Meta分析中,Huo等[16]共收集25项临床研究(其中11个为随机临床研究)的数据,共2577例不能手术切除的肝细胞癌患者,比较单纯介入和介入联合放疗的疗效。结果显示接受介入联合放疗的患者,其长期生存期更获益,2、3、4、5年生存率的合并优势比(pooled odds ratios)分别是1.55、1.91、3.01、3.98,与单纯介入治疗比较,介入联合外放疗可以明显提高总体生存率,尤其是远期生存率。
3.1.1.4 伴门静脉/下腔静脉癌栓接受外放疗 伴有静脉癌栓的肝细胞癌患者预后很差,中位自然生存时间仅为3~4个月。肝细胞癌伴门静脉和/或下腔静脉癌栓的回顾性分析,比较同期接受与不接受放疗患者的中位生存时间,中国报道为8.0个月和4.0个月[17],日本报道为10.0个月和3.6个月[18],韩国报道为11.7个月和4.7个月[19],中国台湾报道为7.0个月和3.9个月[20]。上述4项回顾性研究,单因素和多因素分析均支持放疗可以显著延长患者生存(P<0.01)。另有研究[21]显示,对可手术切除的371例肝细胞癌伴门静脉癌栓患者,186例接受手术切除(手术组),185例接受包括原发灶和静脉癌栓的三维适形放疗(放疗组),中位放疗剂量为40 Gy(30~52 Gy),两组均联合TACE,放疗组中位生存时间为12.3个月,手术组为10.0个月,两组差异有统计学意义(P=0.029),多因素分析显示放疗使患者生存获益。2018年JAMAOncology发表一项来自韩国的随机对照研究,将伴有癌栓的患者随机分为TACE+放疗组和索拉非尼组,前者采用TACE处理肝内病灶而放疗处理癌栓及邻近2 cm肝内病灶,放疗剂量为45 Gy,2.5~3 Gy/f;结果发现TACE+放疗组较索拉非尼组的中位总生存期(55.0周 vs 43周,P=0.04)及PFS(30.0周vs 11.3周,P<0.001)均显著延长[22]。2019年JournalofClinicalOncology发表的一项多中心随机对照研究[23]中,可切除的伴门静脉癌栓肝细胞癌患者随机分为术前新辅助放疗组(82例)和单纯手术切除组(82例),术前放疗剂量为肿瘤及门静脉癌栓18 Gy/6f,放疗后4周进行手术,结果发现:术前放疗组1年、2年生存率(75.2%、27.4%)均较单纯手术切除组(43.1%、9.4%)显著升高。因此,鉴于包含随机对照临床试验的多项研究结果,强烈推荐Ⅲa期肝细胞癌伴门静脉血管癌栓选择放疗,放疗既可作手术切除的新辅助治疗手段,也可与TACE治疗联合,从而改善肿瘤局部控制率、延长生存期。
3.1.1.5 肝细胞癌窄切缘术后的辅助外放疗 中央型肝癌是指与门静脉分叉部、三支主肝静脉、下腔静脉汇合部和肝后下腔静脉主干距离≤1 cm的肝癌。对于大部分中央型肝癌(位于肝脏Ⅳ、Ⅴ和Ⅷ段)和小部分外周型肝癌(位于肝脏Ⅱ、Ⅲ、Ⅵ和Ⅶ段),由于肿瘤邻近或累及肝门部血管主干,即使手术切除肿瘤,也难以满足切缘安全界>1 cm要求,甚至部分患者手术切缘为阳性,从而影响疗效。针对此类患者,中国医学科学院肿瘤医院首次报道了肝细胞癌窄切缘术后辅助放疗的结果[24],共纳入181例患者,分别为窄切缘手术联合术后放疗组33例,单纯窄切缘手术组83例,宽切缘手术组65例,3组的3年总生存率和无病生存率分别为89.1%和64.2%,67.7%和52.2%,86.0%和60.1%。与宽切缘组比较,窄切缘手术联合术后放疗组的总生存率(P=0.957)和无病生存率(P=0.972)均与之相近;与单纯窄切缘手术组比较,窄切缘手术联合术后放疗组的总生存率(P=0.009)和无病生存率(P=0.038)均有显著优势。该研究初步说明术后辅助放疗可弥补窄切缘手术的不足,为前瞻性研究奠定了基础。
3.1.1.6 外放疗成为肝外转移灶的优势治疗手段 肝细胞癌肝外转移部位包括淋巴结、肺、骨、肾上腺、脑等。一旦出现转移需要进行包括放疗在内的多学科综合治疗。有回顾性研究将伴有淋巴结转移的肝细胞癌患者分为接受和不接受外放疗两组,结果发现,接受外放疗组的中位生存时间为9.4个月,不接受放疗组的中位生存期为3.3个月,单因素和多因素分析都有显著差异(P<0.001)[25]。另有多项报道显示:外放疗对肝细胞癌的淋巴结转移是安全有效的[26-27];对肝细胞癌的肾上腺转移[28]、骨或软组织转移[29]、肺转移[30]、脑转移[31],外放疗也可使转移灶缩小、症状缓解,从而带来临床获益。除了门静脉癌栓放疗有高级别循证医学证据,其他不同病期肝细胞癌放疗的循证医学证据级别与其他治疗手段一样,也没有很高级别的证据。尽管中晚期肝细胞癌患者接受外放疗往往以姑息减症为目的,但应充分考虑放疗可能带来的好处,并鼓励进行高级别的前瞻性临床研究。
3.1.2 肝细胞癌外放疗技术
3.1.2.1 放疗的目的 放疗目的可以分为根治性、姑息性、巩固或转化和辅助性(术前或术后)放疗。小肝癌的体部立体定向放疗应该以根治性为目的而中晚期肝细胞癌的放疗基本上属于姑息性放疗。姑息性放疗目的是减轻患者疼痛、梗阻或出血等症状,减缓肿瘤发展,从而有效地延长患者生存期。但对于一部分局限于肝内的中晚期肝细胞癌,通过姑息性放疗,可使得肿瘤缩小或降期,获得手术切除的机会(包括肝移植),从而可以从姑息转化为根治。对于窄切缘或裸切缘术后的肝细胞癌患者,术后辅助放疗可降低复发率,提高总生存率。门静脉癌栓患者接受术前新辅助放疗,生存期可以获得明显延长。
3.1.2.2 放疗靶区确定 肝细胞癌不仅会浸润周围的肝组织,还会通过淋巴管途径转移。因此,通常把肿瘤靶区视为两部分,一部分是肉眼或影像学上的可见病灶(gross tumor volume,GTV);另一部分是肉眼或影像学上看不见的病灶,需借助显微镜方能看到肿瘤细胞,或成为日后复发转移的常见区域,称为亚临床灶,如肿瘤边缘的微浸润灶和潜在转移危险的淋巴结引流区。放疗科医生把亚临床灶和可见病灶合在一起,统称为临床靶体积(clinical target volume,CTV)。GTV勾画应尽量参考多种影像学资料,肝内病灶的GTV勾画必须结合动脉相、静脉相互相参考;MRI对肝内病灶显示较为清楚,PET/CT可以了解肝外病灶情况。肝细胞癌出现淋巴引流区转移相当少见,因此,CTV一般不包括淋巴引流区。对于已经出现淋巴结转移的患者,CTV应包括其所在的淋巴引流区。其余情况(如局限于肝内、癌栓、肾上腺转移、肺转移等)的CTV根据不同的照射技术,在影像学可见病灶的基础上外扩0~4 mm[32]。肝内病灶的靶区勾画须参考动脉相、静脉相互相参考;此外,还应尽量参考多种影像学资料,如多模态MR影像等。肝癌放疗野设计的一个重要原则是充分利用正常肝组织所具有的强大再生能力。在设计放疗射野时,尤其是大肝癌,最好能保留一部分正常肝组织不受照射,让这部分正常肝组织在大部分肝脏受到照射的情况下得以再生。
3.1.2.3 放疗剂量确定 给于处方剂量必须考虑到3个重要因素:(1)肿瘤受到的照射剂量;(2)肿瘤周围正常组织受到的照射剂量;(3)非常规分割剂量如何换算为常规分割剂量。立体定向放疗属于根治性放疗,最佳的剂量分割模式目前还没有统一的标准,文献报道的放疗剂量跨度很大,总剂量为24~60 Gy,3~10次。研究认为高剂量的照射能提高治疗效果,比如Jang等[33]对82例肝细胞癌行射波刀的SBRT,其中高剂量组(>54 Gy/3f)的4.5年局控率和总生存率分别为100%和68%,明显高于低剂量组。也有研究显示较低剂量的照射也能取得较好的效果,Sanuki等[3]报道185例小肝癌患者接受基于常规加速器的SBRT,总剂量为40 Gy或35 Gy,分5次,3年局控率和总生存率分别为91%和70%。笔者考虑,用不同放疗设备进行SBRT,其对肿瘤的局控剂量存在不同,可能是分次放疗的时间长短存在很大差异,导致生物效应差异,这方面还有待积累更多的临床资料加以分析。 对姑息性放疗的肝细胞癌患者,肿瘤的放疗剂量取决于全肝和/或周围脏器的耐受量,通常可给予40~60 Gy的常规分割或等效生物剂量。肝脏的放射耐受剂量视患者肝功能情况及每次的分割剂量有所不同。正常肝体积也是影响因素。肝功能为Child-Pugh A者,三维适形放疗时,常规分割放疗全肝耐受量为28~30 Gy[34],或非常规分割放疗全肝耐受量为23 Gy(每次分割剂量4~8 Gy)[35],或常规分割放疗肝脏耐受量V30<60%[36];SBRT时,正常肝体积>700 cm3,<15 Gy×3f,或正常肝体积>800 cm3,<18 Gy×3f,这些剂量是安全的[37]。肝功能为Child-Pugh B者,肝脏对射线的耐受剂量明显下降。由于亚洲肝细胞癌患者常伴有肝硬化和脾功能亢进,导致胃肠道静脉扩张和凝血功能较差,胃肠道的放射耐受剂量低于RTOG的推荐剂量。韩国报道,123例肝细胞癌患者接受45 Gy/25f的三维适形放疗,23例(18.7%)出现上消化道出血,经胃镜证实,13例(10.6%)为放射线诱发的胃肠道出血[38]。非立体定向放疗的低分割外放疗,利用L-Q模型将其放疗剂量换算为生物等效剂量(BED),有HBV感染者的肝细胞α/β比值取8 Gy[39],肿瘤细胞α/β比值取12~15 Gy[40-41],作为剂量换算参考。
3.1.2.4 放疗技术的选择 二维放疗已成历史,三维适形放疗、调强放射治疗已经普及。实践证明,在肝脏呼吸动度<1 cm 的情况下,可以用常规加速器调强放疗技术治疗不能手术切除的肝癌[42]。螺旋断层放疗的优点是适用于多靶区治疗,且具有较好的剂量学分布优势,但在肝细胞癌应用也需要考虑可以牺牲靶区适形度,也要尽量减少对正常肝脏组织的照射。立体定向放疗主要适用于小肝癌,在大肝癌或癌栓上的应用也有所报道[43-44]。质子、重离子等粒子治疗(particle therapy)肝细胞癌已逐步开展,其毒副作用小,但目前尚缺少疗效比较的临床研究。肝癌的放疗究竟选择哪一种放疗技术,有条件的放疗中心应该建议选择图像引导放疗(IGRT)以提高治疗疗效,减少放疗次数,缩短放疗总时间。与三维适形放疗比较,IGRT可以明显延长局限于肝内大肝癌的总体生存期,从24个月延长到44.7个月(P=0.009)[45]; 延长肝细胞癌伴有门静脉和/或下腔静脉癌栓的患者总体生存期,从10.5个月延长到15.5个月(P=0.005)[46];提高肝细胞伴腹腔淋巴结转移患者的1年生存期,从38%提高到69%(P=0.006)[47]。韩国也有类似报道,IGRT可明显提高患者生存率,并减少放疗次数[48]。螺旋断层放疗最适合多发病灶的肝细胞癌患者,韩国报道利用断层放疗技术治疗同时存在肝内和肝外病灶(肺、肾上腺、软组织转移)的患者,每例患者平均3.5个病灶,结果显示中位生存时间为12.3个月,放疗病灶的1年局部控制率为79%,且未发生4级毒副反应[49]。立体定向放疗用于小肝癌的治疗,必须满足以下条件:四维CT的影像引导或肿瘤追踪系统,非常精确的体位固定,放疗前的个体化图像校正,放射线聚焦到肿瘤,以及肿瘤外放疗剂量跌落快。粒子线治疗肝细胞癌已有不少报道。其中美国的一项研究发现,局限于肝内的76例肝细胞癌患者(平均最大径5.5 cm)接受质子放疗,其3年无进展生存率为60%,而且无明显毒副作用[50]。另一项纳入44例局限肝内的肝细胞癌,中位最大径5 cm(1.9~12.0 cm),放疗58 Gy/15f,2年总体生存率为63.2%[51]。一项Meta分析包括了70篇粒子治疗肝细胞癌的临床研究报告,患者的生存率高,毒副反应小[52]。还有研究报道,符合米兰或旧金山肝移植标准的肝细胞癌69例,随机分为36例介入治疗,33例接受质子放疗,其中,介入组10例(10/36)获得肝移植机会,质子组12例(12/33)获得肝移植机会。术后病理检查发现,介入组完全病理缓解率为10%,质子组为25%。两组患者肝移植后的生存率无显著差别。因此,质子放疗和介入治疗一样,可以使肿瘤降期,获得肝移植机会[53]。目前尚缺乏临床研究支持粒子治疗肝细胞癌较光子线有生存优势。 呼吸运动是导致肝脏肿瘤在放疗过程中出现位移和形变的主要原因,器官运动引起的CTV内边界位置变化,称为内靶区(internal target volume,ITV)。目前,多种技术已用于减少呼吸运动带来的ITV变化,这些技术覆盖了肝癌放疗从靶区勾画到治疗评估的各个环节。以照射过程为例,常用技术包括:门控技术、实时追踪技术、呼吸控制技术和四维CT技术等。不管使用哪项技术,利用腹部加压能够简单易行地减少肝脏的呼吸动度,腹部加压的部位应该在剑突与脐连线的上半部,可以最大程度减少肝脏的呼吸动度[54]。
3.1.2.5 是否需要结合其他治疗手段 (1)与手术的结合:对局限于肝内的大肝癌如果不宜手术切除者,通过TACE、放疗的综合治疗,使肿瘤缩小或降期,可让一部分患者获得手术切除机会,从不能根治到获得根治;门静脉癌栓患者接受术前新辅助放疗,较不放疗者生存期明显延长[24];对R2切除者的外放疗是否有生存优势未见报道,但是,对肝门区的肝内肿瘤,手术切缘<1 cm,术后辅助放疗可降低复发率,提高总生存率和无病生存率[33];对等待肝移植的肝细胞癌患者,放疗可以延缓肿瘤进展或降期,是安全有效的衔接治疗。(2)与TACE的结合:临床上,外放疗常联合TACE,韩国多中心回顾性分析显示,78.4%接受外放疗的肝细胞癌患者,都接受过TACE[55]。TACE可以栓塞肿瘤的动脉血供,减少肿瘤负荷,延缓肿瘤进展。TACE联合外放疗,可提高肿瘤控制率和延长患者生存期,Meta分析显示介入治疗结合外放疗,其3年生存率较单纯介入提高10%~28%[15-16]。对肝内肿瘤伴有动静脉瘘的患者,外放疗可使20%患者动静脉瘘消失,从而继续接受介入治疗[56]。对伴有肝外转移者,可对肝内病灶进行TACE,肝外病灶进行外放疗,以减轻患者症状。研究[57]显示,肝内病灶TACE 2周后进行外放疗,可出现轻度的肝功能异常,但CTCAE≥3级的肝损伤仅2.5%。因此,建议TACE 2周后便可以进行外放疗。(3)与肝动脉灌注化疗的结合:韩国2个肿瘤治疗中心的回顾性研究,将Ⅲ或Ⅳ期肝细胞癌患者进行配对分析,比较了106例经肝动脉灌注5-FU和顺铂局部化疗结合同步外放疗,和106例未接受化疗的单纯放疗患者,两组中位生存时间分别为11.4个月和6.6个月,差异具有统计学意义(P=0.02)[58]。对中晚期肝细胞癌患者,外放疗结合5-FU动脉灌注可能有生存获益。(4)与分子靶向药物的结合:亚太地区临床试验显示,索拉非尼可以延长晚期肝细胞癌患者总体生存期约3个月[59],放疗亦能提高患者局部控制率和延长生存期。Ⅱ期临床研究显示,索拉非尼联合外放疗,疗效不仅没有提高,反而增加了毒副作用,因此,肝内病灶放疗必须谨慎联合使用索拉非尼[60]。而近年来新的靶向药物,如仑伐替尼、瑞格非尼等,是否适合与放疗的同步治疗,仍需要证据的支持。(5)与免疫治疗的结合:肝细胞癌的免疫治疗(如PD-1抑制剂等),近几年也取得了一定的进展,特别是与抗血管靶向药物的联合治疗,最新的IMbrave150 Ⅲ期研究[61]进行阿特珠单抗联合贝伐珠单抗与索拉非尼在肝癌一线治疗上的对比,在意向治疗人群中,联合用药组的死亡风险降低了42%(分层HR=0.58;95%CI:0.42~0.79;P<0.001),同时接受联合治疗患者的PFS明显延长(6.8个月vs 4.3个月,P<0.001)。放疗和免疫治疗的联合理论上具有协同增效的作用[62-63],相关的临床研究也正在进行中。(6)放疗中抗肝炎病毒治疗:韩国报道48例HBV感染并发肝细胞癌的患者接受外放疗,16例放疗前和放疗中服用拉米夫定,32例未服用抗病毒药物,结果显示未抗病毒组发生21.8%(7/32)HBV复制,抗病毒组则未发生病毒复制,两组HBV活动发生率差异有统计学意义[64]。因此,对于HBV-DNA阳性的肝癌患者建议应用核苷类药物(NAs)抗病毒治疗,并优先选择恩替卡韦(ETV)或替诺福韦酯(TDF)治疗[65],防止HBV复制活跃。
3.1.3 放射诱发肝损伤的诊断 对肝内肿瘤的放疗,可能诱发不同程度的肝损伤,轻者表现为Child-Pugh评分上升、转氨酶上升,严重者可以出现放射性肝病(radiation-induced liver disease,RILD)。RILD是肝脏放疗的剂量限制性并发症,尤其是肝癌伴肝硬化患者。放射性肝病诊断标准仍然采用1992年Lawrence的定义,分典型性和非典型性两种。(1)典型RILD:碱性磷酸酶(AKP)升高>2倍,无黄疸,排除肿瘤进展导致腹水、肝肿大。(2)非典型RILD:转氨酶超过正常最高值或治疗前水平的5倍。RILD必须与药物性肝炎、介入治疗引起的肝损伤、病毒性肝炎急性发作、梗阻性黄疸和肝内肿瘤进展等情况进行鉴别。一旦发生RILD,患者死亡率极高[66]。因此,先前存在肝病的肝癌患者选择放疗时必须谨慎[67]。
3.1.4 随访
肝细胞癌放疗后随访,注意观察:(1)受照射肿瘤的局部控制情况;(2)肿瘤周围危及器官特别是正常肝组织和消化道毒副反应并给予及时处理;(3)照射野外的肿瘤进展情况。放疗后1.5个月随访一次,以后每隔3个月随访一次,2年后原发灶和转移灶都控制良好的情况下,每半年随访一次。
3.1.4.1 影像学的变化 (1)肿瘤:放疗过程中和放疗结束时,肿瘤体积多保持稳定,较少出现肿瘤缩小,尤其介入治疗后,碘油沉积,肿瘤是否存活更加难定。采用不同的评价标准和在不同的时间评价,其结果往往也不一样。Price等[11]分析了26例行肝癌立体定向放疗的患者,以实体瘤的疗效评价标准(RECIST)评价放疗效果,放疗后12个月完全缓解者占15%,以欧洲肝病学会(EASL)标准评价,完全缓解率50%;RECIST标准评价为部分缓解9例,稳定1例,但以EASL标准评价则为完全缓解,明显的缓解出现在放疗结束后9个月。因此,肝细胞癌立体定向放疗的疗效评价EASL标准要优于RECIST标准。同样地,改良RECIST标准也能较好的反映放疗后肿瘤缓解情况[68]。此外,根据立体定向放疗作为原位肝移植术的“桥梁”治疗的临床研究结果[9,69-70],分析立体定向放疗后肿瘤组织的病理学特点,病理完全缓解率达27%;然而,大部分立体定向放疗临床研究的局部控制率为70%~100%,这与立体定向放疗后肿瘤细胞坏死需要相当长的时间有关,影像学评价的中位随访时间为12~24个月,而肝移植往往在立体定向放疗后4~7个月进行,可见,评价时间不同,疗效也有可能不同。因此,评价立体定向放疗的真实疗效需要仔细的连续动态观察,直到肿瘤进展。(2)正常肝组织:放疗后肝实质的病理组织学特征为血管闭塞性疾病(veno-occlusive disease,VOD)[71-72]。Olsen等[73]报道2例立体定向放疗后行手术切除的患者,放射性肝损伤的病理表现为病灶区伴中央小叶堵塞和纤维化的血管闭塞性疾病,同时放射肝实质区和非放射肝实质区的界线清晰。由此,受照射肝实质在CT上往往表现为边界清楚的低密度区,称为肝实质对放射线的反应[74-76],这个区域与周围肝实质界线清晰,增强CT时通常表现为门静脉期或延迟期增强。根据动态增强CT评价伴肝硬化患者放射诱导的肝实质反应,开始的中位时间为治疗后3个月,高峰期为治疗后6个月,治疗后9个月开始消失,至少三分之一的患者在治疗后12个月甚至更长的时间保留这些变化。需要注意的是,这种变化不要误认为是局部复发,因为立体定向放疗后肿瘤活性存在的时间与该时间窗有重叠[75]。
3.1.4.2 实验室检查 放疗前后必须完成血常规、血生化、出凝血酶原时间等检验;如果肿瘤标志物(AFP、CA199、CEA)升高,也必须随访这些指标;HBV DNA在放疗前必查,放疗后视情况(放疗前升高者,口服抗病毒治疗药物后需要监测,每月1次)。
3.1.4.3 PET-CT检查 为排除肝外转移,有条件者可以推荐全身PET-CT检查。
3.1.5 推荐 (1)肝细胞癌患者无论肿瘤位于何处,都可以考虑外放疗可能带来的好处,但肝功能为Child-Pugh C级是肝内病灶放疗的相对禁忌,循证级别 B1。(2)小肝癌不宜手术切除者,体部立体定向放疗与射频消融一样,作为不能手术的肝细胞癌的替代治疗手段,循证级别 B1。(3)肝细胞癌窄切缘需要术后辅助放疗,循证级别 B1。(4)对局限于肝内的肝细胞癌,接受介入栓塞化疗后有肿瘤残存者,外放疗可以补充介入治疗的不足,巩固疗效,延长患者生存期,循证级别 B1。(5)不能手术的肝细胞癌伴有门静脉/下腔静脉癌栓者,应该给予外放疗,循证级别 A2;癌栓位于门静脉分支,原发肝内肿瘤可切除,可以考虑新辅助放疗后,再行手术切除,循证级别 A2。(6)肝细胞癌肝外转移(淋巴结、骨、肾上腺、肺、脑转移等),转移灶浸润、压迫导致的症状如疼痛、黄疸、咳嗽等,外放疗可以有效缓解症状,提高生存质量,循证级别 B1。(7)肝功能为Child-Pugh A级者,全肝耐受放疗剂量为28~30 Gy(常规分割),或23 Gy(4~8 Gy低分割),V30≤60%,循证级别 B1。
3.2 肝细胞癌的内放疗 文献报道的原发性肝癌内放疗包括:90Y玻璃微球疗法、131I单克隆抗体、放射性碘化油、125I粒子植入。90Y玻璃微球经过肝动脉,进入肿瘤血管,发出β射线,杀灭肿瘤。国外回顾性研究比较86例BCLC分期为B期的肝细胞癌患者,42例接受常规介入治疗,44例接受90Y微球疗法,而且总体生存期分别为18个月和16.4个月,差异无统计学意义[77]。对BCLC分期为C期的肝细胞癌患者,如果伴发门静脉主干癌栓,则接受常规介入栓塞治疗有风险,由于90Y玻璃微球不通过栓塞肿瘤血管而发挥作用,因而具有优势[78]。也有报道采用90Y玻璃微球作为肝移植前肝源等待期的衔接治疗[79]。总体而言,常规的碘油介入栓塞化疗和90Y玻璃微球疗法的总生存期相似[80]。但是,肿瘤内伴有动静脉瘘的患者不宜使用90Y玻璃微球。目前,90Y玻璃微球治疗肝细胞癌缺乏多中心随机对照的临床研究,回顾性分析未显示出明显优势,以及存在核素放射性衰减及防护问题。国内90Y玻璃微球的应用尚未经过SFDA批准,在BCLC的分期和诊治指南中,亦未推荐90Y用于肝细胞癌的治疗。放射性粒子植入是局部治疗肝细胞癌的一种有效方法,放射性粒子可持续产生低能X射线或γ射线,在肿瘤组织或受肿瘤侵犯的管腔(门静脉、下腔静脉或胆道)内植入放射性粒子后,通过持续低剂量辐射,最大程度杀伤肿瘤细胞。125I粒子植入技术包括组织间植入、门静脉植入、下腔静脉植入和胆道内植入,分别治疗肝内病灶、门静脉癌栓、下腔静脉癌栓和胆管内癌或癌栓。方主亭等[81]采用血管内植入125I粒子条及支架联合介入栓塞治疗223例肝癌合并门静脉主干癌栓患者,给予癌栓的放射剂量为150.4±4.6(138.6~159.9)Gy,中位生存时间为(505.8±45.8) d,术后1、2年生存率分别为53.3%、36.9%。目前,国际通用巴黎系统标准要求植入的放射源活度均匀、相互平行、距离相等,各源中心应处于同一平面,这就必须有内放疗计划系统的引导。但即便有治疗计划系统,由于穿刺植入途径可能存在阻挡或需避开周围敏感器官以及操作手法误差,很难准确地植入肿瘤靶区,尤其是边缘区剂量的绝对均匀;此外,除125I粒子条腔内植入外,组织间粒子植入后移位、迁徙甚至异位栓塞等并发症,同样缺乏有效防治措施。其他国家的肝细胞癌诊治指南未推荐125I内放疗。
4 肝内胆管细胞癌(ICC)
ICC是指起源于二级胆管及其分支上皮的腺癌。
4.1 各病期接受外放疗的获益情况
4.1.1 小病灶ICC的立体定向放疗 ICC容易出现淋巴结转移和沿肝内胆管浸润性生长,符合立体定向放疗指征的病例不多。国内外一些小样本的回顾性研究报道,ICC接受立体定向放疗的中位生存时间约10~17个月[82-85]。美国Mayo医院报道10例ICC接受45~60 Gy/3~5f的立体定向放疗,局部控制率为100%,失败的主要原因是照射野外的肝转移病灶复发,或肝外扩散[86]。德国的一项多中心的胆管癌SBRT病例回顾性研究中,50%是ICC病灶(41/82),发现BED是影响局部控制制率和生存率的唯一预后因素,3级消化道出血发生率4.7%[85]。另一篇报道34例不宜手术切除的ICC接受立体定向放疗,采用30 Gy/3f方式,局部控制率79%,中位生存时间为17个月,3级毒副反应发生率12%[87]。综合目前的资料,立体定向放疗可作为不宜手术切除或射频消融,早期ICC的替代治疗手段。但对于接近肝门部的ICC,必须慎重使用立体定向放疗技术,因离胃窦十二指肠较近,易发生穿孔出血、梗阻等严重副反应。
4.1.2 不能手术切除的ICC的放疗 复旦大学中山医院回顾性分析84例不能手术切除的ICC,35例接受放疗,49例不接受放疗,放疗组的中位生存时间是9.5个月,1、2年生存率分别是38.5%、9.6%,而非放疗组患者的中位生存时间是5.1个月,1、2年生存率分别是16.4%、4.9%,两组差异有统计学意义(P= 0.003)。多因素分析显示是否接受放疗是独立预后因素[88]。美国Lawrrence 选择46例ICC,患者的入选标准包括:预计生存超过12周,ECOG评分≤2分,肝肾功能正常,骨髓储存功能好,15%以上的正常肝不在照射野中,NTCP计算放射性肝损伤概率<10%。患者经三维适形放疗和动脉灌注5-FU化疗,中位生存期达到13.3个月,生存率优于历史对照[89]。美国多中心Ⅱ期临床研究,用质子放疗37例ICC,肿瘤的中位最大径为6 cm(2.2~10.9 cm),放疗剂量为67.5 Gy/15f,2年总体生存率为46.5%,局部控制率为94%[51]。一项基于中国台湾癌症注册数据库的群体病例队列研究,采用倾向匹配法纳入了844例不能手术的无远处转移的ICC患者,分为同步放化疗、序贯化放疗、单纯化疗和姑息对症治疗4组,多因素分析结果同步放化疗相对于姑息治疗可降低35%的死亡风险,且优于序贯化放疗和单纯化疗[90]。
4.1.3 手术切除后ICC的放疗 (1)R0切除:153例ICC R0切除,93例(60.8%)术后复发,仅16例(17.2%)复发部位在切缘2 cm以内或淋巴转移区,由于这些部位属于术后辅助放疗区域,因此,术后放疗很难降低复发率[91]。有Meta分析表明,R0切除的ICC术后辅助放化疗,不能改善预后[92]。(2)R1切除:中国医学科学院肿瘤医院报道,38例ICC邻近大血管,无切缘切除(null-margin resection,一种特殊的R1切除方式),14例术后接受50~60 Gy的调强放疗,24例未接受放疗,放疗组的总体中位生存时间为21.8个月,未放疗组仅为15.0个月,两组差异有统计学意义(P=0.049)[93]。中国台湾一项基于数据库的回顾分析纳入了599例ICC术后辅助治疗的患者,其中174例接受同步放化疗,146例接受了序贯化疗加放疗,279例仅单纯化疗,多因素分析提示切缘阳性是独立的预后不良因素,分层Cox比例风险模型可见术后辅助同步放化疗与单纯化疗相比,可降低AJCC病理Ⅲ、Ⅳ期且R1切除患者49%的死亡风险,对于Ⅰ、Ⅱ期且R1切除患者亦可降低35%的死亡风险[94]。(3)R2切除:复旦大学中山医院回顾性分析1999年到2008年90例ICC,初诊即存在影像学上的腹腔淋巴结转移,给予肝内病灶手术切除,24例接受术后转移淋巴结的常规分割放疗,剂量为34~60 Gy(中位50 Gy),66例术后不放疗。放疗组淋巴结完全缓解率和部分缓解率分别为37.5%(9/24)和37.5%(9/24),放疗组中位生存时间为19.1个月,未放疗组患者为9.5个月(P=0.011)。放疗组与未放疗组患者死于淋巴结转移分别为12.5%和16.7%,两组差异无统计学意义,但未放疗组患者肝内转移病灶复发者多见[95]。
4.2 放疗技术
ICC的放疗技术和肝细胞癌大致一样(见肝细胞癌放疗技术),但在照射野的确定与其他治疗结合方面略有不同。
4.2.1 照射野的确定 对肝内不能手术切除的胆管细胞癌,GTV为肝内的病灶,如果伴有淋巴结转移,则必须包括淋巴引流区;如果没有淋巴结转移的患者,CTV是否扩大到淋巴引流区尚无临床依据。ICC GTV到CTV外扩5~8 mm[96]。
4.2.2 放疗中是否联合化疗或介入治疗 尽管ICC缺少化疗或介入治疗的高级别临床试验,对比历史资料,化疗或介入栓塞化疗,可延长患者生存期。化疗或介入治疗结合外放疗也缺少高级别循证医学证据,但就目前的报道,化疗结合外放疗,患者生存期可能最长[88,97]。化疗药物可实现放射增敏,也可减少远处转移,值得有待进一步研究。
4.3 推荐 (1)小的ICC不宜外科手术切除者,应该考虑体部立体定向放疗,循证等级C1。(2)不能手术切除的ICC,可以接受外放疗或放化疗结合的综合治疗,循证等级B1。(3)对R0切除的ICC,不必术后辅助放化疗;R1或R2切除者,术后放化疗可以延长患者生存期,循证等级C1。
专家共识编审委员会
主任委员:曾昭冲
副主任委员(按姓氏拼音排序):
程树群 高献书 康静波 曲宝林 王若雨
秘书:陈一兴
委员(按姓氏拼音排序):
蔡博宁 陈 波 陈一兴 邓立勇 董丽华 丁丽娟 杜乐辉
杜世锁 胡 凯 胡 永 黎 功 李 平 李 玉 梁 平
梁世雄 刘孟忠 刘施亮 刘小亮 陆海杰 马 娜 孟 岩
苏廷世 孙 菁 孙建国 王 阁 王 竞 王建华 王维虎
王跃辉 吴德华 吴志峰 习 勉 肖 蕾 徐本华 徐寿平
闫 婧 杨 健 俞 伟 袁响林 袁智勇 岳金波 张火俊
张建英 赵向飞 周乐源 竺鑫丽
执笔:曾昭冲 陈一兴
