TRIM28siRNA抑制非小细胞肺癌A549裸鼠移植瘤生长以及促进凋亡的研究*
2021-03-02张子平闫皓翔李霄雨宋芳戎子炎高淑超褚升瑞魏泽浩许倩刘镭
张子平,闫皓翔,李霄雨,宋芳,戎子炎,高淑超,褚升瑞,魏泽浩,许倩,刘镭
承德医学院 1基础医学院2017级临床医学本科班;2基础医学院2016级临床医学本科班;3基础医学院2018级麻醉本科班;4基础医学院2018级临床医学本科班;5基础医学院基础医学研究所;6基础医学院免疫学教研室(河北承德 067000)
肺癌是全世界范围内发病率最高的恶性肿瘤疾病,其中80%以上属于非小细胞肺癌 (non-small cell lung cancer,NSCLC)[1],5年存活率平均为15%。NSCLC往往早期就会侵犯血管,易发生远处转移,这些不适合手术切除的NSCLC患者,即使经过化疗后,患者的5年生存率也仅为5%[2]。而且,目前临床治疗药物均具有明显的毒不良反应,因此探索肺癌的发病机制,寻找新的高效的治疗靶点是国内外研究的热点之一。课题组前期研究表明[3],TRIM28基因在NSCLC细胞系和组织中均高表达。TRIM28能够促进肺癌细胞的生长,敲低NSCLC细胞株中TRIM28基因的表达,显著降低了细胞的增殖并抑制了细胞周期的进展。大量研究证实,TRIM28是三基序超家族的重要成员,具有调节胚胎发育、染色质组织、红细胞分化和DNA损伤反应等重要功能[4-6]。同时,TRIM28也是一种广泛的KRAB锌指蛋白共抑制因子。研究表明,TRIM28还在多种肿瘤的癌变和转移中发挥作用,如宫颈癌、乳腺癌、结直肠癌、胃癌、卡波西肉瘤和卵巢癌[7-10]。下调TRIM28基因表达可降低肿瘤干细胞的自我更新能力,明显抑制肿瘤生长。短发夹RNA(short hairpin RNA,shRNA)介导的TRIM28缺失可导致E-cadherin和N-cadherin启动子上组蛋白的乙酰化和甲基化,进而阻断了转化生长因子-β(transforming growth factor-β,TGF-β)诱导的上皮-间质转化。TRIM28功能缺失能够导致细胞周期、细胞应激反应性、癌细胞代谢的失调,并抑制氧化磷酸化的发生[11]。尽管TRIM28的这些生物学功能是众所周知的,但人们对TRIM28在NSCLC中的作用机制却知之甚少。2018年10月至2020年1月,我们用NSCLC细胞A549建立了裸鼠皮下移植瘤模型,并进一步观察TRIM28基因敲除在NSCLC裸鼠移植瘤模型中具有抗肿瘤和促凋亡活性,以期为NSCLC有效治疗策略的制定提供理论依据。
1 材料与方法
1.1 材料 人NSCLC细胞系A549为本实验室保存。Balb/c裸鼠购自北京维通利华实验动物技术有限公司。RPMI1640培养基和胎牛血清均购自GIBICO公司(美国)。反转录试剂盒、SYBR Green PCR master mix购自TaKaRa公司(日本);抗绿色荧光蛋白(green fluorescent protein,GFP)单克隆抗体、兔抗人Ki-67、Bax、Bcl-2、Caspase3、β-actin 单克隆抗体,及辣根过氧化物酶(Horseradish Peroxidase,HRP)标记二抗均为Abcam 公司(美国)产品;脱氧尿苷三磷酸缺口末端标记(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling,TUNEL)试剂盒购自碧云天生物试剂公司(中国)。
1.2 细胞培养 A549细胞采用RPMI1640培养基(含10%胎牛血清)于CO2培养箱(37℃、5% CO2)静置培养。当细胞生长状态良好并且融合度达到80%左右时,用2.5 g/L的胰蛋白酶消化进行细胞传代。
1.3 裸鼠皮下移植瘤模型的建立和鉴定 取Balb/c雌性裸鼠6只,4只为实验组,2只为对照组。1×107个A549细胞溶解于0.2 mL培养基中制成细胞悬液,每只实验组裸鼠右侧股背处皮下注射。对照组裸鼠于相同部位注射0.2 mL培养基。每天观察裸鼠的一般状况,间日测量裸鼠体重,并测量皮下肿瘤的长径a和短径b,根据公式V=1/2(ab2)计算肿瘤体积。待肿瘤体积达到0.5 cm3时,视为造模成功。裸鼠于皮下注射4周,麻醉后摘眼球处死,取皮下肿瘤组织在10%甲醛溶液中固定,常规脱水、透明、浸蜡,石蜡包埋,切片4 μm,行苏木精-伊红(hematoxylin-eosin,HE)染色。本实验在承德医学院伦理委员会批准和监督下进行。
1.4 TRIM28稳定干扰A549细胞株建立 针对TRIM28 的小干扰RNA(small interfering RNA,siRNA)由上海吉玛生物公司合成,TRIM28siRNA靶向序列为:5′-CACTGAGGACTACAACCTT-3′;5′-GCGATCTGGTTATGTGCAA-3′。将0.5 μg pLVTHM/TRIM28 siRNA表达载体(或对照载体)和1.5 μg混合包装载体质粒混匀于250 μL OPTIMEM无血清培养基中,10 μL Lipofectamine 2000共转染293T细胞,24 h后更换成RPMI1640完全培养液。72 h后收集细胞上清液,0.45 μm滤膜过滤分装即为病毒液,-70℃ 保存备用。病毒液感染A549细胞后,应用抗GFP单克隆抗体和流式细胞术筛选阳性克隆细胞。
1.5 TRIM28 siRNA抑制裸鼠成瘤实验 10只裸鼠随机分为2组,每组5只。第1组皮下注射A549/TRIM28siRNA细胞(TRIM28siRNA组),第2组皮下注射A549/ControlsiRNA细胞(ControlsiRNA组)。每天观察小鼠的生存状况,隔天测量1次小鼠体重和肿瘤大小。注射4周后麻醉处死动物,切除肿瘤并称量肿瘤重量。
1.6 移植瘤组织学检测 皮下肿瘤组织在10%甲醛溶液中固定,常规脱水、透明、浸蜡,石蜡包埋,切片4 μm,行HE染色。采用链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)免疫组化法检测Ki-67的表达,1∶1 000稀释度的兔抗人Ki-67单克隆抗体作为一抗,生物素化羊抗兔IgG作为二抗,稀释度1∶2 000,Image Pro Plus软件进行定量分析。
1.7 TUNEL测定法 将小鼠移植瘤石蜡切片脱蜡、水合,PBS漂洗后用枸橼酸钠和Triton X-100处理,按TUNEL试剂盒操作步骤,配置反应混合液,并加入到样品上,避光放置2 h后,荧光显微镜下观察,每张片上随机选取5个视野,按如下公式计算凋亡指数(apoptosis index,AI):AI=具有凋亡核的细胞数/计数的细胞总数×100。
1.8 实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)方法 按Trizol说明书进行操作,首先抽提细胞总RNA,取500 ng RNA进行反转录反应。以cDNA为模板,0.2 μmol/L上下游引物,并加入SYBR Green PCR master mix配制20 μL PCR反应体系,引物序列如下:Bal-2:上游5′-AGGGGGAAACACCAGAAT-3′;下游5′-GGTAGCGACGAGAGAAGTCA-3′,Bax:上游5′-CCAGGATGCGTCCACCAA-3′;下游5′-CAAAGTAGAAGAGGGCAACCAC-3′,Caspase3:上游5′-GGCGTGAAGACATTTTGGAA-3′;下游5′-CGGGAGTAGTCGCCTCTGAA-3′。扩增条件为94℃ 10 min,94℃ 15 s,60℃ 25 s,72℃ 35 s,共40个循环。GAPDH 作为内参,每样本设3个复孔。按下列公式计算各组目的基因的相对表达量(Q)。ΔCt目的基因=Ct目的基因-CtGAPDH;ΔΔCt=ΔCt实验组-△Ct对照组;Q=2-ΔΔCt。
1.9 Western blot检测 两组移植瘤加裂解液后匀浆,取上清液,BCA法测蛋白浓度。等量蛋白首先经SDS-PAGE电泳分离后,再转移到PVDF膜。5%脱脂奶粉室温封闭2 h,加兔抗人Bal-2、Bax或Caspase3单克隆抗体(1∶1 000)孵育4℃过夜,经TBST洗涤后,加HRP标记的二抗(1∶2 000),室温孵育2 h,TBST洗涤后,ECL发光液显色曝光,并在Quantity One分析软件上测定条带灰度值,计算蛋白相对含量。
1.10 统计学方法 使用SPSS 19.0统计软件,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 成功建立NSCLC A549细胞裸鼠移植瘤模型 A549细胞悬液接种于裸鼠股背处,5~7 d肉眼可见移植瘤形成,平均潜伏期为(5.00±1.15)d。4周后,移植瘤体积达到(1.93±0.15) cm3,肿瘤体积生长情况见图1-A。4只实验组裸鼠全部成瘤,成瘤率为100%;2只对照组裸鼠无成瘤。实验组裸鼠体重增长减缓,与对照组裸鼠比较,差异有统计学意义(t=-9.275,P=0.001),见图1-B。裸鼠麻醉后处死,解剖取移植瘤,经HE染色,光镜下观察可见大量增生细胞,细胞异型性明显,形态、大小不一,细胞核体积增大,着色加深,伴出血坏死,可见红细胞,见图1-C。

注:A:4只实验裸鼠移植瘤体积生长曲线;B:实验组和对照组裸鼠体重变化;C:裸鼠移植瘤HE染色。*P<0.05
2.2 TRIM28基因敲除抑制裸鼠移植瘤的生长 两组裸鼠分别皮下注射A549/TRIM28siRNA细胞和A549/controlsiRNA细胞。4周后麻醉处死裸鼠,观察移植瘤生长情况,发现TRIM28siRNA组裸鼠移植瘤比ControlsiRNA组肿瘤更小(图2-A)。注射A549/controlsiRNA细胞的裸鼠在1周内出现肿瘤,而注射A549/TRIM28siRNA细胞的裸鼠均在1周以后形成肿瘤(图2-B)。4周后TRIM28siRNA组和ControlsiRNA组裸鼠移植瘤体积分别为(1.13±0.08)cm3和(1.82±0.28)cm3,差异有统计学意义(t=-5.432,P=0.001)(图2-B)。另外,与ControlsiRNA组[(0.98±0.08)g]相比,A549细胞中沉默TRIM28后可显著降低移植瘤重量[(0.41±0.08)g;t=-11.489,P<0.001;图2-C]。实验期间,TRIM28siRNA组裸鼠体重[(22.20±0.70)g]明显高于ControlsiRNA组[(20.48±0.52)g;t=-4.500,P=0.002;图2-D]。
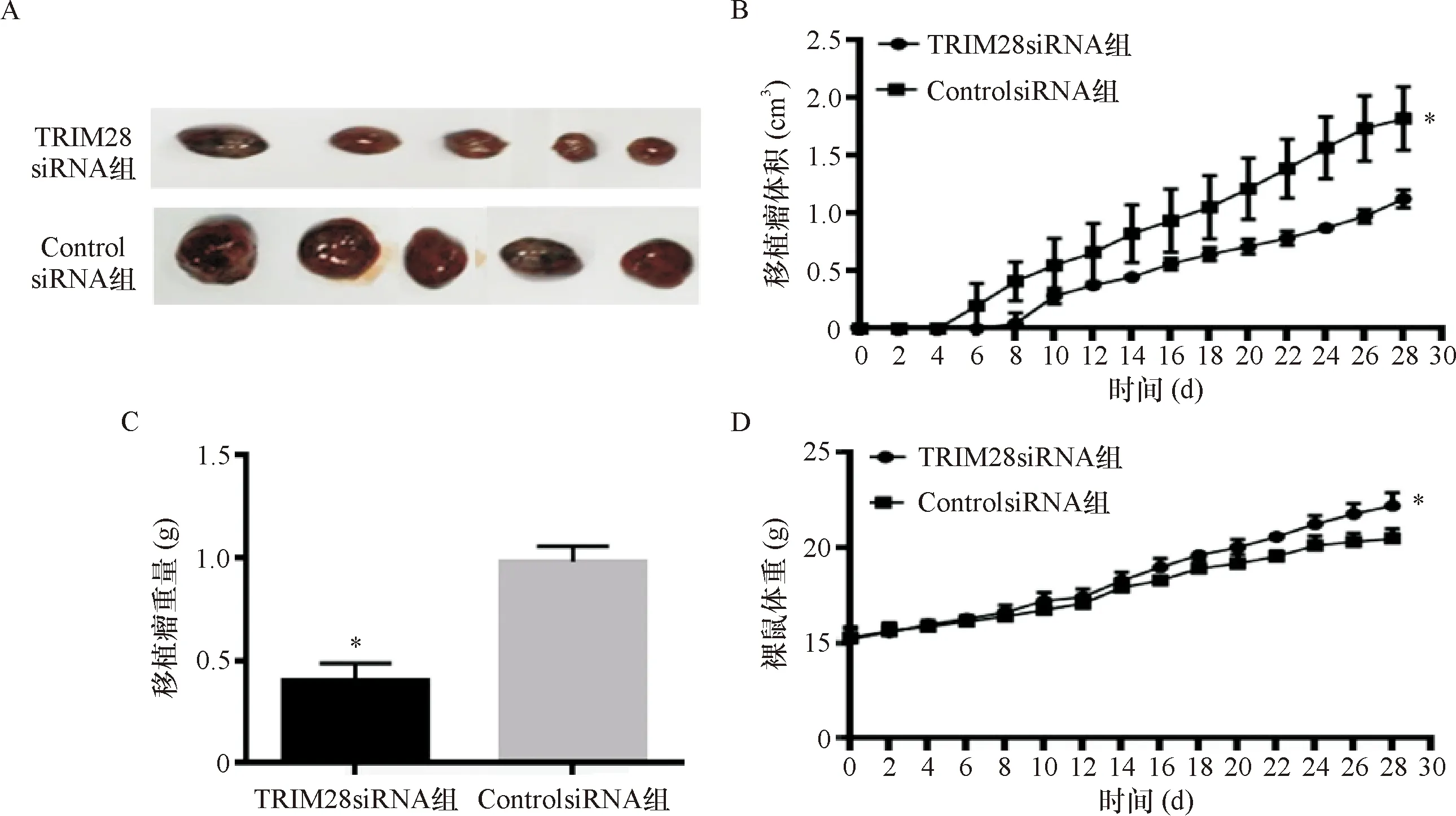
注:A:TRIM28siRNA组和ControlsiRNA组裸鼠移植瘤图像;B:两组裸鼠移植瘤体积变化;C:两组移植瘤重量比较;D:两组裸鼠体重变化。*与ControlsiRNA组比较P<0.05
2.3 TRIM28siRNA诱导裸鼠移植瘤细胞凋亡 肿瘤组织的HE染色显示,注射A549/ControlsiRNA细胞的裸鼠移植瘤组织中富含充满红细胞的微血管(图3-A右);但是,在注射A549/TRIM28siRNA细胞的裸鼠移植瘤中很少观察到微血管(图3-A左)。Ki-67染色检测细胞增殖情况,结果可见,TRIM28siRNA组裸鼠移植瘤组织中Ki-67的表达水平[(21±4.36)%]明显少于ControlsiRNA组[(52±10.15)%;t=-4.861,P=0.008];见图3-B和3-C。TUNEL法检测裸鼠移植瘤细胞凋亡情况,与对照组相比,TRIM28基因敲除显著诱导细胞凋亡(图3-D)。注射A549/TRIM28siRNA和A549/controlsiRNA细胞的裸鼠移植瘤组织中,TUNEL阳性细胞的百分率分别为(58.67±7.77)%和(15.00±3.00)%,差异有统计学意义(t=-9.083,P=0.001);见图3-E。
2.4 TRIM28基因敲除对Bcl-2、Bax和Caspase3表达水平的影响 采用实时荧光定量PCR和western-blot法检测抗凋亡基因Bcl-2和促凋亡基因Bax、Caspase3的表达水平。与ControlsiRNA组相比,注射A549/TRIM28siRNA细胞的裸鼠移植瘤组织中Bcl-2的mRNA和蛋白质水平明显下调(图4-A、D和E);而Bax(图4-B、D和E)和Caspase3(图4-C、D和E)的mRNA和蛋白表达水平明显上调,见表1。

表1 TRIM28基因敲除对Bcl-2、Bax和caspase3表达水平影响的统计学结果
3 讨论
裸鼠是重要的肿瘤研究实验动物模型,可用于肿瘤分子机制,抗肿瘤药物的开发及药物敏感度等研究[12]。由于皮下移植瘤模型具有成瘤率高、易操作、肿瘤体积易测量等优点,因此成为最常用的造模方式[13]。本研究中,我们应用NSCLC A549细胞系建立了裸鼠皮下移植瘤模型,成瘤率高达100%。
通过组织学鉴定,移植瘤组织HE染色镜下观察发现大量增生的肿瘤细胞,提示裸鼠移植瘤模型符合肿瘤的特性。本研究能够成功建立裸鼠A549细胞移植瘤模型,我们认为是在造模的过程中注意了以下几个方面的因素:第一,本研究选取的是5~6周龄的裸鼠。这个周龄的小鼠既能够耐受肿瘤细胞,同时免疫系统功能又基本完全缺失,大大提高了成瘤率。第二,注射时的A549细胞要在对数生长期且存活率>90%,并且细胞悬液须在制备后1 h内完成注射。第三,我们使用的是4.5号的一次性注射器针头,既可防止细胞悬液外漏又保证了细胞在通过针头时不遭到挤压而被破坏。另外,我们还注意了裸鼠的饲养环境,以及及时更换垫料、笼具等因素。
TRIM28是多种肿瘤发生的重要调控因子。有学者发现TRIM28在乳腺癌中过表达,乳腺癌细胞系中TRIM28的缺失可减缓细胞增殖,抑制小鼠移植瘤的生长和转移[8]。Bojkowska等[14]证明,肝脏中特异性TRIM28基因敲除可导致显著的两性表型紊乱,并发展为男性特异性脂肪变性和继发性肝肿瘤。TRIM28基因在胃癌组织中的表达明显增高,在胃癌细胞株中敲除TRIM28后,癌细胞的增殖率和抗凋亡能力下降。本研究中,我们也发现TRIM28基因敲除,能够显著抑制NSCLC裸鼠肿瘤的生长。以上这些研究都说明,TRIM28能够促进各种肿瘤的发生和发展。因此,TRIM28基因的敲除有可能成为多种肿瘤治疗的靶点。另外,在研究中我们还发现,组织切片的HE染色显示TRIM28基因敲除组的血管生成减少,提示TRIM28可能在抗血管生成中发挥作用,这也可能是抑制肿瘤形成的一种机制。但其潜在的机制还需要我们通过进一步的研究来阐明。
研究中发现,TRIM28基因敲除能够显著诱导细胞发生凋亡(P<0.001)。此外,TRIM28基因敲除在基因和蛋白水平上都增加了Bax和Caspase3的表达,同时降低了Bcl-2的表达。有学者发现TRIM28与MDM2可相互作用,从而刺激p53-HDAC1复合物的形成。此外,TRIM28基因的敲除促进了p53的乙酰化和转录活性,增强了p53对DNA损伤的反应,增加了细胞凋亡[15]。还有学者发现,TRIM28在不依赖视网膜母细胞瘤蛋白的情况下,通过与E2F1转录因子结合的方式调节E2F1信号途径诱导细胞凋亡,我们前期研究也发现,TRIM28能够抑制E2F1活性[16]。有人还发现,与内源性STAT1相关的TRIM28抑制了干扰素介导的信号途径。小干扰RNA技术介导TRIM28表达下调后,可增强干扰素诱导的STAT1依赖性IRF-1基因表达。内源性TRIM28与体内内源性STAT3也相关,沉默TRIM28表达可增强白细胞介素-6诱导的STAT3依赖性转录和基因表达,并显著增加Ser727核上磷酸化的STAT3。上述这些研究都表明,TRIM28可能在许多凋亡信号通路中发挥作用,但其具体的作用机制仍不完全清楚。

注:荧光定量PCR法检测两组移植瘤组织中Bcl-2mRNA(A)、BaxmRNA(B)、Caspase3mRNA(C)的表达水平。D、E:Western-blot 法检测两组移植瘤组织中Bcl-2、Bax和Caspase3的蛋白表达水平。*与ControlsiRNA组比较P<0.05
本研究中,我们建立了NSCLC裸鼠皮下移植瘤模型,并利用该模型证明siRNA慢病毒载体沉默TRIM28的表达,可抑制NSCLC移植瘤的生长。但如果需要进一步探讨TRIM28的作用,特别是对转移的影响,就需要建立一个临床相关的肺癌原位模型。将人肺癌细胞株进行基因转化,表达荧光蛋白。首先建立裸鼠皮下移植瘤,取移植瘤并切碎,在裸鼠肺上进行外科原位移植。荧光成像检测肿瘤生长和转移。虽然,本研究只在裸鼠皮下进行了移植瘤实验,并初步证明了TRIM28在体内的功能,但也为进一步研究肺癌的发病机制,以及发现新的治疗靶点打下了基础。
