改良非石蜡切片法荧光标记三维凝胶培养系统中形成的输卵管内膜干细胞团*
2021-03-02林芸秀江明珠谢詹雄林淑萍叶浩峰魏玉珍杨信志
林芸秀 江明珠 闫 培 谢詹雄 林淑萍 叶浩峰 汤 璇 魏玉珍 杨信志△
(福建医科大学,1 基础医学院,2 临床医学院,福州 350122)
细胞的聚团培养首先被Reynold 和Weiss[1]用于分离干细胞,随后被应用于许多细胞的研究,如神经干细胞[1-2]、角膜干细胞[3-4]、肿瘤干细胞[5]等。所形成的细胞团细胞,无论是对其膜蛋白还是对其细胞核进行的免疫荧光染色来做定性的分析时,首先都需要对细胞团进行石蜡包埋切片[6]。这种石蜡切片技术要经过固定、脱水、浸蜡、包埋、切片、脱蜡等一系列复杂而耗时的程序,且这种较强烈的处理方法(有机试剂及较高的温度)还会对细胞中的抗原有着一定程度的损害。虽然Weiswald 等[7]用非切片法对肿瘤细胞团进行了荧光免疫标记,利用多聚甲醛和Triton X-100 混合物同时固定和渗透细胞团块,然后对所固定的细胞团块进行脱水、抗体标记、制片、激光共聚焦观察,但操作方法仍显复杂。本研究改良了非切片法对细胞团细胞的荧光定性检测方法,采用免疫荧光染色和非免疫荧光标记法标记三维凝胶培养系统中形成的输卵管内膜干细胞团的细胞,利用冰甲醇直接固定细胞团块样本,对细胞团进行标记后,直接置于玻璃底培养皿上观察,这种改良的方法省却了脱水和制片的过程,使操作更加简单、快速。
1 材料和方法
1.1 实验动物和主要试剂
选用清洁级健康6~8周龄美国癌症研究所选育的雌性小鼠30只,由福建医科大学实验动物中心提供。5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)试剂盒(Ribobio,广州);小鼠抗上皮特异性黏附分子(epithelial cell adhesion molecule,EpCAM)抗体(Servicebio,武汉);山羊抗小鼠IgG(Abcam,英国);水凝胶(Mebiol Gel,日本);PrEGM BulletKit(Lonza,美国)。
1.2 输卵管全细胞的准备
6~8周龄雌鼠断颈处死后取输卵管,去掉周围的脂肪组织及系膜,用眼科镊子撕碎,放入含有0.25 mg/mL 的胶原蛋白酶Ⅰ和Ⅱ的杜氏PBS(DPBS)中,37℃消化20 min,然后轻轻吹打使细胞分散,1 000 r/min 离心5 min加入5 mL 含10% FBS 的PrEGM 培养基悬浮细胞,然后通过直径为40 μm 的细胞过滤器过滤掉没有消化的组织团块,分散的细胞悬浮液离心(1 000 r/min,5 min)后用含10% FBS 的PrEGM 培养液稀释至细胞浓度为1×107/mL 的溶液备用。
1.3 水凝胶的准备
粉末水凝胶用商家建议的PrEGM 量稀释,4℃环境中缓慢地摇动过夜,然后在4℃下静置至少3 d备用。
1.4 细胞克隆团的培养和回收
取0.1 mL 上述备好的细胞悬浮液与0.9 mL 水凝胶溶液反复轻轻吹打混匀,然后取0.20~0.25 mL 的细胞-水凝胶混合溶液放入24 孔培养板中,37℃培养箱中静置5 min 使凝胶凝固。然后加入1 mL 含10%FBS 的PrEGM BulletKit 在5% CO2,37℃培养箱中培养6 d。
培养6 d,把24孔培养板放置到冰上静置5 min,使凝胶溶解。然后将凝胶溶液收集到15 mL的离心管中,1 000 r/min 离心3 min,用冷PBS 洗2次,每次1 000 r/min,3 min,收集细胞团备用。
1.5 EdU 插入培养
上述三维凝胶培养系统中形成的细胞克隆团培养至6 d,弃掉培养液,然后加入含10%FBS,50 μmol/L EdU 的PrEGM BulletKit 1 mL,继续培养6 h,使EdU 插入到合成的DNA 中,然后回收细胞团备用。
1.6 Apollo 染色检测EdU 标记的细胞核
EdU 插入培养的细胞团用-20℃甲醇固定过夜。室温环境中加入Apollo 反应液并轻轻摇晃6 h,使其与插入的EdU 反应均匀,然后用Hoechst33342染细胞核,避光保存待观察。
1.7 免疫荧光标记检测细胞团细胞的膜蛋白EpCAM
上述步骤(1.4)获得的细胞克隆团用-20℃的甲醇固定5 h,然后用含有0.2%Triton X-100 的冷PBS(PBST)洗2次,将细胞克隆团放入含10%山羊血清的PBST 中封闭孵育3 h,加入含anti-EpCAM 的PBST溶液(1∶200),4℃冰箱内过夜孵育。用含1%山羊血清的PBST 清洗2次,每次5 min,1 000 r/min 离心5 min。细胞团沉淀用含山羊抗小鼠IgG 二抗的PBST(1∶400)室温培养2 h,PI 复染细胞核后将样本避光保存。
1.8 激光共聚焦显微观察荧光标记情况
所有避光保存的样本运到激光共聚焦显微观察室,观察之前,将50μL 的样本悬浮液放入玻璃底培养皿中,置于共聚焦显微镜载物台上静置1~2 min,观察并拍照。
2 结果
2.1 克隆细胞团在三维凝胶培养系统中的形成
利用单个分散的输卵管全细胞在凝胶中培养6 d。培养第0天,可见单个细胞均匀分散在凝胶中(图1A,见封三);由于凝胶可以阻止细胞迁移,因此,凝胶培养系统可防止细胞聚集现象。培养至第3 天时,具有增殖能力的细胞在原位分裂增殖,并形成了由单个细胞增殖而来的较小的细胞克隆团(图1B,见封三),这些小细胞克隆团在继续培养到第6 天时逐渐长大,形成圆球形细胞克隆团块(图1C,见封三)以及培养6 d凝胶解聚回收的细胞团(图1D,见封三)。
2.2 非免疫荧光EdU 染色对细胞团S 期细胞的标记
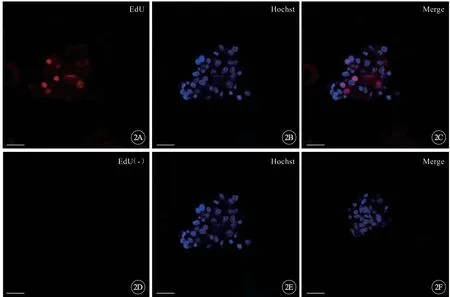
EdU 的标记结果显示细胞团中的很多细胞被标记成阳性(图2A~C,见封三),荧光分布在细胞核中,说明细胞团中的细胞有着明显的分裂增殖活动,表明EdU 可以通过非切片法被用来标记细胞团细胞的增殖情况(图2D~F,见封三)。
2.3 对细胞团细胞表面抗原的荧光标记
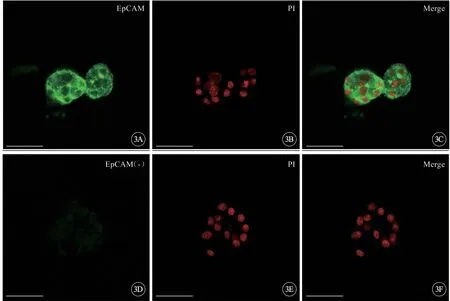
因为输卵管内膜干细胞明确表达EpCAM,因此以EpCAM 作为细胞团细胞的表面抗原,从而对其进行免疫荧光标记来验证非切片法荧光染色的适用情况。结果显示,凝胶培养形成的细胞团都有表达EpCAM,而且染色也比较均匀、强烈(图3A~C,见封三),阴性对照(图3D~F,见封三)为一抗空白组。说明非切片的免疫荧光染色方法可以用于定性鉴定细胞团细胞的膜蛋白的表达。

3 讨论
三维凝胶培养系统,越来越多地被用来培养和扩增细胞[8-10]。由于凝胶的特点,细胞在凝胶培养过程中不会发生迁移而聚集[11]。因此培养得到的细胞团是由单个细胞增殖而形成,并且这些细胞有着较强的分裂增殖能力。而输卵管内膜干细胞在三维凝胶培养系统中可以形成细胞团,这种强烈的增殖能力也被认为是干细胞的自我更新能力[5,12]。
对细胞团细胞的定性分析,传统的方法是切片法。虽然有研究用非切片技术对肿瘤细胞的细胞团进行免疫荧光观察,但其程序略显复杂,在对细胞团细胞进行固定后,还要对其进行逐步脱水,在对细胞团染色之后,要将样本吸附至玻片,吸掉多余的液体,再用90%的甘油重新悬浮,再置于载玻片和盖玻片之间由双面胶围成的间隙内,盖上盖玻片后用胶封片观察[7,13]。本实验用冰甲醇对细胞团细胞进行固定,不需要脱水的步骤,在对三维凝胶培养系统中所形成的干细胞团进行非免疫和免疫荧光染色,然后将样本悬浮液直接置于NEST 玻璃底细胞培养皿中进行观察,得到了良好的观察效果。
对形成细胞团的干细胞自我更新能力的鉴定,传统的方法是用BrdU 插入复制期的染色质中,然后用抗BrdU 的抗体来标记[6,14]。这种方法需要在处理的过程中对样本石蜡包埋、切片、脱蜡、DNA 变性等一系列复杂的处理。而EdU 是近10年来新出现的鉴定细胞增殖能力的技术,EdU 可以代替DNA 中的胸腺嘧啶(T),EdU 可以插入到复制DNA 链中,在Cu+催化下与荧光标记的小分子叠氮化合物探针反应,快速生成稳定的三唑环,并发出荧光。与BrdU 检测方法相比,EdU 检测方法更快速、更灵敏、更准确。EdU 与T 非常相似,而且EdU 染料只有BrdU 抗体的1/500,在细胞内很容易扩散,无需DNA 变性(酸解、热解、酶解等)处理,可有效避免样品损伤,而且无需抗原抗体反应,能在细胞和组织水平更快速便捷地反映DNA 复制活性[15-16]。因此,用EdU 标记干细胞,可以说明干细胞的自我更新能力。一般而言,细胞的EdU 标记都是对贴壁的单层细胞进行标记观察或细胞悬浮液标记后用流式细胞仪进行分析。本实验用EdU 对细胞团的细胞核进行标记,并且在细胞团内直接观察,并得到了良好的结果。本实验对细胞团的染色结果表明,细胞团内的部分细胞的细胞核为EdU 阳性,揭示细胞团的部分细胞具有自我更新的能力,因此本研究直接对细胞团的染色方法可以用来鉴定细胞的增殖能力。结果显示,并不是全部的细胞都呈EdU 阳性,说明细胞团内的细胞在标记期间并不是都处于DNA 复制期,或者有些干细胞在增殖的过程中也逐渐分化,从而失去了自我更新的能力。本研究利用改良的非切片方法第一次对细胞团块进行EdU 标记的结果进行了观察,结果表明这种染色方法对EdU 标记的观察是可行的。
本实验所使用的三维凝胶培养系统中形成的细胞克隆团,被证明是由单个输卵管内膜干细胞增殖而成[17]。这些细胞都明确表达输卵管内膜干细胞的一个膜蛋白标记物分子EpCAM。因此,选用非石蜡切片方法标记这些细胞团中细胞膜上的EpCAM,检测这种改良的非切片法是否适合膜蛋白的免疫荧光染色。
对细胞团的免疫荧光分析,传统的方法也是对细胞团进行脱水、石蜡包埋、切片、脱蜡等一系列较强的物理和化学的处理,这种处理方法会在一定程度上破坏细胞的原有结构,从而使染色结果在一定程度上失真。用非切片法可以对细胞团直接染色,避免了对细胞样本的强处理,使细胞结构以及组织结构在最大限度上得以保留,膜蛋白等抗原物质也受到了最大限度的保护,因此,这种方法的染色会最大限度反映活细胞的真实结构。另一方面,这种染色方法还可以用激光共聚焦显微镜来扫描细胞团各个层次的结构,从而更加全面地掌握细胞团细胞的分布情况及性质。利用改良的非切片方法对细胞膜蛋白EpCAM 进行免疫荧光标记,EpCAM 在这些细胞膜上都有强表达,并且可以观察到EpCAM均匀地分布在细胞膜上,说明这种改良的非石蜡包埋的免疫荧光染色方法可以被用来对细胞团细胞的膜蛋白进行免疫荧光分析。由于细胞团的细胞高度密集相互影响,普通荧光显微镜不能很好地观察细胞结构,而激光共聚焦显微镜却能很好地分辨出细胞团内的细胞结构[18]。
综上所述,通过对细胞团的细胞核化学反应法染色以及对细胞膜的非切片的免疫荧光染色法的检测,证明了改良后的非切片法可以利用激光共聚焦显微镜很好地用于对细胞团块细胞的定性分析。
图版说明(图见封三)
图1 输卵管细胞在三维凝胶培养系统中形成了细胞团,标尺=50 μm。分散的输卵管细胞在凝胶中培养第0、3 和6 天的情况(A~C)以及第6 天低温解聚凝胶后收集到的细胞团(D).
图2 EdU标记输卵管内膜干细胞团,标尺=25 μm。EdU 插入到细胞团中处于S 期的细胞核内(A~C)和无EdU 插入的阴性对照(D~F).
图3 非切片处理法对细胞团细胞进行免疫荧光染色,标尺=50 μm。用小鼠EpCAM 抗体对细胞团进行了免疫荧光染色,细胞团被均匀地染色并发出清晰的荧光(A~C),阴性对照(D~F)为一抗空白组.