沉默HMGA基因对非小细胞肺癌A549细胞增殖和转移的影响及机制
2021-03-02李斌武叶振悦杨思嘉
李斌武,叶振悦,杨思嘉
1.宁波市奉化区中医医院 呼吸科,浙江 宁波 315500;2.中国科学院大学宁波华美医院 呼吸科, 浙江 宁波 315010
非小细胞肺癌(non-small cell lung cancer, NSCLC)是最常见的肺癌类型,占肺癌的80%~85%[1-2]。化疗是肺癌主要的治疗方式,但化疗药物存在不良反应大、易复发、易产生耐药性等多方面的局限[3-4]。尽管以表皮生长因子受体酪氨酸激酶抑制剂为代表的各类靶点抑制剂在治疗晚期及复发性肺癌上效果优于传统的铂类化疗方案,但依旧存在耐药性、适应证窄等问题[5-7]。因此,寻找新的靶蛋白并阐明其在肺癌发生、发展中的分子机制,可以为肺癌早期诊断和优化治疗方案上提供思路。
高迁移族蛋白A(high-mobility group A,HMGA)蛋白家族是一类结构性转录因子,其通过改变染色体结构调节与DNA复制、转录、重组和修复等相关基因的表达[8-10]。HMGA蛋白分为HMGA1和HMGA2两种亚型,其中HMGA2蛋白的过度表达被证明与NSCLC的发生、发展及侵袭转移密切相关[11-13]。因此,研究HMGA蛋白如何调节NSCLC增殖和侵袭转移可以为NSCLC的治疗提供新的思路。基于此,我们通过沉默HMGA1和HMGA2基因在A549细胞内的表达,初步探究了HMGA1和HMGA2在NSCLC细胞增殖和侵袭转移过程中的作用及分子机制。
1 材料和方法
1.1 材料 人NSCLC细胞株A549购自中国科学院上海生命科学研究院细胞库。RPMI1640完全培养基、胰酶、Annexin V-FITC和碘化丙啶(propidium iodide,PI)凋亡检测试剂盒、MTT及BCA蛋白浓度测定试剂盒均购自南京凯基生物技术股份有限公司。siRNA-NC、siRNA-HMGA1、siRNA-HMGA2、Opti-MEM及lipofectamine2000 均购自上海爱丁堡生物技术有限公司。转录因子叉头框M1(Forkhead box M1,FOXM1)、c-Myc、E-Cadherin、N-Cadherin、Vimentin、β-actin一抗及鼠二抗、兔二抗均购自美国Cell Signaling Technology公司。实时定量PCR(realtime quantitative PCR,Q-PCR)试剂盒/SYBR Green Realtime PCR Master Mix、RIPA细胞裂解液及血清均购自上海碧云天生物技术公司。RNAiso Plus RNA提取试剂盒及FOXM1、c-Myc、ECadherin、N-Cadherin、Vimentin、β-actin引物均购于大连宝生物科技技术有限公司。
1.2 方法
1.2.1 细胞培养及基因沉默:A549细胞株置于含10%胎牛血清,100 mg/L链霉素,100 kU/L青霉素的RPMI1640培养基中培养。将处于对数生长期的A549细胞以2×105个/mL的浓度接种于6孔板培养过夜,待细胞长至70%左右进行转染。设置对照组(Control组)、阴性对照组(siRNA-NC组)、siRNAHMGA1组和siRNA-HMGA2组。其中Control组为A549细胞,siRNA-NC组为转染无序siRNA的A549细胞,siRNA-HMGA1和siRNA-HMGA2组分别为转染了siRNAHMGA1和siRNA-HMGA2的A549细胞。实验中通过 lipofectamine2000将相应siRNA转染至A549细胞中。
1.2.2 MTT实验测定细胞生长活力:将处于对数生长期的A549细胞以4×104个/mL接种于96孔板中培养过夜。之后分别将siRNA-NC、siRNA-HMGA1和siRNA-HMGA2用lipofectamine2000转染至各孔,每组设置6个复孔。待对应的siRNA转染6 h之后,更换为RPMI1640完全培养基继续培养24、48、72 h。之后,每孔加入20 μL 5 mg/mL MTT继续培养4 h显色。随后弃去培养液,每孔加入150 μL DMSO,震荡60 s之后,用酶标仪在570 nm波长处测定吸光度值。细胞增殖抑制率(%)=(1-实验组吸光度值/空白对照组吸光度值)×100%。
1.2.3 细胞凋亡实验:细胞凋亡由Annexin VFITC和PI凋亡双染检测试剂盒染色,通过流式细胞仪测定。将对数生长期的A549细胞以2×105个/mL接种在6孔板上。待培养细胞过夜之后,用siRNANC、siRNA-HMGA1和siRNA-HMGA2干扰细胞48 h,随后收集细胞。收集的细胞按照试剂盒说明书分别用Annexin V-FITC和PI染色,用流式细胞仪测定细胞凋亡情况。FlowJo 7.6软件用于统计分析细胞凋亡情况。
1.2.4 划痕实验:将对数生长期的A549细胞以5× 105个/mL接种在6孔板上,待细胞贴壁之后,在无血清的培养基中饥饿处理细胞12 h,之后用无菌枪头进行垂直划痕并用PBS洗去脱落的细胞。随后,用siRNA-NC、siRNA-HMGA1和siRNA-HMGA2干扰细胞48 h,观察细胞迁移情况。
1.2.5 Q-PCR测定mRNA:将对数生长期的A549细胞接种在6孔板上,待细胞生长至70%左右,将siRNANC、siRNA-HMGA1和siRNA-HMGA2转染至各孔并培养细胞48 h。收集各组细胞,用RNAiso Plus试剂盒提取细胞内总RNA,RNA的纯度和浓度均由微量核酸仪测定。Q-PCR完全按照说明书设置对应参数,并进行操作。反应条件:95 ℃预变性5 min,95 ℃ 10 s、60 ℃ 30 s、72 ℃ 15 s,循环40 次。各基因对应的引物由大连宝生物科技有限公司合成,引物序列见表1。

表1 相关基因及引物序列
1.2.6 Western blot实验:待siRNA-NC、siRNAHMGA1和siRNA-HMGA2转染至数生长期的A549细胞后,继续培养各组细胞48 h并收集细胞,用RIPA细胞裂解液裂解细胞并收集上清液,使用BCA蛋白定量试剂盒进行蛋白定量,调整各组蛋白浓度后进行上样。各组蛋白上样量均为25.0 μg,经SDSPAGE凝胶电泳分离后,目标蛋白通过湿法电转印到PVDF膜上。膜上的蛋白用5%(w/v)脱脂奶粉室温封闭1 h,之后用一抗4 ℃孵育过夜,二抗室温孵育 1.5 h。最后,PVDF膜上的蛋白用增强化学发光液显色,检测系统检测后,用Image J分析条带。
1.3 统计学处理方法 采用SPSS19.0统计软件对数据进行统计分析。计量资料以±s 表示,多组间比较采用单因素方差分析,组间两两比较采用 Bonferroni t检验。P<0.05为差异有统计学意义。
2 结果
2.1 沉默HMGA1和HMGA2基因可抑制A549细胞生长
MTT实验结果显示,当转染siRNA-HMGA1或siRNAHMGA2 24、48、72 h后,与siRNA-NC组比,siRNAHMGA1组和siRNA-HMGA2组A549细胞生长活力均显著降低,差异有统计学意义(P<0.05)。与siRNAHMGA1组比,siRNA-HMGA2组细胞的生长活力有所降低,差异有统计学意义(P<0.05)。见图1。
2.2 沉默HMGA1和HMGA2基因可诱导A549细胞凋亡
HMGA1和HMGA2基因沉默后,A549细胞凋亡情况由Annexin V-FITC和PI双染凋亡检测试剂盒测定。Q2处在Annexin V-FITC(+)/PI(+)象限,代表细胞处在 凋亡中晚期;Q3处在Annexin V-FITC(+)/PI(-)象限,代表细胞处在早期凋亡阶段。凋亡细胞数为处于Annexin V-FITC(+)/PI(+)象限和Annexin V-FITC(+)/ PI(-)象限的细胞总和[14]。与Control组相比,当A549细胞转染siRNA-NC 48 h后,细胞凋亡不显著,凋亡细胞百分含量分别为9.2%±2.1%(Control组)和11.7%±1.9%(siRNA-NC组)。而siRNA-HMGA1组和siRNA-HMGA2组的细胞凋亡率分别为24.1%±3.1%、31.9%±3.8%。siRNA-HMGA1组和siRNA-HMGA2组的细胞凋亡率高于siRNA-NC组,且siRNA-HMGA2组高于siRNA-HMGA1组,差异均有统计学意义(P<0.05)。见图2。
2.3 沉默HMGA1和HMGA2基因诱导A549细胞凋亡的机制 待A549细胞转染siRNA-HMGA1和siRNA-HMGA2之后培养48 h,Q-PCR检测结果显示,siRNA-HMGA1组和siRNA-HMGA2组A549细胞FOXM1和c-Myc mRNA的表达量低于siRNA-NC组,差异有统计学意义(P<0.05)。与siRNA-HMGA1组相比,siRNA-HMGA2组中c-Myc mRNA的表达量降低,差异有统计学意义(P<0.05)。见图3。
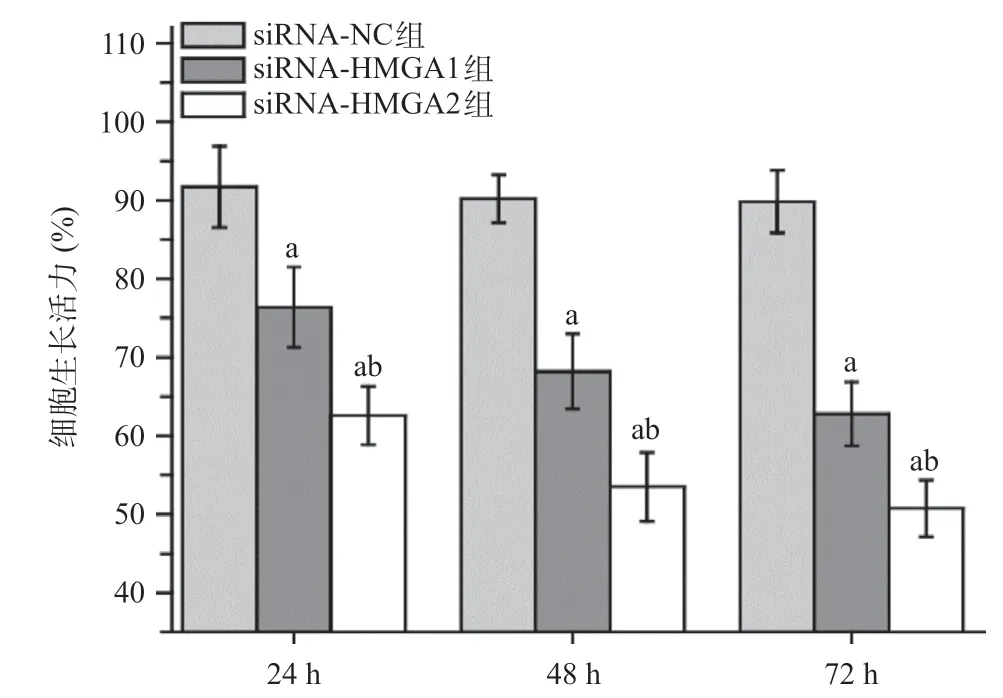
图1 HMGA1和HMGA2基因沉默对A549细胞生长活力的影响
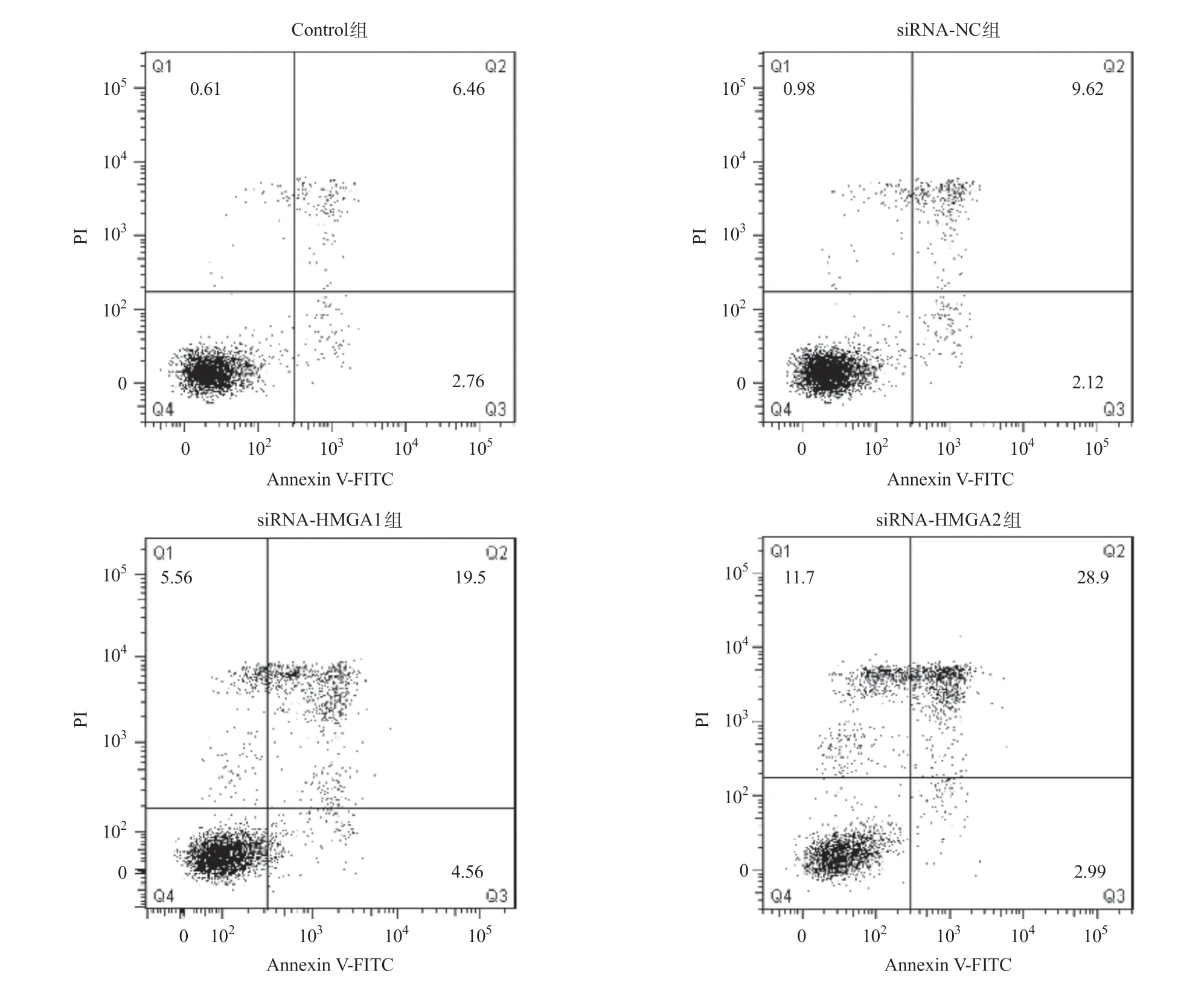
图2 HMGA1和HMGA2基因沉默对A549细胞凋亡的影响
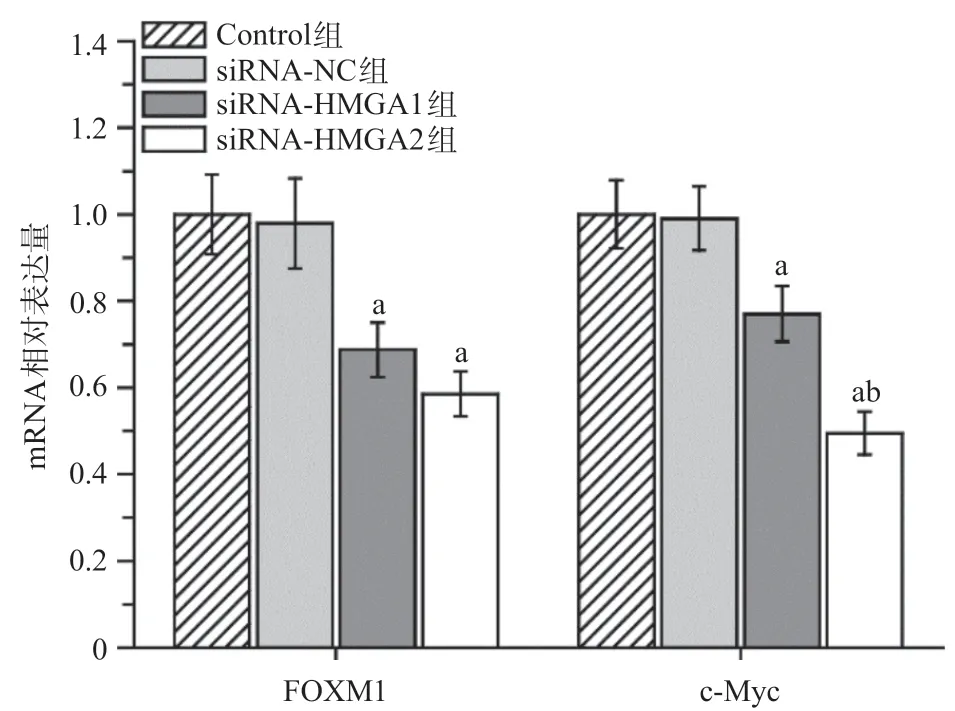
图3 Q-PCR分析沉默HMGA1和HMGA2基因对A549细胞FOXM1和c-Myc mRNA的调节作用
Western blot测定结果显示,Control组和siRNA-NC组细胞FOXM1和c-Myc的蛋白表达量差异无统计学意义(P>0.05)。siRNA-HMGA1组和siRNAHMGA2组FOXM1和c-Myc蛋白表达量显著低于siRNANC组,差异有统计学意义(P <0.05),且siRNAHMGA2组c-Myc的蛋白表达量低于siRNA-HMGA1组,差异有统计学意义(P<0.05)。见图4。
2.4 沉默HMGA1和HMGA2基因对A549细胞迁移的影响 A549细胞具有较高的迁移能力,在无血清培养基培养48 h之后,可导致划痕显著愈合。siRNA-NC转染至A549细胞内后并不能显著抑制细胞的迁移能力。当A549细胞HMGA1基因沉默之后,细胞迁移能力依旧不能被显著抑制。但是,当沉默HMGA2基因在A549细胞内的表达后,细胞的迁移能力被显著抑制(见图5)。
2.5 沉默HMGA2基因抑制A549细胞转移的机制
Q-PCR实验结果显示,siRNA-HMGA2沉默其在A549细胞内的表达48 h之后,与siRNA-NC组比,siRNAHMGA2组E-Cadherin的mRNA表达量显著增加,NCadherin和Vimentin的mRNA表达量显著降低,差异有统计学意义(P<0.05),见图6。
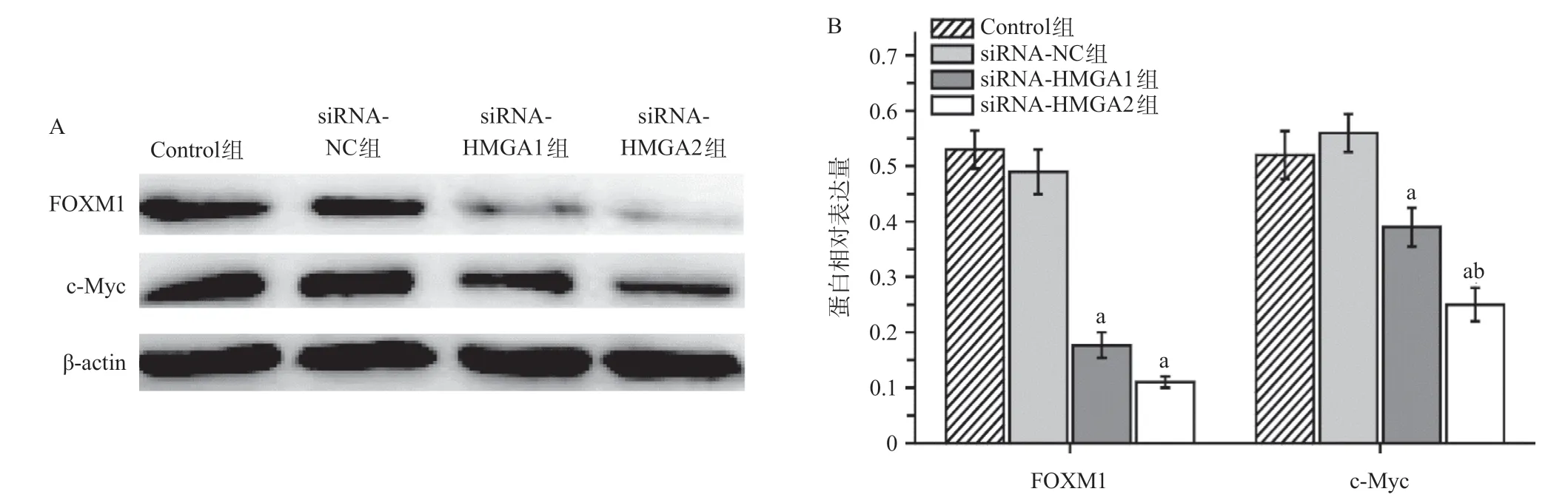
图4 沉默HMGA1和HMGA2基因对A549细胞FOXM1和c-Myc蛋白水平的调节作用
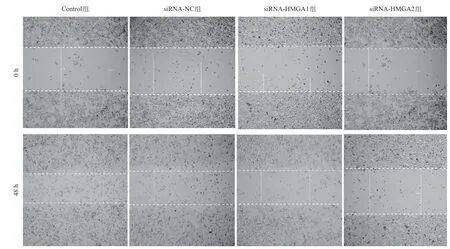
图5 划痕实验测定HMGA1和HMGA2基因沉默对A549细胞迁移能力的影响(×4)
Western blot实验结果显示,Control组和siRNA-NC组E-Cadherin、N-Cadherin和Vimentin的蛋白表达量差异无统计学意义(P>0.05)。但是,当HMGA2基因沉默之后,与siRNA-NC组比,siRNAHMGA2组E-Cadherin的蛋白表达量显著增加,NCadherin和Vimentin的蛋白表达量显著降低,差异有统计学意义(P<0.05),见图7。
3 讨论
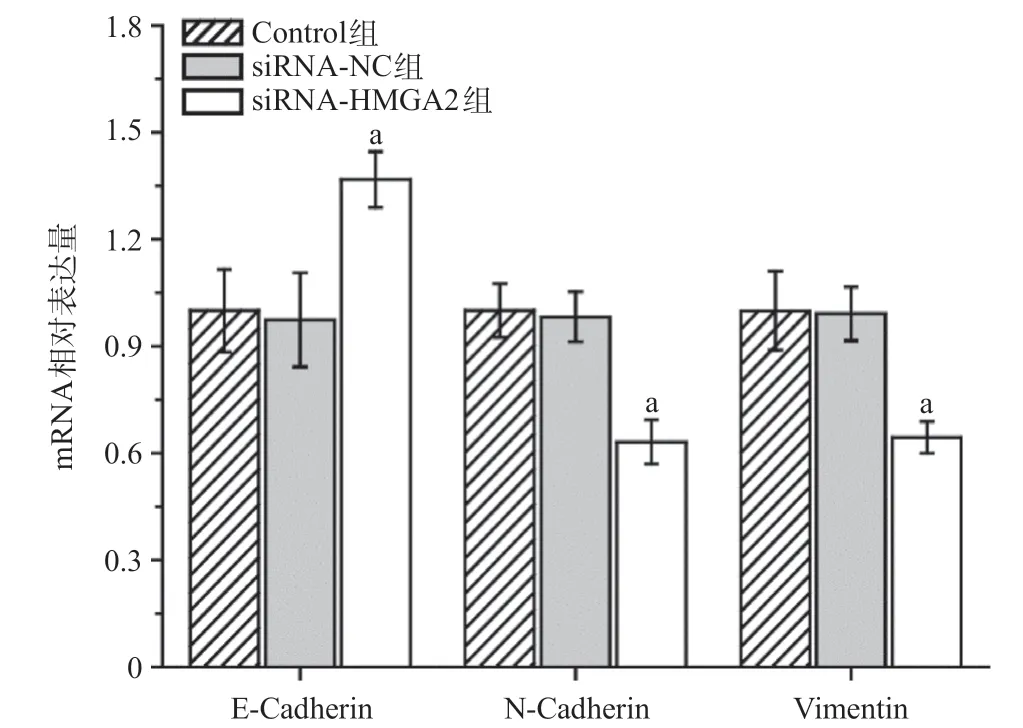
图6 Q-PCR分析HMGA2基因沉默对A549细胞内E-Cadherin、N-Cadherin和Vimentin mRNA的调节作用
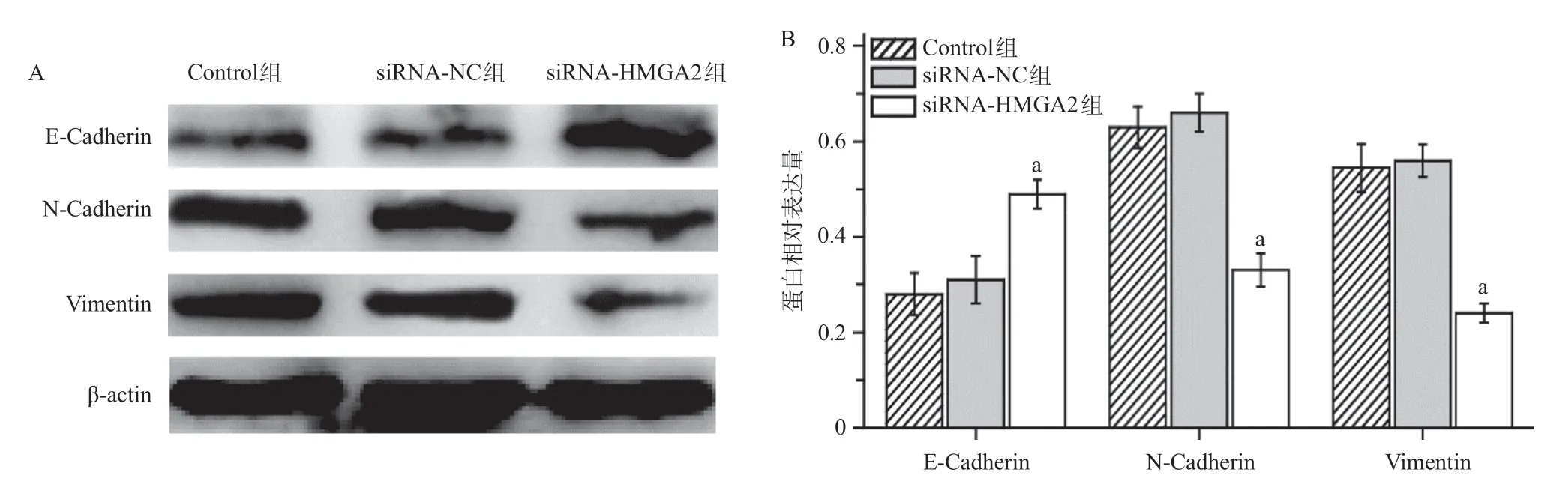
图7 HMGA2基因沉默对A549细胞内E-Cadherin、N-Cadherin和Vimentin蛋白水平的调节作用
NSCLC是最常见的肺癌类型,也是病死率非常高的肺癌类型。由于缺乏早期诊断靶标,大多数患者确诊的时候都已经处于晚期,导致其治疗难度增加[1-2],不论是传统的铂类药物化疗方案还是现有的小分子抑制剂,都存在患者容易产生耐药性、易复发等多种局限[4-7]。因此,寻找新的与NSCLC发生、发展密切相关的靶标,并研究其在NSCLC内发挥生物功能的分子机制,可为NSCLC的早期诊断和临床治疗提供新的思路和理论依据。非组蛋白染色体蛋白HMGA1和HMGA2被证明在大多数NSCLC细胞内存在异常表达[11-13]。HMGA1和HMGA2的异常表达被证明参与调控DNA复制、转录等多种通路促进NSCLC的恶性增殖和侵袭转移[12-13]。本研究通过siRNA特异性干扰HMGA1和HMGA2的表达,观察并分析HMGA1和HMGA2基因沉默对NSCLC细胞株A549细胞增殖和转移的影响及相应的分子机制。
本研究发现,不论是沉默HMGA1基因的表达还是沉默HMGA2基因的表达,A549细胞的生长均受到抑制。同时发现,HMGA1或者HMGA2基因的沉默均可导致A549细胞显著凋亡。与HMGA1基因沉默组相比,HMGA2基因的沉默更容易导致A549细胞凋亡。有研究表明,HMGA2的表达与NSCLC的恶性程度密切相关,NSCLC细胞恶性增殖能力越强,其表达量越高[12]。HMGA1和HMGA2通过促进DNA损伤修复及上调促癌基因如c-Myc等的表达维持癌细胞恶性增殖[10,15]。转录因子FOXM1被证明与HMGA1共同参与调控DNA损伤修复[16-17]。因此,我们通过Q-PCR和Western blot从mRNA和蛋白水平分析了HMGA1和HMGA2基因沉默后FOXM1和c-Myc的表达情况。结果发现,HMGA1和 HMGA2基因的沉默均可以显著下调FOXM1和c-Myc的表达。与HMGA1基因沉默组相比,HMGA2基因的沉默可显著下调c-Myc的表达,但FOXM1在两组中的表达没有显著性差异。划痕实验结果显示,HMGA1基因的沉默并不能显著抑制A549细胞的迁移能力,但是HMGA2基因沉默后,A549细胞侵袭转移能力显著降低。上皮间质转化(epithelial interstitial transformation,EMT)是肿瘤转移的关键环节[18]。当肿瘤细胞侵袭转移能力增强时,常表现为上皮标志蛋白E-Cadherin表达的减少和间质标志蛋白N-Cadherin、Vimentin表达的增多[18]。为了探究HMGA2基因沉默影响A549细胞转移能力的机制,我们用Q-PCR和Western blot评价了HMGA2沉默后,E-Cadherin、N-Cadherin和Vimentin蛋白在mRNA和蛋白水平的表达情况,结果显示,HMGA2基因的沉默,会导致N-Cadherin和Vimentin表达的下调,ECadherin表达的上调。
综上所述,沉默HMGA1和HMGA2基因的表达可显著抑制NSCLC细胞株A549的恶性增殖,并通过下调FOXM1和c-Myc的表达诱导A549细胞凋亡。同时,沉默HMGA2基因的表达可显著下调间质标志蛋白 N-Cadherin和Vimentin的表达,上调上皮标志蛋白E-Cadherin的表达来抑制A549细胞的转移。HMGA 蛋白在NSCLC发生、发展及侵袭转移上的促进作用表明,HMGA蛋白可能可作为NSCLC诊断和治疗的靶标。
