混合型小肝癌的MR强化特征及其病理基础
2021-03-02徐晓飞李炳荣毛卫波肖扬锐王祖飞
徐晓飞,李炳荣,毛卫波,肖扬锐,王祖飞
1.浙江省影像诊断及介入微创重点实验室,丽水市中心医院 放射科,浙江 丽水 323000;2.丽水市中心医院 病理科,浙江 丽水 323000
混合型肝癌(combined hepatocellular- cholangiocarcinoma,CHC)为原发性肝癌的少见类型,发病率与病毒性肝炎高度相关;WHO于2010年对其进行了定义更新及亚组分型[1];手术仍是本病目前公认的治疗标准。早发现和治疗是改善CHC预后的重要途径[2]。基础肝病的存在将促使患者进行更为积极的定期检查,CHC的早期检出率势必有所提升。CHC的影像表现与病灶大小相关,当病灶较小时CHC与肝细胞肝癌(hepatocellular carcinoma, HCC)间的误诊更加频繁并可能导致患者在没有取得病理的情况下接受射频、栓塞等非标准治疗[3]。穿刺对诊断CHC的准确率不高[4],病灶较小时则更低,因 此如何进一步提升混合型小肝癌(small combined hepatocellular-cholangiocarcinoma,sCHC)影像诊断准确率需要进行更多的研究总结。目前针对sCHC的MR强化特征的报道较少,本研究分析长径≤3.0 cm的sCHC MR强化特征并与病理对照,旨在提高对本病的诊断水平。
1 资料和方法
1.1 一般资料 回顾性分析2011年4月至2019年7月期间丽水市中心医院经病理证实的sCHC患者首诊资料。纳入标准:①经手术病理证实;②进行过肝脏MRI增强扫描;③病灶长径≤3.0 cm。排除标准:图像质量不佳,不能用于分析。24例患者纳入研究,男18例,女6例,年龄(49.9±9.2)岁。实验室结果:AFP升高17例,数值均大于90 ng/mL;CAl9-9升高1例,数值722 U/mL;CEA升高1例,数值53 ng/mL。
1.2 检查方法 采用德国Siemens Area 1.5 T或Siemens Symphony 1.5 T超导MR成像仪进行扫描。扫描参数:①T2WI:TR 3 300~3 391 ms,TE 90~97 ms,FOV 38 cm×38 cm,矩阵320×320,层厚 6 mm,层间距1 mm;②双回波T1WI:TR 120.0 ms, TE 2.4、4.8 ms,FOV 38 cm×38 cm,矩阵256× 256,层厚6 mm,层间距1 mm;③DWI:b=800 mm2/s, TR 3 800~5 800 ms,TE 61~70 ms,FOV 38 cm× 38 cm,矩阵128×128,层厚6 mm,层间距1 mm;④增强扫描:采用横轴面屏气三维容积内插法,TR 4.1 ms,TE 1.8 ms,TR 120 ms,TE 10 ms,重建层厚5 mm,层间距1 mm,FOV 38 cm×38 cm,矩阵320×320,对比剂采用Gd-DTPA,剂量0.1 mmol/kg,注射流率2 mL/s。采集25 s动脉期、60 s门脉期、190 s平衡期时像图。
1.3 影像分析 由2名具有10年以上工作经验的副高级职称影像诊断医师共同阅片达成一致意见;评估病灶的一般情况、平扫(包括DWI)信号表现、增强扫描强化表现及周围组织结构伴随征象。
1.4 病理检查 病例均为整体取材,HE及免疫组化染色,由2名具有15年以上工作经验的正、副高级职称病理诊断医师依据WHO 2010版CHC诊断标准进行阅片达成一致意见,观察成活肿瘤细胞、纤维及坏死,并评估2种肿瘤细胞的分布类型和优势瘤细胞类型,评估者不知晓病灶的影像表现。1.5 统计学处理方法 采用SPSS22.0统计软件进行数据分析。计量资料以±s 表示,Fisher检验比较不同优势瘤细胞类型病灶间强化表现的差异。 P<0.05为差异有统计学意义。
2 结果
2.1 病灶平扫表现 24例患者共24个≤3.0 cm的sCHC病灶,长径(2.0±0.5)cm,右肝17个、左肝7个。在T1WI上呈较均匀低信号23个、不均匀低信号1个,在T2WI上呈较均匀高信号11个、不均匀高信号13个,在DWI上呈较均匀高信号9个、不均匀高信号15个。所有病灶形态均较为规则,边界均较清晰;均未见明显脂肪变性及出血信号。
2.2 病灶强化表现及其对应病理 病灶强化表现共5型,具体影像及相应病理情况见表1。
2.3 周围组织结构伴随征象 1个病灶周围见动脉期瘤周异常灌注强化;2个病灶见延迟强化假包膜征;1个病灶见肝门淋巴结增大;所有病例均未见胆管扩张。
2.4 不同优势瘤细胞对应MR强化类型的对比结果 24例sCHC病灶中肝内胆管细胞癌(intrahepatic
cholangiocarcinoma,ICC)优势12例,HCC优势8例,2种瘤细胞含量接近4例。不同优势瘤细胞类型病灶间强化方式的差异无统计学意义(P=0.664)。

表1 病灶强化表现及其对应病理
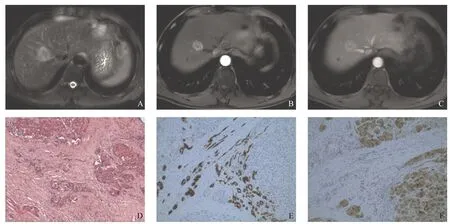
图1 49岁男性右肝sCHC患者MRI及病理图片

图2 49岁男性右肝sCHC患者MRI及病理图
3 讨论
3.1 国内外研究现状及本研究意义 CHC临床特点近似于ICC亦或是HCC目前存在不同观点[2,5];有报道认为富动脉血供的CHC患者较乏血供者预后更好[6],这与我们前期关于肝内肿块型胆管癌(intrahepatic mass cholangiocarcinoma,IMCC)的研究结果相似[7],因此笔者认为CHC的临床特点与IMCC更为接近。优势瘤细胞类型与影像表现是否相关亦存在争议[4,8],本研究表明当病灶≤3.0 cm时不同瘤细胞优势类型的sCHC均常为持续稳定强化的富血供病变,两者无明显相关性。本研究另显示sCHC患者常有肝病基础及AFP的异常,此与多数报道[9]相符;但出现淋巴结增大、CAl9-9升高的患者比率极低与之不同,提示两者的异常出现率与病灶大小相关,当病灶较小时,AFP和CA19-9同时升高的辅助诊断价值可能有限。
3.2 sCHC的MRI特征、病理基础及相关鉴别 病理上sCHC主要由肝细胞癌、胆管细胞癌、纤维间质和凝固性坏死构成。本研究结果显示当CHC≤3.0 cm时病灶内肿瘤细胞的含量丰富、纤维间质及凝固性坏死组织较少,MR上sCHC常表现为动脉期强化程度较高、强化面积较大的富血供病变,填充强化或延迟强化表现少见。本研究病理显示sCHC中两种瘤细胞以弥漫混杂分布更为多见,呈移行分布的病例较少,但笔者认为后者的MR强化表现更具特征。以往报道所述CHC的特殊征象为“同心圆分布反转强化”[4],但该征象在IMCC中也存在,并非CHC特 异[10]。本研究中呈“反转强化”的病例为2种瘤细胞碰撞式分布并可在平扫和增强扫描中表现出“结中结”征,笔者认为这可能与HCC与ICC瘤细胞密集区的含水量及血供差异有关,ICC密集区纤维间质含量相对丰富因而平扫T1WI信号相对高,而HCC主要接受动脉供血,因此增强后期廓清更快。
瘤细胞呈弥漫混杂分布的sCHC当病灶中央有一定含量的凝固性坏死时增强即表现为厚环状强化,若无明显坏死则为全瘤明显强化;这些强化表现与sHCC、sIMCC甚至肝局灶性结节增生、硬化性血管瘤的强化模式类似[11]。由于同样常具肝病背景及HCC的高发病率,sCHC被误判为sHCC的概率仍是相对最高[3];笔者认为对比剂廓清的速度对两者鉴别具有一定的价值,多数sHCC在增强后期对比剂廓清较快[12],而本研究表明sCHC多为持续强化。另 外,本研究中仅2个病灶见“延迟强化假包膜”征,提示“假包膜征”出现概率低也是sCHC与sHCC的鉴别线索,与之前研究[13]相符。sCHC与sIMCC鉴别困难,尤其是在肝硬化背景下,后者同样频繁地呈现动脉期明显强化伴后期持续强化[14]。
本研究的局限性在于病例数偏少且没有对sCHC进行经典型和干细胞型的进一步分型,但据报道两者MR表现无明显差异[15]。
综上所述,sCHC患者多具有基础肝病及AFP升高,然而淋巴转移少见且大多患者CA19-9正常。“反转强化”是瘤细胞移行分布sCHC的典型MR特征;瘤细胞混杂分布sCHC病灶常表现为动脉期整体或厚环状显著强化伴持续稳定强化,但少见“假包膜”征。
