载喜树碱普朗尼克/TPGS混合胶束的制备与质量评价
2021-03-02魏培
魏培
(山东畜牧兽医职业学院食品与药品科技系,山东 潍坊 261061)
喜树碱(camptothecin,CPT)是从我国特有珙桐科旱莲属落叶植物喜树中提取的一种生物碱[1],具有显著的抗肿瘤活性和较宽的抗癌谱。CPT为拓扑异构酶Ⅰ特异性抑制剂,通过抑制DNA超螺旋结构松弛过程中的再连接步骤,导致单链和双链DNA断裂触发细胞死亡[2-3]。由于CPT类药物难溶于水,常将其内酯环打开形成钠盐制备成静脉注射剂而应用于临床,但体内代谢很快,半衰期很短,临床上常需延长给药时间或延长疗程,但剂量限制性毒性骨髓抑制和消化道毒性也随之增加。此外,CPT的α-羟基内酯环是其作用于靶酶的必要结构,但其存在形式依赖于体系的酸碱性[4],pH<5.0时,CPT几乎全部以活性强的内酯形式存在,而pH>7.5时,则主要以活性弱的开环羧酸盐形式存在。所以在生理条件下(pH 7.0或以上),内酯环迅速水解,平衡后80%以上的药物以无活性的羧酸盐形式存在。CPT代谢快、组织分布不理想以及内酯环不稳定性均阻碍其充分发挥抗肿瘤作用,限制了临床应用。
为提高CPT疗效,同时降低毒副作用,国内外学者先后进行了剂型改革。目前,已经报道的CPT剂型有纳米粒、脂质体、脂肪乳、自微乳和聚合物胶束等。由双亲嵌段共聚物在水溶液中自组装的胶束载体系统(聚合物胶束)近年来受到了广泛关注[5-7],成为CPT类衍生物抗癌药物新剂型的研究热点,可解决药物溶解度差、半衰期短及内酯基团不稳定等问题。
聚合物胶束已在药物释放、基因载体和诊断制剂等很多方面得到了广泛的应用研究。与其他药物载体相比,聚合物胶束有其独特的优势:结构稳定,具有耐稀释性;药物释放缓慢,易于实现体内靶向性;胶束的粒径非常小(纳米级),对于存在渗漏的脉管区域(肿瘤部位)具有更强的渗透与滞留能力,从而增强药物在靶组织中的聚集,提高药效;还可以通过在胶束表面连接适当的配体使胶束具有靶向性;药物可被胶束很好地与体内生物环境隔离开来,降低了不良反应的发生概率;此外,聚合物胶束制备工艺较为简单,可实现大规模生产,市场前景广阔。
本研究选用普朗尼克105(P105)和水溶性维生素E聚乙二醇琥珀酸酯(TPGS)制备CPT聚合物胶束。普朗尼克作为胶束材料已有较多研究[8-9],而TPGS是近年新发展起来的胶束材料[10-11]。有文献显示维生素E琥珀酸酯(如TPGS)亦可以作为选择性癌细胞前凋亡剂[12-13]。此外,TPGS中的苯环还可与CPT中的芳香核结构紧密结合,由于其亲脂部分相对较大,故具有更大的增溶作用。TPGS亲水段PEG链具有很高的柔顺性,且构象易变,可在胶束表面形成柔顺性好的水合性外壳,掩蔽内核免受单核吞噬细胞系统的识别,增加内核的稳定性。因此,制备普朗尼克105/TPGS混合胶束有望提高CPT的水溶性及稳定性。
1 材料与仪器
1.1 试剂及药品 普朗尼克P105(P105)购自Sigma-Aldrich(St.Louis,MO,USA);水溶性维生素E聚乙二醇琥珀酸酯(TPGS)购自Eastman Co.(USA);CPT(CPT)购自Sigma-Aldrich(St.Louis,MO,USA);氯仿(莱阳经济技术开发区精细化工厂,批号:20161025);乙腈(天津市博迪化工有限公司,批号:20171110);冰乙酸(济南试剂总厂,批号:20160430);苯甲酸钠(天津市天河化学试剂有限公司,批号:20150519);氯化钠(北京化工厂,批号:20160810);氯化钾(上海精化科技研究所,批号:20170103);磷酸氢二钠(天津市巴斯夫化工有限公司,批号:20161101);磷酸二氢钾(天津市巴斯夫化工有限公司,批号:20150823)。以上试剂均为分析纯。
1.2 试验仪器 RE 52-98旋转蒸发仪(上海亚荣生化仪器厂);LGJ 0.5冷冻干燥机(北京四环科学仪器厂);XW-80A旋涡混合器(上海精科实业有限公司);F98荧光分光光度计(上海精密仪器仪表公司);ETS-D4型定时恒温磁力搅拌器(上海雷磁仪器厂);ER-182A型电子天平(日本A&D有限公司);JEM-100CXⅡ透射电镜(日本电子公司);BI-200SM动态激光散射仪(美国布鲁克海文仪器公司);AS3120超声波清洗器(天津奥特赛恩斯仪器有限公司);pHS-25型数显pH计(上海雷磁仪器厂)。
2 方法
2.1 药物的含量测定及方法学考察
2.1.1 荧光标准曲线建立 精密称取CPT对照品10 mg于10 mL容量瓶中,加入适量三氯甲烷使溶解,醋酸调节pH约为2,定容至刻度,4 ℃保存,作为储备液Ⅰ。精密吸取一定量的储备液Ⅰ配成1 μg·mL-1的储备液Ⅱ。分别精密量取后者0.5、1.0、1.5、2.0、2.5、3.0 mL于10 mL容量瓶中,乙腈定容到刻度,得系列标准溶液。在激发波长360 nm,发射波长430 nm[4,14]测定荧光强度,以荧光强度对相应浓度进行线性回归,得标准曲线方程为:F=-0.010 6+0.738C,相关系数r=0.999 6。表明在0.05~0.30 μg·mL-1浓度范围内CPT的荧光强度与其浓度线性关系良好。
2.1.2 精密度试验 精密称取CPT对照品1.6 mg,配制成10 mL的乙腈溶液,醋酸调节pH约为2。精密吸取0.5 mL,配制成0.8 μg·mL-1的CPT溶液。分别精密量取后者0.8、1.6、3.2 mL于10 mL容量瓶中,乙腈定容到刻度,得系列标准溶液。在激发波长360 nm,发射波长430 nm处测定荧光强度。一天内测定5次,计算日内精密度;每天测定1次,连续测定5天,计算日间精密度,结果见表1。
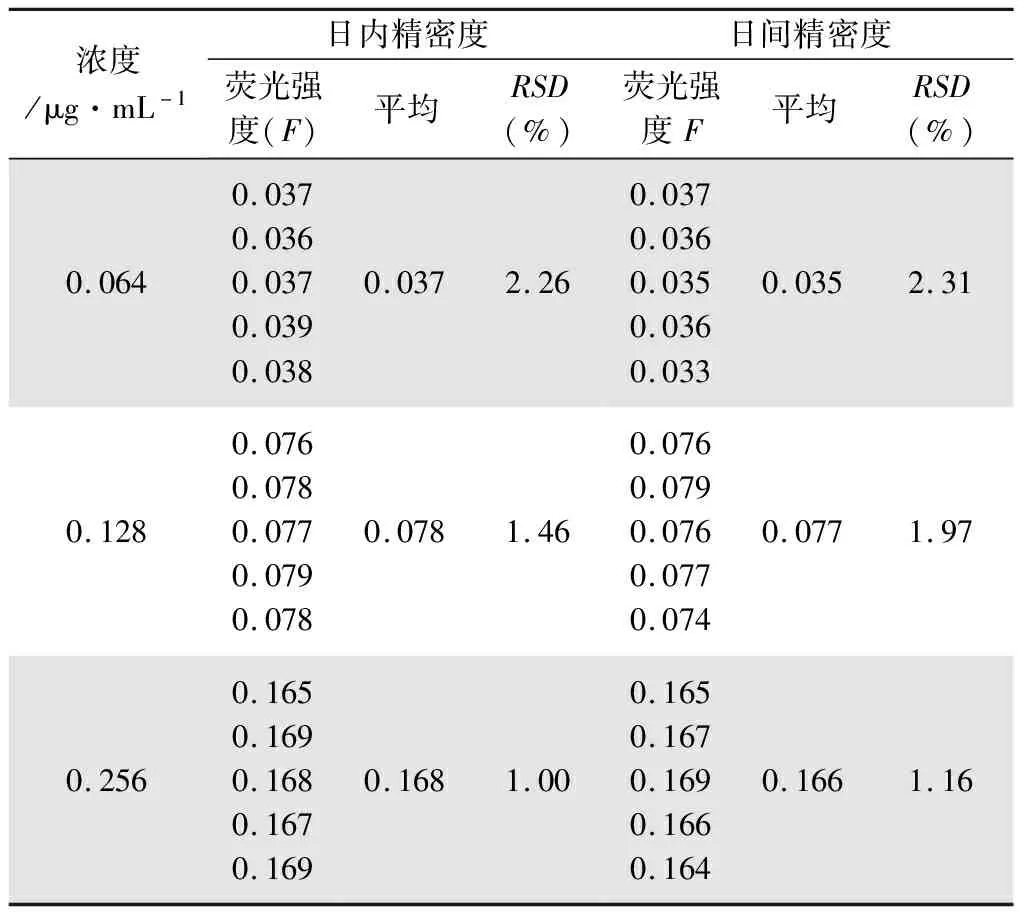
表1 精密度试验结果(n=5)
2.1.3 回收率试验 分别精密量取上述0.8 μg·mL-1CPT溶液1.0、1.5、2.0 mL各3份于10 mL容量瓶中,然后,分别加入等量10 mmol·L-1空白胶束溶液,乙腈定容至刻度,得低、中、高系列溶液。在激发波长360 nm,发射波长430 nm处测定荧光强度,计算回收率,结果见表2。
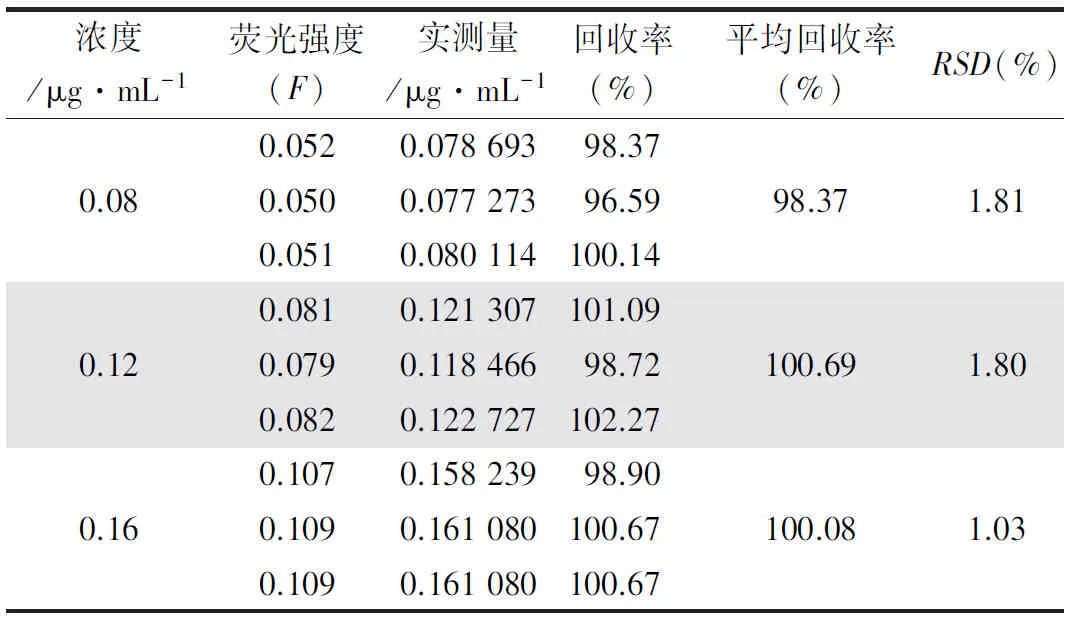
表2 回收率试验结果
2.2 CPT混合胶束的制备 本试验采用薄膜形成法制备胶束。按照普朗尼克105与TPGS的不同摩尔比设计4个处方制备空白混合胶束。操作如下:称取处方量(浓度为10 mmol·L-1)的载体材料于25 mL圆底烧瓶中,加入3 mL三氯甲烷,旋涡使其完全溶解,40 ℃、100 r·min-1旋转蒸发45 min,将有机溶剂蒸干,真空干燥5 h去除残留溶剂,得均匀干燥薄膜。加入2 mL 5 mmol·L-1磷酸盐缓冲溶液(pH 7.4)溶解,于室温下700 r·min-1搅拌14 h,0.22 μm微孔滤膜滤过,即得透明胶束溶液。
载药胶束的制备同空白胶束。材料溶解后加入1 mg·mL-1的CPT储备液Ⅰ1 mL,旋涡混合5 min,静置30 min,使材料与药物充分混合均匀,旋转蒸发除去有机溶剂,如上所述制得载CPT的聚合物胶束溶液。
2.3 胶束的形态学考察 以2%的磷钨酸(pH=4.47)负染色,滴在铜网上,制备胶束样品,于透射电镜下观察胶束形态。
2.4 胶束粒径的测定 采用动态激光散射仪测定胶束的粒径及其分布。
2.5 胶束载药量测定 精密量取0.1 mL载药胶束溶液,稀释100倍,使胶束破坏释放出药物,荧光分光光度计测定其荧光强度。根据“2.1.1”项下荧光标准曲线计算药物浓度,并按照下式计算聚合物胶束的载药量:载药量=胶束中测得药物量/载药胶束质量×100%。
2.6 载药胶束体外释放试验[15-16]
2.6.1 释放介质的选择 由于CPT在水中的溶解度很低,以有限的水或者pH 7.4磷酸盐缓冲溶液做释放介质均不能满足释放要求,故需选择合适的助溶剂以增加CPT的溶解度,形成漏槽状态。本试验选择助溶剂苯甲酸钠进行混合胶束体外释放试验。
考察CPT在苯甲酸钠的溶解度,进行方法学验证,方法如下:取0.2 mg CPT,加入至2 mL 1 mmol·L-1的苯甲酸钠中,超声使其溶解。若溶液浑浊,则继续追加1 mL苯甲酸钠溶液,直至溶液澄清。结果显示,CPT在1 mmol·L-1的苯甲酸钠的溶解度至少为0.025 g·L-1,并且有淡蓝色荧光。本释放试验设计中完全释放后介质中药物浓度约为1.0 μg·mL-1,故采用苯甲酸钠作为介质可以保证药物释放在漏槽状态中进行。
2.6.2 1 mmol·L-1苯甲酸钠中荧光标准曲线的建立 分别精密量取储备液Ⅱ0.5、1.0、1.5、2.0、2.5 mL于10 mL容量瓶中,1 mmol·L-1苯甲酸钠定容到刻度,得系列标准溶液。按“2.1.1”项下方法测定荧光强度,建立释放介质中药物的荧光标准曲线。标准曲线方程为:F=-0.004 4+0.704C,相关系数r=0.999 2。表明在0.05~0.25 μg·mL-1浓度范围内荧光强度与浓度线性关系良好。
2.6.3 CPT在释放介质中的稳定性 精密量取1 mg·mL-1的CPT储备液Ⅰ1 mL,加入至装有20 mL释放介质(1 mmol·L-1苯甲酸钠溶液)的锥形瓶中,置于(37±0.5)℃恒温条件中,分别于0、0.5、1、2、6、8、12、24、48、72 h取样。采用上述荧光分光光度法测定释放介质中的药物含量,以0 h作为100%含量,考察CPT相对含量随时间的变化趋势。
2.6.4 透析袋的前处理 将透析袋剪成5~8 cm的小段,将其放入大体积的2%(W/V)碳酸氢钠和1 mmol·L-1EDTA(pH 8.0)溶液中煮沸10 min,用蒸馏水彻底清洗透析袋后,放入1 mmol·L-1EDTA(pH 8.0)中煮沸10 min。冷却后,存放于4 ℃,必须确保透析袋始终浸没在溶液内,用前在透析袋内装满蒸馏水后排出,清洗干净后方可使用。
2.6.5 载药胶束的释放试验 释放介质中药物浓度必须低于10%的饱和浓度才能维持释放要求的漏槽状态。1 mol·L-1的苯甲酸钠完全能够满足此要求。取P105/TPGS(摩尔比3∶7)载药胶束溶液2 mL加至截留分子量为8 000~12 000 Da经预处理后的透析袋内,平行3份,扎紧袋口,放入装有20 mL释放介质(1 mol·L-1苯甲酸钠溶液)的锥形瓶中,然后置于(37±0.5)℃恒温条件中,100 r·min-1磁力搅拌下进行释放试验。分别于0.5、1、2、6、8、12、24、48、72 h取样,每次取出2 mL释放介质,并同时加入同体积的37 ℃新鲜释放介质。采用荧光分光光度法测定释放介质中的药物含量,计算累计释放百分率(%),绘制释放曲线。
3 结果
3.1 CPT胶束的形态 普朗尼克P105纯品胶束的电镜照片见图1。在电镜下,普朗尼克105聚合物胶束呈米粒状均匀分布,排列整齐。聚合物胶束的疏水段部分不被磷钨酸染色,呈现亮白色的内核,背景的磷钨酸溶液干燥后,电子束不能透过,故呈现黑色。该图清晰地显示出胶束的球型核-壳结构,且大小较均匀。

图1 P105纯品胶束的电镜照片
P105/TPGS(摩尔比3∶7)混合材料形成的棒状胶束见图2。在形成球状胶束的两亲嵌段共聚物中如果疏水段含量增加,核链的伸展就会变得相对容易,熵减较大,球形胶束则不能处于热力学稳定状态,聚集体便会慢慢过渡到棒状以增加稳定性。本处方的棒状胶束宽度约为15 nm,与动态激光散射仪测定的流体学粒径基本一致。
图2 P105/TPGS(摩尔比3∶7)胶束的电镜照片
3.2 CPT胶束的流体学粒径 为比较不同P105与TPGS处方胶束的差异,4份样品均同样稀释至0.5 mmol·L-1进行粒径测定。动态激光散射仪图谱(见图3)上仅形成一个峰,表明胶束已经形成并且粒径大小上比较接近。但是不同处方的胶束所占的质量分数并不相同,这又表明胶束在稀释至0.5 mmol·L-1时已经开始出现分解现象。其中,P105/TPGS(摩尔比为3∶7)混合胶束处方分解最少,这意味着此处方的胶束具有最好的耐稀释稳定性。这是由于亲水链段长度不变的条件下,随着疏水链段长度增加,亲水链段对疏水链段的疏水性影响降低,疏水链段间的相互作用增强,形成胶束所需的聚合物浓度随之降低,即临界胶束浓度减小[17],胶束耐稀释稳定性提高。由图还可知,混合胶束大小均匀,粒径分布范围在4~9 nm,并且随着TPGS用量的增加,聚合物胶束的粒径分布更加趋于集中。

A.P105胶束;B.P105/TPGS混合胶束(摩尔比为7∶3);C.P105/TPGS混合胶束(摩尔比为5∶5);D.P105/TPGS混合胶束(摩尔比为3∶7)
3.3 CPT胶束的载药量 为了增加聚合物胶束的载药量,我们在胶束处方中加入TPGS。结果表明,增加胶束材料中TPGS的用量可以提高对药物的增溶作用。P105/TPGS(摩尔比3∶7)聚合物胶束的载药量为0.0323%±0.0011%W/W,而单纯应用普朗尼克P105制备的胶束载药量仅为0.0254%±0.0008%W/W,具体结果见表3。P105/TPGS混合胶束比纯P105胶束的载药量提高可能是因为加入TPGS后形成了松散但结实的疏水性内核,由于TPGS中的芳香核能够增加聚合物和药物的疏水性相互作用,使药物紧密结合于胶束内核中。在材料浓度为10 mmol·L-1前提下,CPT胶束溶液每毫升装载药物量达15 μg,大大提高了CPT原料药的溶解度和胶束的载药量。

表3 不同处方胶束的载药量
3.4 CPT胶束的体外释放 CPT在释放介质中的稳定性试验结果显示,CPT在1 mol·L-1苯甲酸钠溶液释放介质中0、0.5、1、2、6、8、12、24、48、72 h的相对含量分别为100.0%、100.0%、100.0%、99.9%、99.8%、99.8%、99.7%、99.5%、99.2%、99.0%,相对含量基本保持不变,具有较高的稳定性。
最佳处方混合胶束(P105和TPGS摩尔比3∶7)的体外释放曲线见图4。分别以零级动力学方程、一级动力学方程、Higuchi方程、Ritger-Peppas、Weibull方程和双相动力学方程对胶束体外释药数据进行处理,得到回归方程见表4。

表4 载CPT胶束的不同释药模型拟合方程
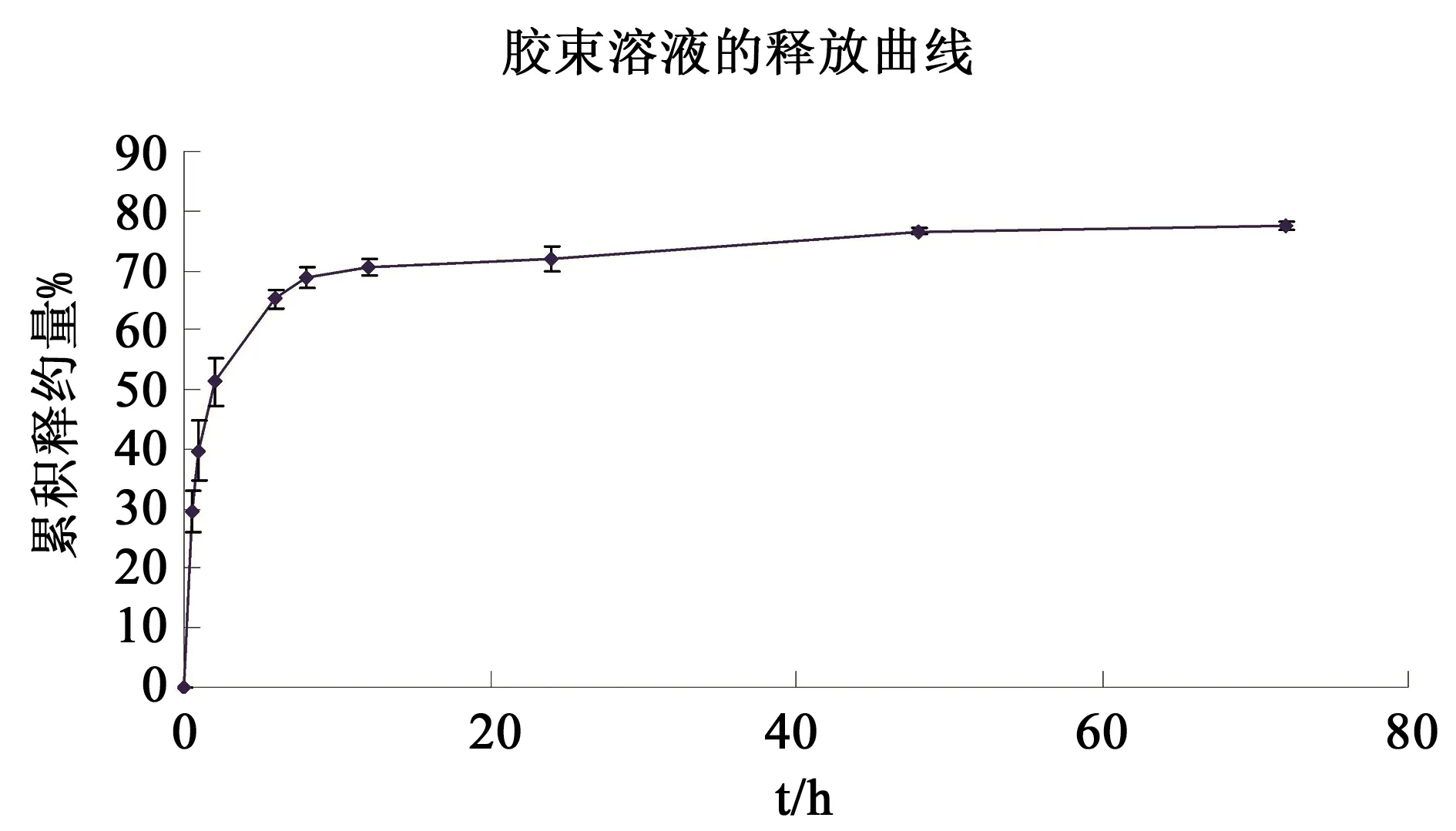
图4 CPT 胶束(P105和TPGS摩尔比3∶7)在37 ℃时的体外释放曲线
体外释药试验表明所制备的载药纳米胶束释药符合纳米胶束释药模型,由两相组成,分别为突释相和缓释相。在1 mol·L-1苯甲酸钠溶液中,突释发生在1 h,约有50%药物释放,随后进入缓释期,48 h仍有约25%药物被包裹。释放曲线拟合结果表明,此胶束释放符合双向动力学特征,其拟合方程为100-R=90.71e-0.3389 t+33.08e-0.0006 t(rα=0.950 6,rβ=0.941 1)。这种释放模型可以反映CPT的包裹稳定性,并能初步解释药物在胶束中的包裹部位。最初发生的突释是由少量包裹于亲水“冠”或亲水“冠”与疏水核界面的药物引起的,它们通过药物的水合作用以及被动扩散释放出来。疏水内核的药物包裹比较紧密,在漏槽状态下呈现缓慢释放,在37 ℃ 72 h时,仍有约20%的药物紧密包裹于其中。
4 讨论
混合胶束是一种新型运载难溶性药物的缓控释给药系统,能更好地稳定药物结构,提高药物溶解度,降低机体系统毒性。普朗尼克105与TPGS是常用的载体材料,在水中可形成自组装系统,分子链发生定向排列,排斥疏水端相互靠近缔合于内,亲水嵌段在外面向介质,自组装形成纳米级大小的胶束产物。通过普朗尼克105和TPGS两种两亲性高分子聚合物制备CPT混合胶束,显示对疏水性药物CPT具有较好的装载和控释能力。通过增加胶束材料中TPGS的用量,调节疏水段的比例,可以提高对CPT的增溶作用,增加胶束的耐稀释稳定性,控制药物的释放速率。普朗尼克105和TPGS纳米胶束有望成为一种有应用前景的抗癌药物新型载体。
