西藏扁芒菊的抗补体活性成分研究
2021-03-02赵志治高慧琴德吉卢燕
赵志治,高慧琴,德吉,卢燕
(1.复旦大学药学院,上海 201203;2.山西医科大学药学院,山西 太原 030001;3.西藏大学理学院,西藏自治区 拉萨 850000)
西藏扁芒菊[Waldheimiaglabra(Decne.)Rgl.]是菊科(Compositae)扁芒菊属(Waldheimia)的代表性植物,生长在海拔4 900~5 200 m的沙壤土中[1],在印度、巴基斯坦、尼泊尔、阿富汗与中国均有分布。西藏扁芒菊的藏语名为“刚布”,其花与叶的浸泡液有良好的驱虫效果,全草晒干可用于缓解瘙痒、头痛、关节痛、发热等症状[2-3]。Giorgi等[2]通过顶空固相微萃取-气相色谱法从西藏扁芒菊中识别到70余种挥发性物质,包括5个醇类化合物、2个烃类化合物、8个酮类化合物、7个游离脂肪酸、6个酯类化合物、39个萜类化合物与5个醛类化合物。De等[4]从西藏扁芒菊挥发油中分离出27个化合物,并发现挥发油有良好的抗炎、抗病毒活性。西藏扁芒菊总多糖能够显著增强巨噬细胞 NO分泌功能,具有免疫增强活性[5]。
课题组前期研究表明,清热类中草药解热抗炎药效与其抑制补体系统过度激活有关,鱼腥草、火炭母、黄芩等清热中药普遍含有黄酮、木脂素、多糖等多类抗补体活性物质[6-8],但西藏扁芒菊的挥发油和总多糖均无抗补体活性[4-5],预实验显示西藏扁芒菊中仅醇提物组分有显著的抗补体活性。考虑到西藏扁芒菊清热药效物质研究相对不足,本研究采用课题组前期的中药抗补体活性测定方法[9],从西藏扁芒菊95%乙醇提取物中活性导向分离得到10个抗补体活性成分,包括5个酚酸、3个黄酮、1个倍半萜和1个酪醇,并对化合物的构效关系进行了分析讨论,为该药材的进一步开发利用与质量控制奠定基础。
1 仪器与材料
Autopol V plus型旋光仪(美国Rudolph公司);APEXIII 7.0 TESLA FTMS型质谱仪(德国Bruker公司);DRX 400型核磁共振仪(德国Bruker公司);Agilent 1260(DAD检测器);Eclipse XDB-C-18 column(5 μm,9.4×250 mm);Agilent 1200(DAD检测器);所用试剂均为分析纯。
西藏扁芒菊药材采收于2014年8月,经复旦大学药学院卢燕副教授鉴定为菊科扁芒菊属西藏扁芒菊[Waldheimiaglabra(Decne.)Rgl.]全草,标本存放于复旦大学药学院生药教研室。
2 方法
2.1 提取与分离 西藏扁芒菊干燥药材1.285 kg中加入95%乙醇(1∶20料液比),闪式提取3次,向滤渣中再次加入95%乙醇(1∶10料液比)超声提取30 min,合并滤液减压浓缩得到醇提物浸膏181.70 g。浸膏加2 L水混悬,以石油醚、二氯甲烷、乙酸乙酯、正丁醇分别萃取 5 次,分别合并浓缩得到4个部位的浸膏30.19 g(石油醚)、20.15 g(二氯甲烷)、7.72 g(乙酸乙酯)、10.50 g(正丁醇)。
对西藏扁芒菊的醇提物以及石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取物共5个部分的抗补体活性进行测定,结果与阳性肝素比较,乙酸乙酯部分有明显的抗补体活性,血清总补体活性(CH50)值达到(140.8±2.1)μg·mL-1,正丁醇部分活性较弱,而二氯甲烷与石油醚部分则没有抗补体活性。因而选择乙酸乙酯部分进行进一步的物质分离与纯化。
乙酸乙酯萃取部位浸膏以二氯甲烷、二氯甲烷-甲醇(50∶1~1∶1)作为洗脱剂进行梯度洗脱,依次得到Fr.1~Fr.7 7个组分,Fr.1(380 mg)以凝胶柱(二氯甲烷-甲醇1∶1)洗脱,得到化合物2(7 mg)、4(5 mg)、8(7 mg);Fr.2(280 mg)以二氯甲烷-甲醇(30∶1)作为洗脱剂经硅胶柱层析得到化合物1(5 mg)、3(6 mg);Fr.4(774 mg)以二氯甲烷-甲醇(30∶1)作为洗脱剂经硅胶柱层后得到化合物5(4 mg)和馏分Fr.4-2,Fr.4-2以凝胶柱(二氯甲烷-甲醇1∶1)洗脱得到化合物6(7 mg)、9(5 mg)、10(4 mg);Fr.5(1 803 mg)以凝胶柱(二氯甲烷-甲醇1∶1)洗脱得到馏分 Fr.5-1和Fr.5-2,Fr.5-2经过制备液相(甲醇-水作为流动相)制得化合物7(5 mg)。
2.2 补体经典途径的溶血活性测定
2.2.1 配制巴比妥缓冲液(BBS),含有0.5 mol·L-1Mg2+和0.15 mol·L-1Ca2+;将配制的巴比妥缓冲液稀释,制成1∶1 000的溶液待用。
2.2.2 测定补体的效价 取一定量豚鼠血清配成1∶10溶液,并倍比稀释成1∶20、1∶40、1∶80、1∶160浓度。取溶血素、各浓度补体以及2%绵羊红细胞(SRBC)各0.1 mL溶于0.3 mL BBS中,混匀后37 ℃水浴30 min,离心后取上清液在405 nm处测定吸光度值。以三蒸水溶血管的吸光度值作为全溶血标准,选择达到相似吸光度值的最低补体浓度作为正常溶血所需的临界补体溶度。
2.2.3 测定样品的经典途径抗补体活性 取临界浓度的补体分别与倍比稀释后不同浓度的供试品混匀,加入适量的BBS、溶血素和2% SRBC。37 ℃水浴30 min,离心后取上清液在405 nm处测定吸光度值。同时制备全溶血组、不溶血组、供试品对照组(不加入补体、溶血素和2% SRBC),将测定组的吸光度值扣除相应供试品对照组的吸光度值后,计算各组的溶血抑制率。以供试品溶液浓度为X轴,溶血抑制率为Y轴作图,计算CH50值。
3 结果
3.1 结构鉴定 化合物1:C26H26O12,淡黄色粉末;[α]25 D-149.0°(c=0.50,MeOH),1H-NMR(400 MHz,CD3OD)δ:7.64,7.53(2H,d,J=16.04 Hz,H-7′,7″),7.06(2H,brs,H-2′,2″),6.95(2H,dt,J=7.5 Hz,H-5′,5″),6.80(2H,m,H-6′,6″),6.33,6.20(2H,d,J=15.6 Hz,H-8′,8″),5.38(1H,m,H-5),5.30(1H,m,H-3),3.97(1H,m,H-4),3.68(3H,s,7-OCH3),2.31(2H,m,H-2ex,6ex),2.15(2H,m,H-2ax,6ax);13C-NMR(100 MHz,CD3OD),δ:175.6(C-7),168.7,168.0(C-9′,9″),149.7,149.5(C-4′,4″),147.4,147.1(C-7′,7″),146.9,146.8(C-3′,3″),127.9,127.6(C-1′,1″),123.1,123.0(C-6′,6″),116.6,116.5(C-5′,5″),115.4,114.9(C-8′,8″),115.1,115.1(C-2′,2″),74.6(C-1),72.2(C-5),71.9(C-3),69.7(C-4),53.0(7-OCH3),36.7(C-6),35.6(C-2)。以上数据与文献[10]基本一致,故鉴定化合物1为3,5-二咖啡酰奎宁酸甲酯。
化合物2:C8H10O2,白色针晶;1H-NMR(400 MHz,CD3OD).δ:7.01(2H,d,J=8.4 Hz,H-4,8),6.68(2H,d,J=8.4 Hz,H-5,7),3.66(2H,t,J=7.0 Hz,H-1),2.70(2H,t,J=7.0 Hz,H-2;13C-NMR(100 MHz,CD3OD)δ:156.8(C-6),130.1(C-3,4,8),116.1(C-5,7),64.6(C-1),39.4(C-2)。其波谱数据与文献[11]一致,故鉴定化合物2为酪醇。
化合物3:C26H26O12,淡黄色粉末;[α]25 D-297.1°(c=0.50,MeOH),1H-NMR(400 MHz,CD3OD)δ:7.60,7.50(2H,d,J=16.1 Hz,H-7′,7″),7.05,7.03(2H,brs,H-2′,2″),6.92(2H,m,H-5′,5″),6.75(2H,brs,H-6′,6″),6.32,6.18(2H,d,J=16.0 Hz,H-8′,8″),5.53(1H,m,H-3),5.11(1H,m,H-4),4.34(1H,m,H-5),3.72(3H,s,7-OCH3),2.34(1H,m,H-6ax),2.26(1H,m,H-2ex),2.26(1H,m,H-2ax),2.80(1H,dd,J=13.8,6.0 Hz,H-6ex);13C-NMR(100 MHz,CD3OD)δ:175.2(C-7),168.5,167.9(C-9′,9″),149.8,149.7(C-4′,4″),147.7,147.7(C-7′,7″),146.8,146.8(C-3′,3″),127.7,127.5(C-1′,1″),123.1,123.1(C-6′,6″),116.5,116.5(C-5′,5″),115.2,115.2(C-2′,2″),114.7,114.6(C-8′,8″),75.8(C-1),74.9(C-4),69.1(C-3),68.6(C-5),53.1(7-OCH3),38.6(C-2),38.4(C-6)。以上数据与文献[12-13]基本一致,故鉴定化合物3为3,4-二咖啡酰奎宁酸甲酯。
化合物4:C17H20O9,淡黄色粉末;[α]25 D-50.2°(c=0.50,water),1H-NMR(400 MHz,CD3OD)δ:7.51(1H,d,J=15.9 Hz,H-7′),7.04(1H,d,J=2.0 Hz,H-2′),6.95(1H,dd,J=8.2,2.0 Hz,H-6′),6.78(1H,d,J=8.4 Hz,H-5′),6.22(1H,d,J=15.9 Hz,H-8′),5.26-5.30(1H,m,H-3),4.12-4.15(1H,m,H-5),3.71(1H,dd,J=7.2 Hz,2.8 Hz,H-4),3.69(3H,s,-OCH3),1.93-2.23(4H,m,H-2,H-6);13C-NMR(100 MHz,CD3OD)δ:175.4(COO-),168.3(C-9′),149.7(C-3′),147.2(C-4′),146.9(C-7′),127.6(C-6′),123.0(C-1′),116.5(C-5′),115.1(C-2′,C-8′),75.8(C-4),72.5(C-1),72.1(C-3),70.3(C-5),53.0(-OCH3),38.1(C-6),37.7(C-2)。以上数据与文献[14]基本一致,故鉴定化合物4为绿原酸甲酯。
化合物5:C15H10O6,淡黄色粉末;1H-NMR(400 MHz,DMSO-d6)δ:12.98(1H,s,5-OH),7.43(1H,d,J=2.1 Hz,H-2′),7.41(1H,dd,J=8.7,2.7 Hz,H-6′),6.90(1H,d,J=8.0 Hz,H-5′),6.67(1H,s,H-3),6.44(1H,d,J=2.0 Hz,H-8),6.19(1H,d,J=2.0 Hz,H-6);13C-NMR(100 MHz,DMSO-d6)δ:182.2(C-4),164.6(C-2),164.5(C-7),162.0(C-9),157.8(C-5),150.2(C-4′),146.2(C-3′),122.0(C-1′),119.5(C-6′),116.2(C-5′),113.8(C-2′),104.1(C-10),103.3(C-3),99.3(C-6),94.3(C-8)。以上数据与文献[15-16]基本一致,故鉴定化合物5为木犀草素。
化合物6:C9H8O4,淡黄色无定形粉末;1H-NMR(400 MHz,CD3OD)δ:7.53(1H,d,J=16.0 Hz,H-7),7.03(1H,d,J=2.0 Hz,H-2),6.94(1H,dd,J=8.0,2.0 Hz,H-6),6.78(1H,d,J=8.0 Hz,H-5),6.22(1H,d,J=16.0 Hz,H-8);13C-NMR(100 MHz,CD3OD)δ:171.2(C-9),149.7(C-4),147.2(C-7),147.0(C-3),128.0(C-1),123.0(C-6),116.7(C-8),115.7(C-2),115.3(C-5)。以上数据与文献[17]一致,故鉴定化合物6为咖啡酸。
化合物7:C21H30O8,无色油状物;[α]25 D-297.1°(c=0.20,MeOH),1H-NMR(400 MHz,CD3OD)δ:6.38(1H,s,H-13ax),5.84(1H,s,H-13ax),5.57(1H,d,J=8.0 Hz,H-1′),3.84(1H,dd,J=12.2,1.5 Hz,H-6′ax),3.68(1H,dd,J=12.2,4.7 Hz,H-6′ex),3.42(1H,m,H-3′),3.41(1H,m,H-5),3.40(1H,m,H-2′),3.38(1H,m,H-4′),2.93(1H,m,H-6ex),2.57(1H,m,H-2ex),2.56(1H,m,H-7),2.33(1H,dt,J=16.7,3.9 Hz,H-2ax),2.15(1H,m,H-6ax),1.81(1H,m,H-8ax),1.81(1H,m,H-1),1.75(1H,m,H-8ex),1.75(1H,s,H-15),1.74(1H,m,H-9ex),1.51(1H,m,H-9ax),1.26(1H,s,H-14);13C-NMR(100 MHz,CD3OD)δ:201.5(C-3),166.8(C-12),164.5(C-5),145.3(C-11),129.9(C-4),125.9(C-13),96.1(C-1′),78.9(C-3′),78.1(C-5′),74.0(C-2′),71.0(C-4′),62.3(C-6′),42.9(C-9),41.5(C-7),38.4(C-1),37.0(C-10),34.6(C-6),34.5(C-2),28.2(C-8),22.7(C-14),11.0(C-15)。以上的数据与文献[18]数据一致,故鉴定化合物7为β-D-glucopyranosyloxyl pteodonote。
化合物8:C15H10O7,黄色粉末;1H-NMR(400 MHz,CD3OD)δ:7.71(1H,d,J=2.0 Hz,H-2′),7.61(1H,dd,J=8.0,2.0 Hz,H-6′),6.86(1H,d,J=8.4 Hz,H-5′),6.36(1H,d,J=2.0 Hz,H-8),6.15(1H,d,J=2.0 Hz,H-6);13C-NMR(100 MHz,CD3OD)δ:177.3(C-4),165.6(C-7),162.5(C-5),158.2(C-9),148.8(C-2),148.0(C-4′),146.2.0(C-3′),137.2(C-3),124.1(C-1′),121.7(C-6′),116.2(C-5′),116.0(C-2′),104.5(C-10),99.2(C-6),94.4(C-8)。以上数据与文献[19]一致,故鉴定化合物8为槲皮素。
化合物9:C18H21O10,黄绿色油状物;[α]25 D +100.7°(c=0.50,MeOH),1H-NMR(400 MHz,CD3OD)δ:7.64(1H,d,J=16.0 Hz,H-3″),7.57(1H,d,J=16.0 Hz,H-3′),7.14(1H,d,J=2.0 Hz,H-5″),7.07(1H,d,J=2.0 Hz,H-5′),6.97(1H,dd,J=8.0,2.0 Hz,H-9′),6.95(1H,dd,J=8.0,2.0 Hz,H-9″),6.77(1H,d,J=2.0 Hz,H-8″),6.72(1H,d,J=8.0,H-8′),6.43(1H,d,J=16.0,H-2′),6.34(1H,d,J=16.0 Hz,H-2″),5.44(1H,m,H-3),5.33(1H,dd,J=12.0,8.0 Hz,H-9ax),4.65(1H,dd,J=12.0,8.0 Hz,H-9ex),4.59(1H,m,H-1),4.54(1H,m,H-7),4.23(1H,dd,J=5.0,5.4 Hz,H-2),3.79(3H,s,-OCH3),2.41(1H,dd,J=15.5,5.5 Hz,H-4ax),2.27(1H,dd,J=16.0,1.2 Hz,H-4ex);13C-NMR(100 MHz,CD3OD)δ:169.4(C-10),169.2(C-1″),168.7(C-1′),149.6(C-7′,1″),147.4,147.2(C-3′,3″),146.9,146.8(C-6′,6″),127.9,127.8(C-4′,4″),123.4,123.1(C-9″,9′),116.6,116.5(C-8″,8′),115.6,115.2(C-5′,5″),115.2,114.9(C-2′,2″),104.6(C-5),81.1(C-7),78.4(C-1),67.9(C-3),67.8(C-3),64.2(C-9),53.4(-Me)。以上数据与文献[20-21]基本一致,故鉴定化合物9为methyl rel-(1S,2R,3R,5S,7R)-7-[(E)-caffeoyloxymethyl]-3-[(E)-caffeoyloxy]-2-hydroxy-6,8-dioxabicyclo[3.2.1]octane-5-carboxylate。
化合物10:C30H26O14,黄绿色油状物;1H-NMR(400 MHz,CD3OD)δ:6.49(1H,s,H-3),6.50(1H,d,J=2.0 Hz,H-6),6.70(1H,d,J=2.0 Hz,H-8),6.68(1H,d,J=2.0 Hz,H-2′),6.85(1H,d,J=8.0 Hz,H-5′),7.32(1H,m,H-6′),5.08(1H,d,J=8.0 Hz,H-1′),3.53(2H,m,H-2″,3″),3.41(1H,m,H-4″),3.83(1H,m,H-5″),4.28(1H,dd,J=12.0,5.0 Hz,H-6a″),4.63(1H,dd,J=12.0,2.5 Hz,H-6b″),6.82(1H,d,J=2.0 Hz,H-2‴),6.59(1H,d,J=8.0 Hz,H-5‴),6.85(1H,d,J=8.0 Hz,H-6‴),6.22(1H,d,J=16.0 Hz,H-α),7.45(1H,d,J=16.0 Hz,H-β);13C-NMR(100 MHz,CD3OD)δ:183.4.4(C-4),169.1(C=O),166.7(C-2),164.5(C-7),162.9(C-5),158.8(C-9),151.0(C-4′),149.5(C-4‴),147.4(C-3‴),146.9(C-3′),146.6(C-β),127.3,123.4(C-1‴,1′),122.6,120.5(C-6‴,6′),116.7,116.4(C-5‴,5′),115.4(C-2‴),114.6(C-α),114.2(C-2′),107.1,104.1(C-10,3),99.8(C-6,1″),95.9(C-8),77.8,75.6(C-3″,5″),74.6,72.1(C-2″,4″),64.7(C-6″)。以上数据与文献[22-23]基本一致,故鉴定化合物10为木犀草素-7-(6″-咖啡酰氧基)-β-D-葡萄糖。
本实验从西藏扁芒菊95%乙醇提取物中共分得10个化合物,包括3,5-二咖啡酰奎宁酸甲酯(1)、酪醇(2)、3,4-二咖啡酰奎宁酸甲酯(3)、绿原酸甲酯(4)、木犀草素(5)、咖啡酸(6)、β-D-glucopyranosyloxyl pteodonote(7)、槲皮素(8)、methyl rel-(1S,2R,3R,5S,7R)-7-[(E)-caffeoyloxyme-thyl]-3-[(E)-caffeoy-loxy]-2-hydroxy-6,8-dioxabicyclo[3.2.1]octane-5-carboxylate(9)、木犀草素-7-(6′′-咖啡酰氧基)-β-D-葡萄糖(10)。
3.2 抗补体活性 课题组前期已经报道了木犀草素、槲皮素以及咖啡酸3个化合物的抗补体活性,本研究对其余7个化合物进行了抗补体活性的测定,这10个化合物的抗补体活性数据见表1。
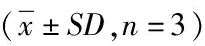
表1 化合物1~10的抗补体活性CH50值
上述10个化合物均为首次从西藏扁芒菊中分离得到,且均有不同程度的补体抑制作用。5个酚酸类化合物(1、3、4、6、9)的CH50范围为80.0~769.9 μg·mL-1,3个黄酮类化合物(5、8、10)的CH50范围为280.1~450.0 μg·mL-1,两类成分的抗补体活性与文献报道一致[24-26];另外,1个倍半萜类化合物(7,CH50:650.9±1.9 μg·mL-1)和1个酪醇类化合物(2,CH50:490.5±2.2 μg·mL-1)也显示中等强度的活性。
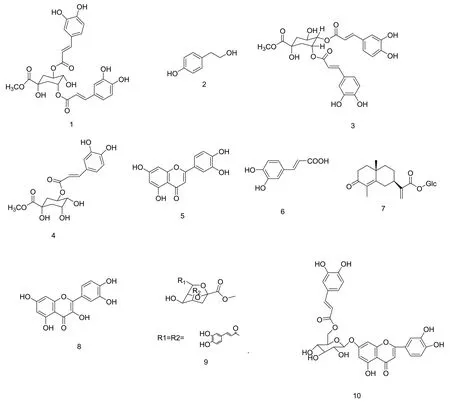
图1 化合物1~10的结构
4 讨论
本研究分离得到的10个化合物中,具有邻二酚烃基结构的酚酸类和黄酮类成分的抗补体活性普遍较强,其中以咖啡酸(6,CH50:80.0 μg·mL-1)的活性最强。进一步对比发现,酚酸类成分中含有两个咖啡酰基的3个化合物(1、3、9)活性明显强于仅含一个咖啡酰基的化合物(4),而且,具有咖啡酰基的黄酮类成分(10)活性也明显强于黄酮母核相同但不含此基团的黄酮(5),提示咖啡酰基在西藏扁芒菊成分的抗补体活性中发挥重要的作用。
课题组前期报道了西藏扁芒菊挥发油的抗炎、抗病毒活性,以及总多糖的免疫增强活性,并确定了挥发油的主要挥发性成分及总多糖的单糖组成[4-5]。本研究进一步明确了西藏扁芒菊中酚酸、黄酮等抗补体活性小分子成分,丰富了该传统藏药的药效物质研究基础,为其药材及相关制剂的质量控制提供了依据。
