经口气管插管激发和雾化激发建立哮喘小鼠模型的比较
2021-03-01胡婕邹文静王韵婷牛超符州代继宏
胡婕,邹文静,王韵婷,牛超,符州,代继宏
1.儿童发育疾病研究教育部重点实验室、儿童发育重大疾病国家国际科技合作基地、儿科学重庆市重点实验室,重庆 400014;2.重庆医科大学附属儿童医院呼吸中心,重庆400014
支气管哮喘(简称哮喘)是世界范围内严重威胁公众健康的慢性病,其发病率在发达国家高达15%~20%,在中国也有2%~4%[1],特别是近年儿童哮喘发病率较十年前上升了43.4%[2],提示现有哮喘防治措施严重不足,需要引起社会的广泛关注。当前小鼠哮喘模型是全世界进行哮喘研究最广泛的动物模型[3],但其构建方法存在较大差异,特别在致敏原剂量、致敏后激发方式上有较大不同[4,5],对小鼠哮喘模型建立的最优方案暂无广泛共识。
目前哮喘模型的激发方式主要有滴鼻吸入激发和雾化吸入激发两种[6],但这两种激发方式都不能完全对小鼠吸入气管的过敏原定量,如在滴鼻激发时,因鼻腔和口腔的连接,不能够确定药物是否进入气道以及进入气道的剂量,造成同批次哮喘模型的不稳定。若增加过敏原的滴鼻剂量和次数会提高小鼠的死亡率。在雾化激发时,国内多自制雾化盒对小鼠进行雾化[7];雾化时,因盒内OVA浓度易波动,小鼠药物吸入剂量不能明确,易造成哮喘建模不稳定,造成模型数据差异偏大。故寻找一种激发方式既能精准定量定位,又能够提高模型稳定性是十分必要的,因此本研究尝试在不同的致敏剂量的基础上采用经口气管插管(intratracheal instillation,ITI)[8]和雾化(atomizing inhalation,INH)的激发方式建立小鼠哮喘模型,从气道炎症、气道高反应性(airway hyperresponsiveness,AHR)以及血清总IgE等方面比较[9,10],探讨建立一种稳定、理想的小鼠哮喘模型。
1 材料与方法
1.1 材料
鸡卵清蛋白(ovalbumin,OVA,Sigma-Aldrich,U.S.A);氢氧化铝凝胶(Aluminum Hydroxide Gel,Alum,Sigma-Aldrich,U.S.A);乙酰甲胆碱(methacholine,Ach,Sigma-Aldrich,U.S.A);糖原PAS染色试剂(雷根生物技术,中国);Masson染色试剂盒(雷根生物技术,中国);ELISA检测试剂盒(欣博盛生物科技,中国);小鼠无创肺功能仪(EMKA,France)。
1.2 实验动物及模型建立
1.2.1 实验动物及分组6~8周龄SPF级雌性BALB/c小鼠,体重18~22 g,购于重庆医科大学实验动物中心,饲养于重庆医科大学附属儿童医院实验动物中心SPF级动物房,室温22~26℃,湿度55%~60%,光照12 h/d。将小鼠随机分为5组:对照组、20-INH组、100-INH组、20-ITI组、100-ITI组,每组6只。
1.2.2 致敏 建模哮喘组小鼠均于0、7、14 d经腹腔、大腿根部皮下各注射100μl致敏液(内含20μg OVA或100μg OVA,100μl Alum)致敏,对照组用相同的方法注射同体积的生理盐水。
1.2.3 激发 雾化激发组(20-INH组、100-INH组)于第21~30 d置入雾化箱内,予1%OVA溶液超声雾化吸入,每天30 min(图1A)。经气管给药激发组(20-ITI组、100-ITI组)于第21 d,水合氯醛(3 ml/kg)腹腔注射进行麻醉后,固定于解剖台上,用眼科镊将小鼠的舌头从口中轻轻牵出,用自制的插管装置[11]在发光耳勺的引导下插入插管装置,待小鼠呼吸平稳后缓慢滴入50μl激发液(含50μg OVA),48 h后重复1次,共5次(图1B)。对照组以等量生理盐水代替OVA致敏液及激发液,其余处理同哮喘组。
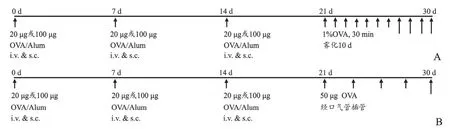
图1 哮喘模型造模方法A:雾化激发建立小鼠哮喘模型方法B:经口气管插管建立小鼠哮喘模型方法Fig.1 Establishment of asthma modelA:Establishment of mouse asthma model by atomizing inhalation;B:Establishment of mouse asthma model by intratracheal instillation
1.3 指标检测
1.3.1 气道高反应性测定 每组取6只小鼠于末次激发后24 h内用EMKA体积描记仪检测小鼠气道高反应性,先测定基础肺功能值2 min,再给予不同浓度的Ach(0、3.125、6.25、12.5、25、50 mg/ml)雾化3 min,休息2 min后记录5 min,完成后收集增强的呼气间歇(enhanced pause,Penh)数据[10],取其平均值分析小鼠气道高反应性。
1.3.2 支气管肺泡灌洗液(BALF)的灌取及细胞计数 小鼠于末次激发24 h内用10%水合氯醛麻醉,取眼球血后断颈处死,仰卧固定,充分暴露气管和胸腔,用止血钳钳夹左肺肺门处,留置针插入气管并固定,用预冷无菌PBS溶液进行右肺支气管肺泡灌洗,共3次,每次0.5 ml,回收率在80%以上。2500 r/min,4℃离心5min,收集上清液。细胞沉渣加入1 ml PBS稀释,充分混匀后取20μl进行细胞计数,剩余悬液,4℃,2500 r/min离心5 min,弃上清液,取细胞沉淀涂片,晾干后行瑞氏染色细胞分类计数。
1.3.3 病理染色 小鼠支气管肺泡灌洗液灌洗后松开左侧肺门处止血钳,取出左肺放入4%的中性甲醛内固定48 h,经脱水、石蜡包埋后切成4μm薄片,黏附于载玻片上,放入60℃烘箱烘烤48 h后分别进行HE染色、PAS染色和Masson染色,光镜下观察肺部病理情况。
1.3.4 血清中总IgE含量检测 将小鼠眼球血,常温,2500 r/min离心10 min,取上清,再常温,2500 r/min离心5 min,取上清,参照ELISA检测试剂盒说明检测血清中IgE含量。
1.4 统计学处理
采用Graph Pad Prism 6.0软件进行统计分析,数值以平均值±标准差(±s)表示,各组小鼠BALF细胞计数、肺部炎症情况及血清IgE水平用One-way ANOVA或Turkey检验;组间小鼠气道高反应性比较用Two-way ANOVA。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠气道高反应性检测结果
随着Ach浓度的增高,各组小鼠AHR也逐渐增加。在Ach浓度为0、3.125、6.25 mg/ml时,20-INH、100-INH、100-ITI三组的AHR与对照组无统计学差异(P>0.05)。在Ach浓度为12.5、25、50 mg/ml时,20-INH、100-INH、100-ITI三组的AHR较对照组明显升高(12.5 mg/ml:F=2.265,P=0.002;25 mg/ml:F=30.34,P<0.0001;50 mg/ml:F=15.57,P<0.0001);20-INH组、100-INH组和100-ITI组间无统计学差异(P>0.05)。20-ITI组AHR与对照组相比在Ach各浓度均无统计学差异(P>0.05)(图2)。
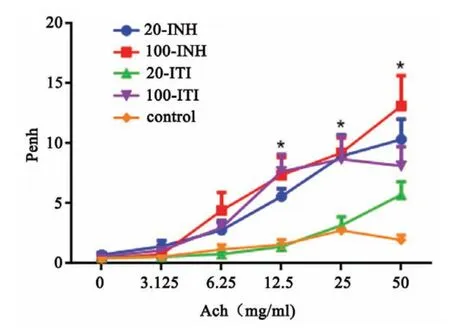
图2 各组小鼠气道高反应性*P<0.05,n=6Fig.2 Airway hyperresponsiveness of mice for each group*P<0.05,n=6
2.2 BALF细胞总计数及分类计数结果
20-INH组[(11.56±2.03)×105]、100-INH组[(7.45±2.49)×105]、100-ITI组[(9.47±1.79)×105]与对照组细胞总数[(2.403±0.94)×105]相比明显增多(F=27.81,P<0.0001)。其中20-INH组细胞总数均值最高,100-ITI组次之,两者相比有统计学意义(F=5.625,P=0.015),100-INH组与100-ITI组无统计学差异(F=1.971,P=0.4734)。20-ITI组[(3.403±1.44)×105]细胞总数最低,与对照组无明显差异(T=2.331,P=0.3745)(图3A)。
各哮喘组与对照组相比嗜酸性粒细胞总数明显升高(F=23.22,P<0.0001),其中100-ITI组升高最明显,20-ITI升高最不明显。20-INH组与100-INH组结果类似,无明显统计学差异(F=1.5,P=0.6672);100-ITI组嗜酸性粒细胞明显高于20-ITI组,两者有统计学差异(T=5,P=0.0005)(图3B)。
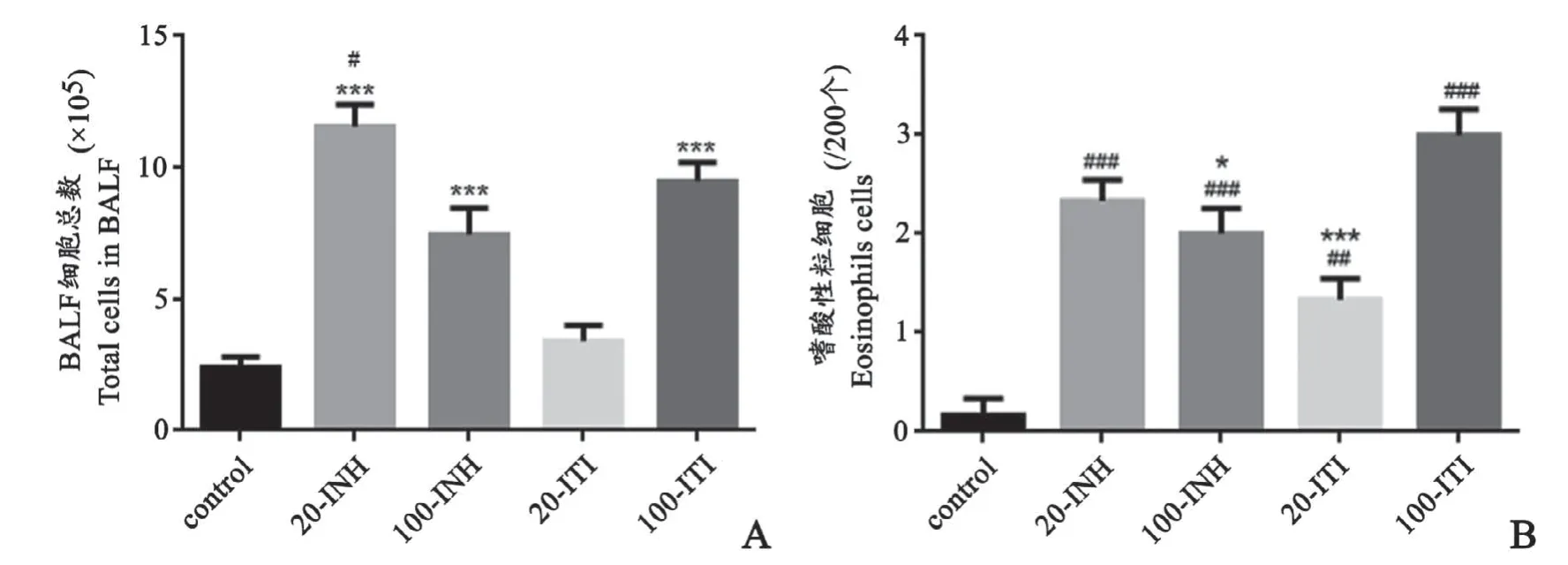
图3 各组BALF细胞分类计数A:与对照组相比,***P<0.001,与100-INH组相比,#P<0.05 B:与对照组相比,##P<0.01,与100-ITI组相比,*P<0.05,***P<0.001 n=6Fig.3 Numbers of total cells and eosinophils cells in BALF of the miceA:compared with control group,***P<0.001,#P<0.05;B:compared with control group,##P<0.01,compared with 100-ITI group,*P<0.05,***P<0.001,n=6
2.3 肺组织病理切片HE染色结果
各哮喘组小鼠气道和血管周围均有大量炎症细胞浸润,但20-ITI组较其他3组模型组气道及血管周围炎症细胞浸润程度较低。病理炎症评分结果显示:哮喘模型组炎症评分均明显高于对照组(F=98.62,P<0.0001),20-INH、100-INH、100-ITI 3组间病理炎症评分无明显差异(F=3.1,P=0.07),20-IHN、100-IHN和100-ITI组均明显高于20-ITI组(F=42.12,P<0.0001),提示20μg OVA致敏剂量下,经口气管插管激发建模效果稍差(图4)。

图4 各组小鼠肺组织HE染色A:对照组B:20-INH组C:100-INH组D:20-ITI组E:100-ITI组F:病理炎症评分,与对照组相比,***P<0.01,n=6Fig.4 HE staining of lung tissue in each group of miceA:control group;B:20-INH group;C:100-INH group;D:20-ITI group;E:100-ITI group;F:pathological inflammation score,compared with control group,***P<0.01,n=6
2.4 肺组织病理切片PAS糖原染色结果
糖原PAS染色反应物质为红色或紫红色,代表气道粘液的分泌。20-INH组、100-INH组、100-ITI组较对照组气道粘液分泌明显增多(F=54.8,P<0.0001),其中100-ITI组气道粘液分泌最为明显,明显高于其它各组(F=34.88,P<0.0001);20-INH组与100-INH组气道分泌粘液无明显差异(F=1.117,P=0.906);20-ITI组粘液分泌量低于其他3个哮喘组(F=34.88,P<0.0001),提示20μg OVA致敏剂量下,经口气管插管激发建模气道粘液分泌效果较差。此外,各组组内稳定性比较中,100-ITI组(SD=34.39)低于20-INH组(SD=36.59)和100-INH组(SD=34.62),该组数据离散程度最低(图5)。
2.5 肺组织病理切片Masson染色结果
各哮喘组小鼠器官周围无明显胶原蛋白沉积,无明显的纤维增生,无气道重塑的改变,其中100-ITI组纤维增生较对照组有增多,但无统计学意义(F=0.25,P=0.90)(图6)。
2.6 血清中总IgE含量检测结果
通过ELISA检测各组小鼠眼球血血清可知,各哮喘组血清中总IgE含量明显高于对照组,差异有统计学意义(F=40.36,P<0.0001),100-ITI组血清总IgE含量最高(F=9.85,P=0.0019),20-INH组与100-INH组相比无统计学差异(F=2.746,P=0.2918);20-ITI较其它哮喘组IgE水平最低(F=20.27,P<0.0001),提示经口气管插管激发下,20μg致敏剂量升高哮喘模型血浆IgE效果欠佳。此外,20-ITI(SD=0.17)、100-ITI(SD=0.37)组内差异小于20-INH(SD=0.71)、100-INH(SD=0.43),提示经口气管插管激发引发哮喘模型的IgE水平升高更稳定(图7)。
3 讨论
过敏性哮喘是一种异质性疾病,影响了全世界数百万人,并且每年的发病率稳步上升[12]。哮喘的发病机制十分复杂,小鼠哮喘模型在很大程度上促进了对哮喘病理生理机制的理解[13]。目前在建立小鼠哮喘模型的方法中,多采用BALB/c和C57BL/6近交系小鼠,鸡卵清蛋白和屋尘螨为过敏原,腹腔注射或滴鼻等方法进行致敏,雾化或滴鼻方法进行激发[14]。然而在现有建立小鼠哮喘模型的激发方式方法中,经鼻腔激发易使激发液经过口腔进入消化道,从而造成不同个体间呼吸道摄入激发量的差异和激发液的浪费;国外虽有已出现专门用于小鼠的雾化装置,但价格昂贵[7],故国内多采用自制的雾化装置,但因雾化装置未标准化常导致小鼠哮喘模型的不稳定,也不能明确定位病变部位,所以需采用新的激发方式精准定位定量,提高模型的稳定性。
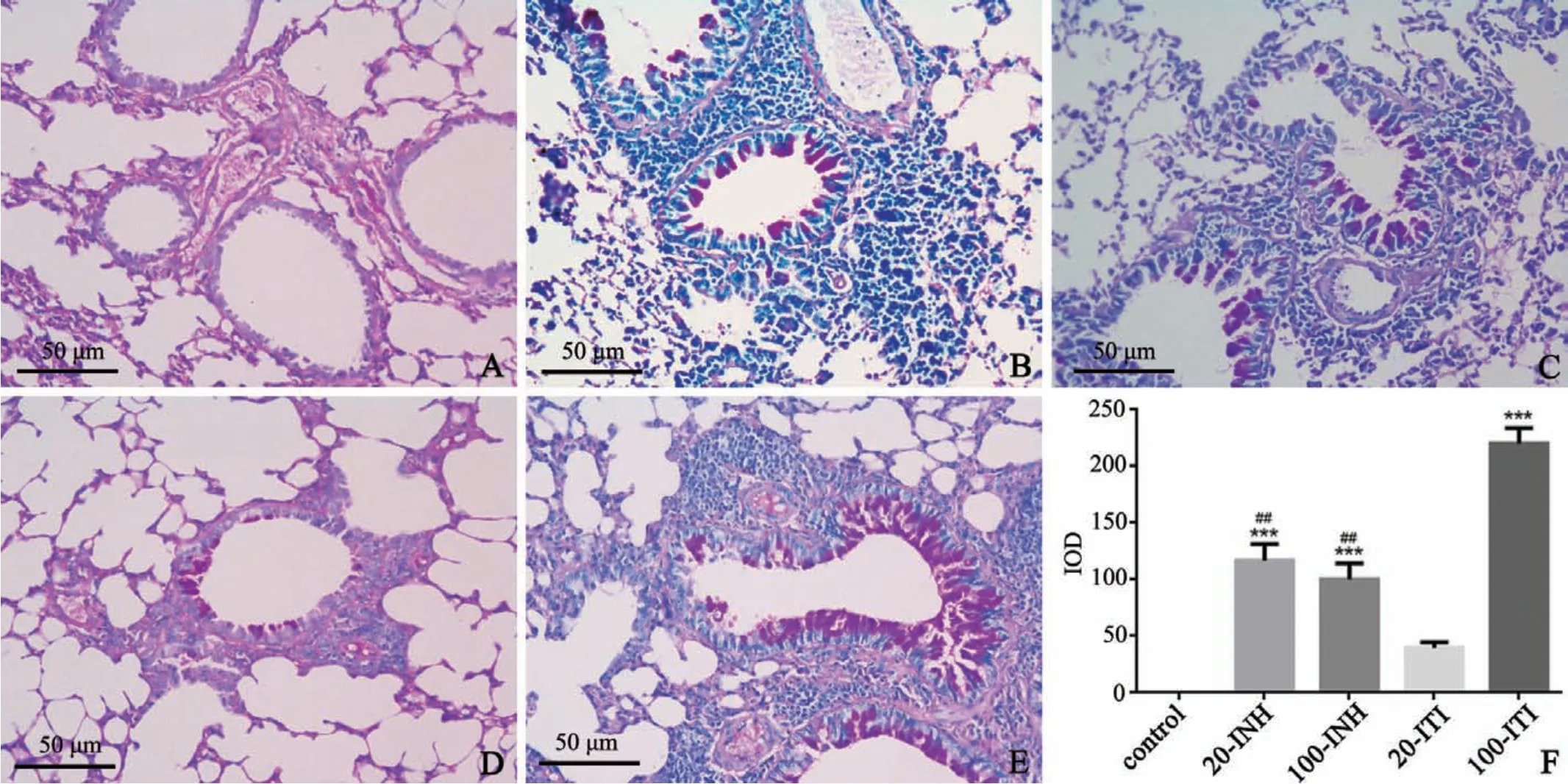
图5 各组小鼠肺组织PAS染色A:对照组B:20-INH组C:100-INH组D:20-ITI组E:100-ITI组F:IOD,与对照组相比,***P<0.001;与100-ITI组相比,##P<0.01,n=6Fig.5 PAS staining of lung tissue in each group of miceA:control group;B:20-INH group;C:100-INH group;D:20-ITI group;E:100-ITI group;F:IOD,compared with control group,***P<0.01,compared with 100-ITIgroup,##P<0.01,n=6

图6 各组小鼠肺组织Masson染色A:对照组B:20-INH组C:100-INH组D:20-ITI组E:100-ITI组F:IOD,n=6Fig.6 Masson staining of lung tissue in each group of miceA:control group;B:20-INH group;C:100-INH group;D:20-ITIgroup;E:100-ITIgroup;F:IOD,n=6

图7 ELISA检测血清总IgE含量与对照组相比,***P<0.001,*P<0.05;与100-ITI组比较,##P<0.01,#P<0.05,n=6Fig.7 Total IgEin serum detected by ELISAcompared with control group,***P<0.001,*P<0.05;compared with 100-ITIgroup,##P<0.01,#P<0.05,n=6
本研究前期发现,经口气管插管方法明确将药物作用在气管上,扩散至下气道[15],对哮喘病理基础气道炎症的研究准确定位。类似的给药方法已成功应用于肺纤维化模型的构建[16],故该技术成熟可行。因此,我们采取经口气管插管激发的方式用BALB/c雌性小鼠建立哮喘小鼠模型,与雾化激发建模进行比较,同时哮喘模型0VA致敏剂量多在10~100μg不等,其中10~20μg最常见[3],所以我们选择最常见剂量20μg和最大剂量100μg两种剂量进行建模。综上,本研究在不同致敏剂量上采用了两种激发方式构建小鼠哮喘模型,将经口气管插管激发建立的哮喘模型与雾化激发的哮喘模型在气道高反应性、气道炎症和血清总IgE水平等方面进行比较,以期选择出一种价格适宜,同时能减少同批次间模型差异性,提高小鼠哮喘模型稳定性的建模方法。
本研究结果显示,在小鼠气道高反应性中,经口气管插管激发与雾化激发所建模型均能明显提高小鼠气道高反应性,两种方法间没有明显的差异,表明经口气管插管激发的方式能够达到雾化激发建模效果;BALF细胞总计数中,各哮喘组中除20-ITI组外BALF细胞总数升高明显,经口气管插管激发小鼠哮喘模型细胞总数与雾化激发哮喘模型没有明显差异,同时经口气管插管激发组的数据标准差小于雾化激发组,表明经口气管插管激发哮喘模型组内数据离散程度低于雾化激发哮喘模型组,稳定性较好;在BALF嗜酸性粒细胞分类计数中,各哮喘组其嗜酸性粒细胞计数均高于对照组,且在100μg OVA致敏剂量下,经口气管插管激发组中BALF嗜酸性粒细胞计数高于雾化激发方式;血清总IgE水平检测表明,经口气管插管激发比雾化激发建立的小鼠哮喘模型更好的提升其血清总IgE含量,同时结合BALF中嗜酸性粒细胞总数提高,表明经口气管插管激发较雾化激发更易引起哮喘小鼠的过敏性质;肺组织病理切片HE染色结果表明,经口气管插管激发与雾化激发均可在小鼠哮喘模型引起气管及血管周围炎症细胞浸润,浸润程度无差异,而在糖原PAS染色中,可明显发现经口气管插管激发建立的小鼠哮喘模型其气管比雾化激发可以引起较多的粘液分泌,在Masson染色中,经口气管插管激发小鼠哮喘模型其气道周围纤维增生较雾化激发有增多趋势,但两种激发方式与对照组无统计学差异;各哮喘模型组中各指标数据中的标准差SD值结果显示,经口气管插管激发所建哮喘模型SD值低于雾化激发所建哮喘模型,表明前者组内数据离散程度小,所建小鼠哮喘模型更稳定。
同时,研究结果发现,20μg雾化激发组与20μg经口气管插管激发组只是在激发阶段给药方式上有差异,其致敏阶段给药剂量和方式一致,但这两组实验结果在气道高反应性、气道炎症、气道粘液分泌和血清总IgE水平升高方面均有明显差异,从而提示20 μg OVA致敏剂量经口气管插管激发不能完全引发气道哮喘炎症。在雾化激发组中,20μg和100μg OVA组在激发阶段给药方式和剂量完全一致,仅在致敏阶段药物剂量上有所差异,但它们均能成功建立哮喘模型,并在气道高反应性、气道炎症、气道粘液分泌以及血清总IgE水平无明显差异,提示致敏阶段致敏剂量的差异对哮喘模型建立影响不大。在100μg OVA致敏剂量下,经口气管插管激发组与雾化激发组在致敏阶段途径和剂量完全一致,仅在激发阶段给药方式有差异,但前者的嗜酸性粒细胞绝对值、血清总IgE水平、气道粘液水平均明显升高,提示激发阶段使用经口气管插管激发直接作用于气道更易引发机体变态反应和气道粘液高分泌。
综上所述,经口气管插管激发方式可以在100 μg OVA致敏剂量时成功的建立小鼠哮喘模型,该小鼠哮喘模型具有明显气道高反应性、气道炎症、气道粘液高分泌和血清高IgE水平,同时与雾化激发小鼠哮喘模型相比,该模型差异性小,稳定性更高。
