血清miR-144及miR-203表达水平对胃癌诊断及预后评估的价值
2021-03-01赵高传陈卿奇
赵高传 陈卿奇 庞 莉 程 正
(海南洋浦经济开发医院消化内科,洋浦 578101)
胃癌是胃黏膜上皮的常见消化道恶性肿瘤,其致死率高居癌症相关死因的第2位,已成为严重威胁人类生命健康的恶性肿瘤之一[1]。目前,根治性切除术是治疗胃癌的主要手段之一,但仍有部分患者手术疗效欠佳,术后5年生存率较低。因此,早期预判胃癌患者的预后情况并及时进行干预对提高患者的生存率具有重要意义。微小核糖核酸(microRNA,miRNA)是一类长度在21~25 nt的非编码小分子RNA,参与细胞增殖、分化、凋亡和新陈代谢等过程,在胃肠道肿瘤的发生发展中起到重要的作用[2]。近年来的研究发现,miR-144及miR-203在胃肠道肿瘤患者中异常表达,并能通过调控多种信号通路参与胃肠道肿瘤的发生发展,可能在胃肠道肿瘤的诊断、治疗和预后方面扮演重要角色[3-4]。然而,关于血清miR-144及miR-203表达水平对胃癌诊断及预后评估的研究鲜有报道。本研究通过检测胃癌患者术前血清miR-144及miR-203表达水平,分析其对胃癌诊断及预后评估的价值,旨在为胃癌的诊断及靶向治疗提供参考依据。
1 资料与方法
1.1资料 选取2015年1月1日至2017年12月31日海南洋浦经济开发医院和海南西部中心医院行胃癌根治术治疗的胃癌患者106例,其中男74例,女32例,年龄36~82岁,中位年龄61.70岁。纳入标准:①根据胃镜检查及组织病理学结果诊断为胃癌,参照WHO胃癌的病理学分类;②胃癌患者均常规行标准胃癌根治术治疗(D2术式),即胃大部分或全胃切除加清除胃周第二站淋巴结,术后根据患者情况行辅助化疗;③能配合本次研究及病历资料完整者。排除合并其他恶性肿瘤,无法配合本次研究者。另选取同期45例体检健康对照组,其中男30例,女15例,年龄35~79岁,中位年龄60.80岁。本研究经我院伦理委员会批准,并与患者或家属签署知情同意书。
1.2方法
1.2.1研究方法 采用前瞻性研究方法对106例胃癌患者进行随访,患者术后最初2年每3个月返院随访1次,以后每6个月1次,由专职人员采用电话或门诊等方式对患者或家属进行随访,截止时间为2019年5月31日。总生存时间(overall survival,OS)定义为术后第1天至患者死亡的时间。无进展生存时间(progression-free survival,PFS)定义为术后第1天起,未发生复发、原发器官肿瘤转移及其他原因引起死亡的时间。纳入本研究的变量包括患者年龄、性别、临床症状、TNM分期、分化程度、侵犯深度、脉管瘤栓、淋巴结转移、腹膜转移及肝转移等情况。
1.2.2miR-144及miR-203检测 miR-144引物:上游:5′-ACTAGATGCTACTAGCAGACG-3′,下游:5′-GATCAGTAGTGAGACTAG-3′;miR-203引物:上游:5′-GCATGCAGTATGTCTATCAG-3′,下游:5′-ACTAGACTAGATAGTCAG-3′。所有患者均于术前抽取空腹静脉血5 ml置于未加抗凝剂的离心管中,3 500 r/min 离心10 min,吸取上层血清400 μl,加入1 ml提取剂(TRIzol),于-70℃保存。在ABI 7500型荧光定量PCR仪上进行RT-PCR。反应体系为20 μl:TaqMan MicroRNA Assay 1.00 μl,cDNA 1.33 μl,TaqMan 2×Universal PCR Master Mix 10.00 μl,ddH2O 7.67 μl,混合后离心放入定量PCR仪。扩增条件为:95℃预变性10 min、95℃变性15 s、60℃复性60 s进行45个循环,实验重复3次。以U6为内参照,采用2-ΔΔCt法计算miR-144及miR-203的相对表达水平,其中ΔCt=Ct目的基因-CtU6。

2 结果
2.1胃癌组和对照组血清miR-144及miR-203表达水平比较 胃癌组血清miR-144表达水平(0.23±0.05)明显低于对照组(1.17±0.60),差异有统计学意义(t=14.627,P<0.001);胃癌组血清miR-203表达水平(0.38±0.12)明显低于对照组(1.05±0.46),差异有统计学意义(t=11.215,P<0.001)。见图1。

图1 胃癌组和对照组血清miR-144及miR-203表达水平比较
2.2血清miR-144及miR-203表达水平诊断胃癌的价值 血清miR-144表达水平诊断胃癌的最佳截断值为0.53,曲线下面积(area under cure,AUC)为0.856(95%CI:0.797~0.917),其敏感度和特异度为86.2%和82.7%。血清miR-203表达水平诊断胃癌的最佳截断值为0.62,AUC为0.814(95%CI:0.753~0.875),其敏感度和特异度为82.0%和78.0%。见图2。

图2 血清miR-144及miR-203表达水平诊断胃癌的ROC曲线
2.3血清miR-144及miR-203表达水平与胃癌患者的临床病理特征比较 以miR-144=0.53及miR-203=0.62为界值,将106例胃癌患者分为高miR-144组(miR-144≥0.53,n=30)和低miR-144组(miR-144<0.53,n=76);高miR-203组(miR-203≥0.62,n=35)和低miR-203组(miR-203<0.62,n=71)。高miR-144组与低miR-144组的TNM分期、脉管瘤栓、淋巴结转移、腹膜转移及肝转移比较,差异均有统计学意义(P<0.05);高miR-203组与低miR-203组的TNM分期、脉管瘤栓、淋巴结转移、腹膜转移及肝转移比较,差异均有统计学意义(P<0.05)。两组的年龄、性别、饮酒史、分化程度、侵犯深度及肿瘤最大径比较,差异均无统计学意义(P>0.05)。见表1。
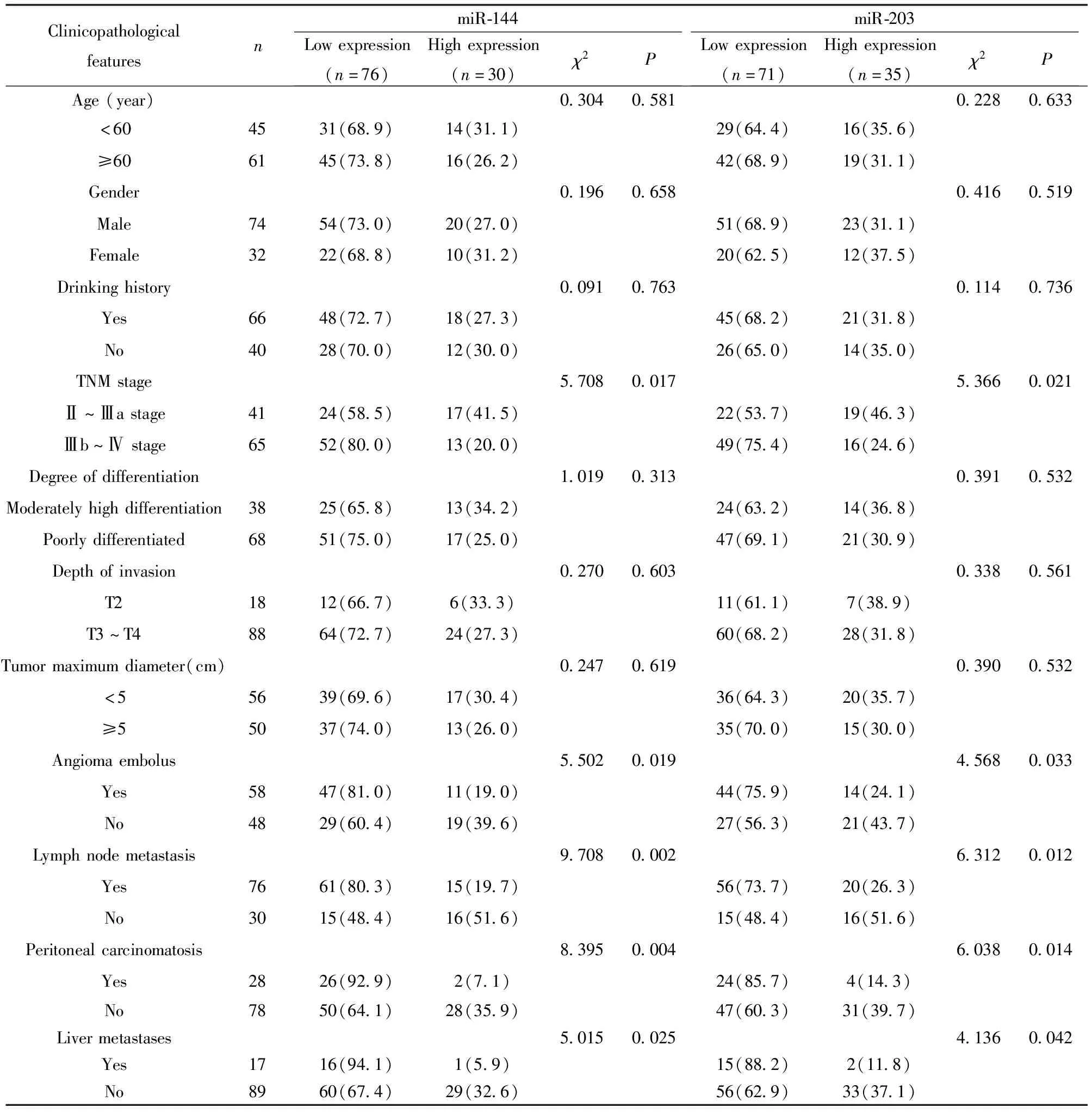
表1 血清miR-144及miR-203表达水平与胃癌患者的临床病理特征比较[n(%)]
2.4miR-144及miR-203表达与胃癌患者预后不良的关系 106例胃癌患者中失访4例,随访率为96.2%(102/106),随访时间为8~58个月,中位随访时间为29个月。生存分析显示,低miR-144组患者总生存率明显低于高miR-144组,差异有统计学意义(31.7% vs 60.4%;Log-rankχ2=15.370,P<0.001);低miR-144组患者无进展生存率明显低于高miR-144组,差异有统计学意义(19.6% vs 42.8%;Log-rankχ2=11.206,P<0.001),见图3。低miR-203组患者总生存率明显低于高miR-203组,差异有统计学意义(34.0% vs 58.2%;Log-rankχ2=12.183,P<0.001);低miR-203组患者无进展生存率明显低于高miR-203组,差异有统计学意义(22.5% vs 39.7%;Log-rankχ2=9.512,P<0.001),见图4。对单因素分析中有统计学意义的因素(TNM分期、脉管瘤栓、淋巴结转移、腹膜转移、肝转移、miR-144及miR-203)调入COX回归分析模型,结果显示腹膜转移[HR(95%CI)=3.164(2.273~6.108)]、肝转移[HR(95%CI)=1.905(1.217~4.106)]、miR-144<0.53[HR(95%CI)=2.730(1.981~5.394)]及miR-203<0.62[HR(95%CI)=2.181(1.562~4.775)]是影响胃癌患者预后不良的独立危险因素(P<0.05)。见表2。

图3 高miR-144组与低miR-144组胃癌患者总生存时间及无进展生存时间曲线比较

图4 高miR-203组与低miR-203组胃癌患者总生存时间及无进展生存时间曲线比较
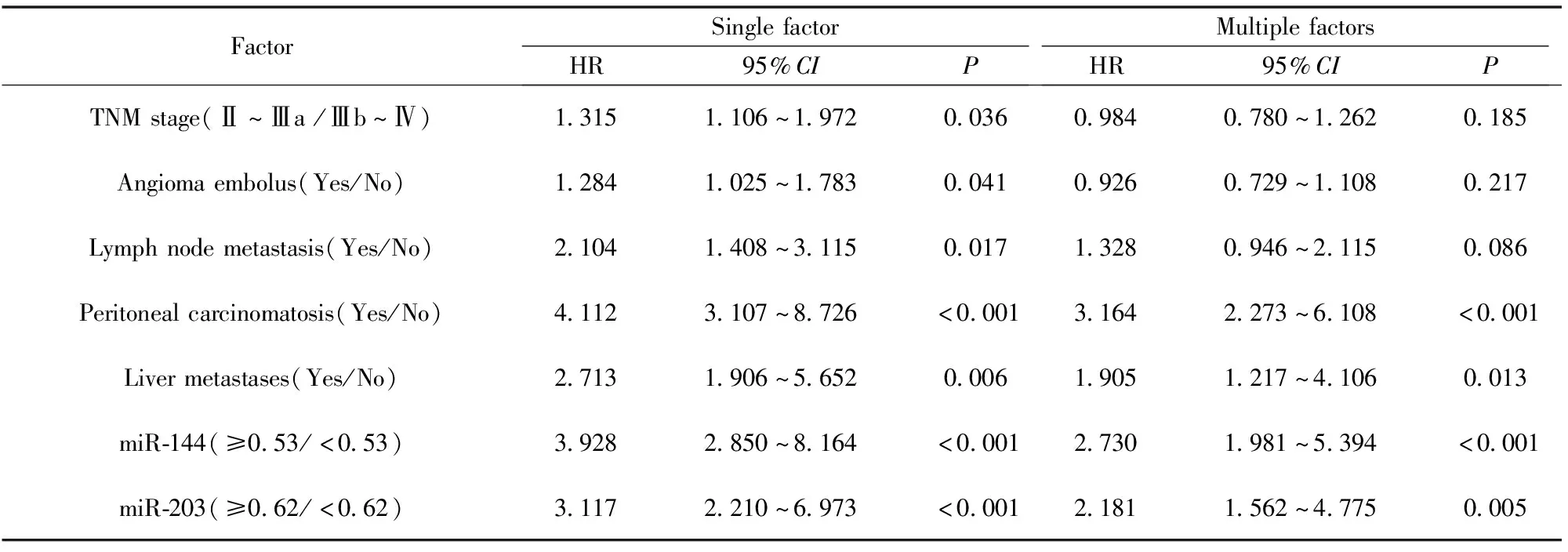
表2 影响胃癌患者预后不良的单因素及多因素COX回归分析
3 讨论
胃癌根治术是指原发肿瘤连同转移淋巴结及受累浸润的组织一并被切除的手术,并最大限度的保证肿瘤的彻底切除,减少局部的复发,从而达到治愈的效果[5]。然而,部分晚期患者的预后难以被准确地评估,其术后死亡率较高。因此,寻找用于胃癌个体化治疗和预后评估的生物标志物具有重要意义。miRNA是一类高度保守的内源性非编码单链RNA,广泛存在于真核生物中,通过转录后调控靶基因的表达,参与调控细胞的增殖、凋亡、侵袭、迁移和分化等过程,在恶性肿瘤的发生发展中发挥着重要的作用,有望成为肿瘤诊断和治疗的重要靶点[6]。近期的研究表明,miR-144及miR-203在多种恶性肿瘤中异常表达,且不同恶性肿瘤中miR-144及miR-203的表达水平不同,miR-144及miR-203对恶性肿瘤的诊断、转移及预后判断等方面具有重要的价值[7-8]。
本研究显示,胃癌组血清miR-144及miR-203表达水平均明显低于对照组,提示血清miR-144及miR-203表达水平在胃癌患者中异常低表达,其可能通过发挥抑癌基因的作用来调节胃癌的发生发展过程。MUSHTAQ等[9]研究显示,与正常胃上皮细胞相比,miR-144在胃癌细胞中的表达明显下调,miR-144的过度表达抑制了癌细胞的增殖、迁移和侵袭,其在胃癌进展中起重要作用。LI等[10]研究发现,miR-203在胃癌组织和细胞系中表达下调,其下调促进了胃癌细胞的增殖、迁移和侵袭,有可能在胃癌的发病机制中发挥关键作用。本研究中随着TNM分期增加、脉管瘤栓、淋巴结转移、腹膜转移及肝转移的胃癌患者,miR-144及miR-203的表达水平均下调,提示miR-144及miR-203低表达可能促进胃癌的进展过程,其低表达可导致一系列其靶向的癌基因过度激活,从而参与胃癌的发生发展。REN等[11]研究显示,miR-144在胃癌组织中表达下调,其低表达与淋巴结转移、TNM期显著相关,可促进胃癌细胞的增殖、侵袭和迁移。ZHOU等[12]研究认为,miR-203在胃癌组织和细胞中显著下调,miR-203的高表达抑制了胃癌细胞的集落形成、迁移和侵袭,其可能是一种新的胃癌治疗策略。另有研究表明,miRNA在胃癌患者中明显升高,其可能参与胃癌的发生和发展,其差异表达与肿瘤复发和淋巴结转移密切相关,是影响胃癌患者总生存率的独立预后因素[13]。
本研究应用ROC曲线分析,结果显示血清miR-144及miR-203表达水平诊断胃癌的最佳截断值分别为0.53、0.62,以此为标准对胃癌患者进行分组,并分析miR-144及miR-203表达水平与胃癌患者生存时间之间的关系。结果显示,低miR-144及miR-203组患者总生存率低于高miR-144及miR-203组,低miR-144及miR-203组患者无病生存率低于高miR-144及miR-203组。这说明miR-144及miR-203低表达与胃癌患者生存期短有关。此外,本研究进一步采用单因素及多因素COX回归模型分析显示,腹膜转移、肝转移、miR-144<0.53及miR-203<0.62是影响胃癌患者预后不良的独立危险因素。LIU等[14]研究显示,miR-144在胃癌组织和血清中的表达明显下调,miR-144水平较低的患者5年总生存率和无病生存率较差,可作为胃癌诊断及预后预测的潜在生物标志物。ZHENG等[15]研究发现,胃癌组织中miR-203的表达明显低于非癌组织,miR-203的低表达对总生存率和无进展生存率有显著影响,是影响总生存率(HR=2.73,95%CI:1.69~8.91,P=0.01)和无进展生存率(HR=4.19,95%CI:2.91~10.12,P=0.005)的独立预后因素。另有研究表明,血清miR-203的低表达与无病生存率和总生存率显著相关,多因素分析显示miR-203低表达、腹膜和远处转移是胃癌预后不良的独立预测指标,有望作为胃癌患者预后预测的无创生物标志物[16]。
综上所述,胃癌患者血清miR-144及miR-203表达水平下调,腹膜转移、肝转移、miR-144<0.53及miR-203<0.62是影响胃癌患者预后不良的独立危险因素,其中miR-144及miR-203低表达与胃癌患者生存期短有关,可能是预测胃癌患者预后不良的生物标志物。但本研究为单中心研究,病例来源较单一,缺乏多中心的研究结果,未来仍需大规模多中心的前瞻性研究进一步证实miR-144及miR-203与胃癌患者预后不良的关系。
