lncRNA SNHG8调控miR-335-5p表达影响膀胱癌增殖、迁移和侵袭的机制研究①
2021-03-01夏儒锐梁培育王声兴欧善际彭晓晖
夏儒锐 梁培育 王声兴 欧善际 彭晓晖
(海南医学院第一附属医院泌尿外科,海口 570102)
膀胱癌是世界范围内最常见的癌症之一,近年来其发病率呈上升趋势。膀胱癌分为两大类,非肌肉浸润性和肌肉浸润性[1]。大多数情况下的膀胱癌(75%~80%)是非肌肉侵袭性肿瘤,其复发率高达50%~70%[2]。尽管已有多种治疗方法,如根治性膀胱切除术、保留膀胱的经尿道切除术、化学疗法和放射疗法,但转移性膀胱癌的总生存期仅为13个月[3]。因此,迫切需要进一步探索膀胱癌肿瘤的发生和转移分子机制,并找到新的治疗策略来改善膀胱癌患者的预后。非编码RNA是一种不编码蛋白质,没有完整开放阅读框的转录副产物RNA,起初被认为是基因转录的“噪音”,现代研究证明,其在人类的多种癌症中均具有调控作用[4]。长链非编码RNA是长度大于200个核苷酸的非编码RNA,微小RNA是长度介于18~24个核苷酸之间的短链内源性非编码RNA,二者在人类癌症的进展中均具有调控作用[5]。lnc RNA 小核仁RNA宿主基因8(small nucleolus RNA host gene 8,SNHG8)在人类的很多癌症中均出现表达异常[6],但是其在膀胱癌中是否会出现异常尚且未知。已知miR-335-5p在膀胱癌中作为抑癌基因发挥作用[7],但是其与SNHG8之间的关系尚未完全清楚。本研究旨在探索lnc RNA SNHG8在膀胱癌细胞中增殖、迁移、侵袭和凋亡的作用机制。
1 材料与方法
1.1材料 膀胱移行上皮细胞SV-HUC-1、膀胱癌细胞SW780、5637、T24、HT-1197均购自中国科学院细胞库;噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂购自碧云天;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒购自南京诺唯赞生物公司;BD Transwell小室购自北京明阳科华生物公司;RNA抽提试剂盒、反转录试剂盒、qRT-PCR试剂盒均购自日本TaKaRa。实验中所涉及的引物和质粒(si-con、si-SNHG8、miR-con、miR-335-5p mimics、SNHG8)由上海吉玛公司设计并合成。pCDNA3.1(+)载体质粒购自上海酶研生物公司。
1.2方法
1.2.1细胞的培养 将膀胱移行上皮细胞SV-HUC-1、膀胱癌细胞SW780、5637、T24、HT-1197用含有10 %胎牛血清的DMEM培养基进行常规细胞培养。
1.2.2细胞的转染与分组 把正常培养的SV-HUC-1、SW780、5637、T24、HT-1197细胞分别标记为SV-HUC-1组、SW780组、5637组、T24组、HT-1197组。将SW780细胞随机分为NC组(不做任何处理)、si-con组(转染si-con)、si-SNHG8组(转染si-SNHG8)、pcDNA组(转染pcDNA)、pcDNA-SNHG8组(转染pcDNA-SNHG8)、miR-con组(转染miR-con)、miR-335-5p组(转染miR-335-5p mimics)、si-SNHG8+anti-miR-con组(共转染si-SNHG8和anti-miR-con)、si-SNHG8+anti-miR-335-5p组(共转染si-SNHG8和anti-miR-335-5p),各组细胞均用5倍量的脂质体进行转染,转染6 h后,更换新鲜培养基继续培养48 h。用qRT-PCR法检测转染效率,转染成功后用于后续的实验研究。
1.2.3qRT-PCR法检测细胞中SNHG8、miR-335-5p的表达 收集细胞,将其用RNA抽提试剂盒、反转录试剂盒提取RNA并合成cDNA。再用qRT-PCR试剂盒检测其中SNHG8、miR-335-5p的相对表达量。结果以GAPDH、U6为内参,2-ΔΔCt法计算SNHG8、miR-335-5p的表达。引物信息(5′-3′):SNHG8上游引物AAGTTTACAAGCATGCGCGG,下游引物TCAAACTGACGGTTCTCGGG;GAPDH 上游引物CGCTCTCTGCTCCTCCTGTTC,下游引物ATCCGTTGACTCCGACCTTCAC;miR-335-5p上游引物UGUUUUGAGCGGGGGUCAAGAGC,下游引物CUCUCAUUUGCUAUAUUCA;U6上游引物CTCGCTTCGGCAGCACA,下游引物AACGCTTCACGAATTT-GCGT;反应条件为:95℃ 5 min,95℃ 30 s,60℃ 30 s,72℃ 1 min,40个循环,最后延伸至72℃ 5 min。
1.2.4Western blot检测细胞中Ki-67、Cleaved caspase-3、MMP-2、MMP-9的蛋白表达 收集培养48 h的待检测细胞,充分裂解后,提取总蛋白,用BCA法定量。加入5倍体积的上样缓冲液对蛋白进行沸水浴变性,用上清进行上样。将蛋白小心加入梳子孔中,注意不要溢出孔外。电泳结束后,将蛋白转移至PVDF膜上,整个转膜系统需要在4℃低温条件下进行。然后5%脱脂奶粉封闭处理,一抗稀释液4℃孵育过夜处理。第2天,将膜转移至二抗稀释液中室温下孵育2 h。最后在暗室中进行显影、定影和曝光。用Image J分析条带的灰度值。
1.2.5MTT法检测细胞存活率 收集培养48 h的待检测细胞,调整细胞至5×105个/ml,取100 μl加入96孔板,依次加入20 μl的MTT液和150 μl的DMSO混匀溶解后,在490 nm波长下检测细胞的吸光度。细胞存活率=A490样品/A490对照×100%。
1.2.6流式细胞术检测细胞凋亡 收集培养48 h的待检测细胞,按照Annexin V-FITC/PI试剂盒要求操作,依次加入Annexin V-FITC、PI,避光反应结束后,上流式细胞仪,检测分析结果。
1.2.7Transwell小室检测细胞迁移和侵袭 采用带基质胶的小室检测细胞的侵袭数量,不含基质胶的小室检测细胞的迁移数量。将培养48 h的待检测细胞调整至5×105个/ml,用无血清培养基培养24 h,从中吸取200 μl平铺在上室聚碳酸酯膜表面,以浸湿膜为准。取600 μl含血清的培养基加入下室内。将小室置于37℃培养箱内,培养24 h后取出小室。配置甲醇固定液和1 g/L的结晶紫染色液。先擦去上室膜的上表面残余细胞,再将膜侵入甲醇中固定30 min,然后转移至染液中染色15 min,结束后将膜进行封片,镜检。选取5个视野进行拍照计数,取平均值。每个样本做3个复孔,实验重复3次。
1.2.8生物信息学分析 通过在线预测网站mircode(http://mircode.org/)预测SNHG8的靶点。
1.2.9双荧光素酶报告基因检测实验检测细胞荧光活性 通过荧光素酶与底物结合发生化学发光的特性,将化学合成的目的基因序列(SNHG8-WT)和突变序列(SNHG8-MUT)克隆在萤火虫荧光素酶基因上游,构建荧光素酶报告质粒。再将其与miR-335-5p mimics、miR-NC共转染至细胞。用裂解液充分裂解细胞,按照双荧光素酶报告基因检测试剂盒说明书要求操作,加入底物、终止液。结束后,检测细胞的荧光强度,以海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值反映细胞的荧光活性。

2 结果
2.1SNHG8和miR-335-5p 在膀胱移行上皮细胞株和膀胱癌细胞中的表达 结果如表1所示,与SV-HUC-1组相比,SW780、5637、T24、HT-1197细胞中SNHG8表达均显著升高,miR-335-5p表达均显著降低(P<0.05)。

表1 SNHG8和miR-335-5p 在膀胱移行上皮细胞株和膀胱癌细胞的表达
2.2沉默SNHG8抑制膀胱癌细胞 SW780增殖和诱导细胞凋亡 结果如表2和图1所示,与si-con组相比,si-SNHG8组细胞中SNHG8的mRNA表达显著降低,Ki-67蛋白表达显著降低,Cleaved caspase-3蛋白表达显著升高,细胞存活率显著降低,细胞凋亡率显著升高(P<0.05)。

图1 沉默SNHG8对膀胱癌细胞 SW780增殖和细胞凋亡的影响

表2 SNHG8抑制膀胱癌细胞 SW780增殖和诱导细胞凋亡
2.3沉默SNHG8抑制膀胱癌细胞 SW780迁移和侵袭 结果如图2和表3所示,与si-con组相比,si-SNHG8组细胞中MMP-2、MMP-9蛋白表达均显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)。

表3 沉默SNHG8抑制膀胱癌细胞 SW780迁移和侵袭

图2 沉默SNHG8抑制膀胱癌细胞MMP-2和MMP-9蛋白表达
2.4SNHG8靶向调控miR-335-5p 的表达 结果如图3所示,SNHG8与miR-335-5p之间存在靶向结合位点。与miR-con组相比,miR-335-5p组WT-SNHG8细胞荧光活性显著降低(表4)。与si-con组相比,si-SNHG8组细胞中SNHG8表达显著升高,与pcDNA组相比,pcDNA-SNHG8组细胞中SNHG8表达显著降低(表5)(P<0.05)。

表4 双荧光素酶报告实验

表5 SNHG8靶向调控miR-335-5p 表达
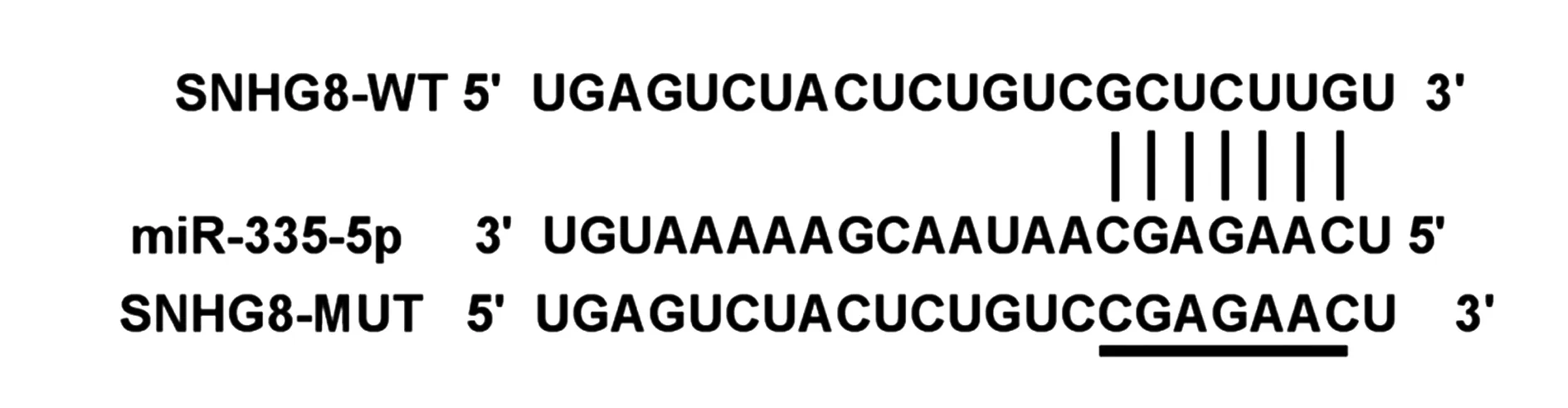
图3 SNHG8与miR-335-5p 存在互补序列
2.5转染miR-335-5p 抑制膀胱癌细胞 SW780增殖、迁移和侵袭及诱导细胞凋亡 结果如表6和图4所示,与miR-con组相比,miR-335-5p组细胞中 miR-335-5p表达显著升高,Ki-67、MMP-2、MMP-9蛋白表达均显著降低,Cleaved caspase-3蛋白表达显著升高,迁移细胞数和侵袭细胞数均显著降低,细胞存活率显著降低,细胞凋亡率显著升高(P<0.05)。
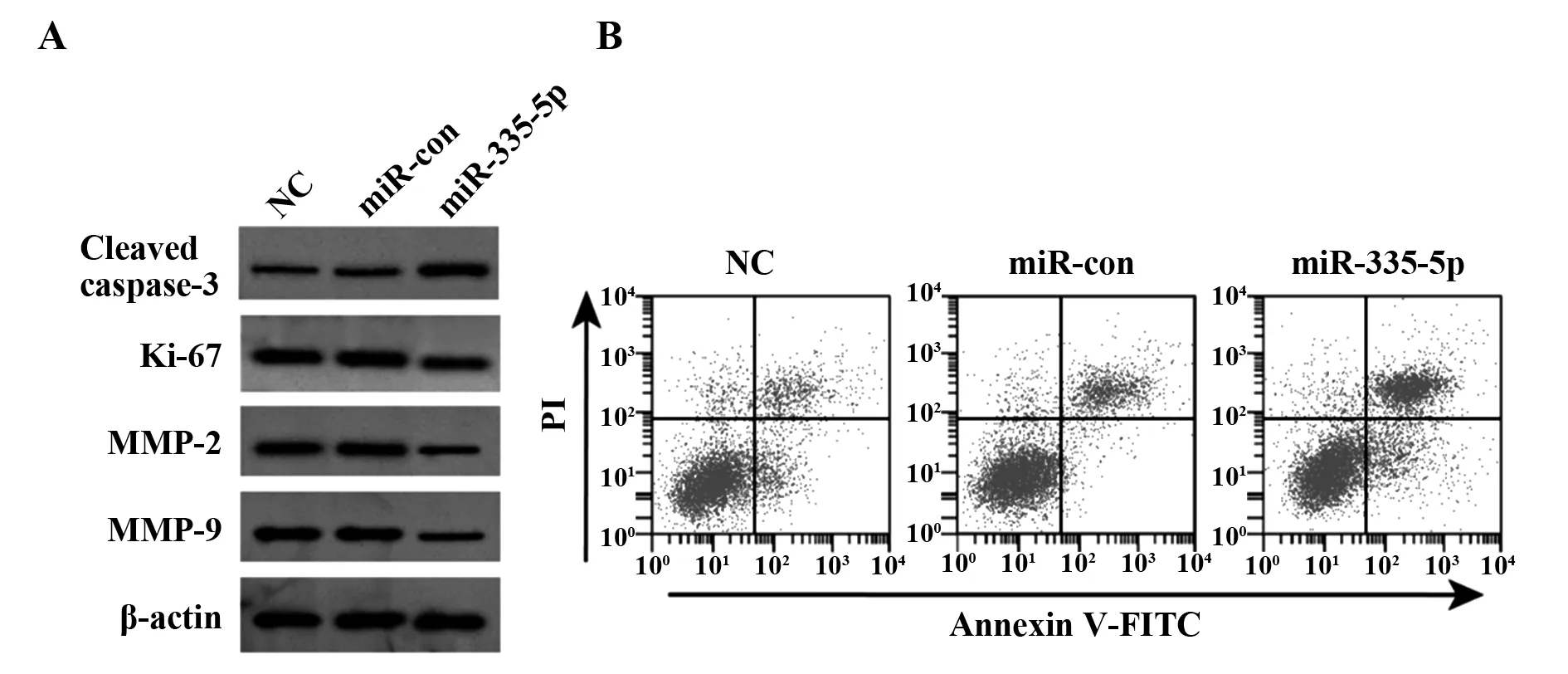
图4 转染miR-335-5p对膀胱癌细胞凋亡以及增殖、凋亡、迁移相关蛋白表达的影响

表6 转染miR-335-5p对膀胱癌细胞SW780增殖、迁移、侵袭和凋亡的影响
2.6干扰miR-335-5p 部分逆转沉默SNHG8对膀胱癌细胞 SW780的抑制作用 结果如表7和图5所示,与si-SNHG8+anti-miR-con组相比,si-SNHG8+anti-miR-335-5p组细胞中miR-335-5p表达显著降低,Ki-67、MMP-2、MMP-9蛋白表达均显著升高,Cleaved caspase-3蛋白表达显著降低,迁移细胞数和侵袭细胞数均显著升高,细胞存活率显著升高,细胞凋亡率显著降低(P<0.05)。

表7 转染anti-miR-335-5p部分逆转沉默SNHG8对膀胱癌细胞SW780增殖、迁移、侵袭和凋亡的影响
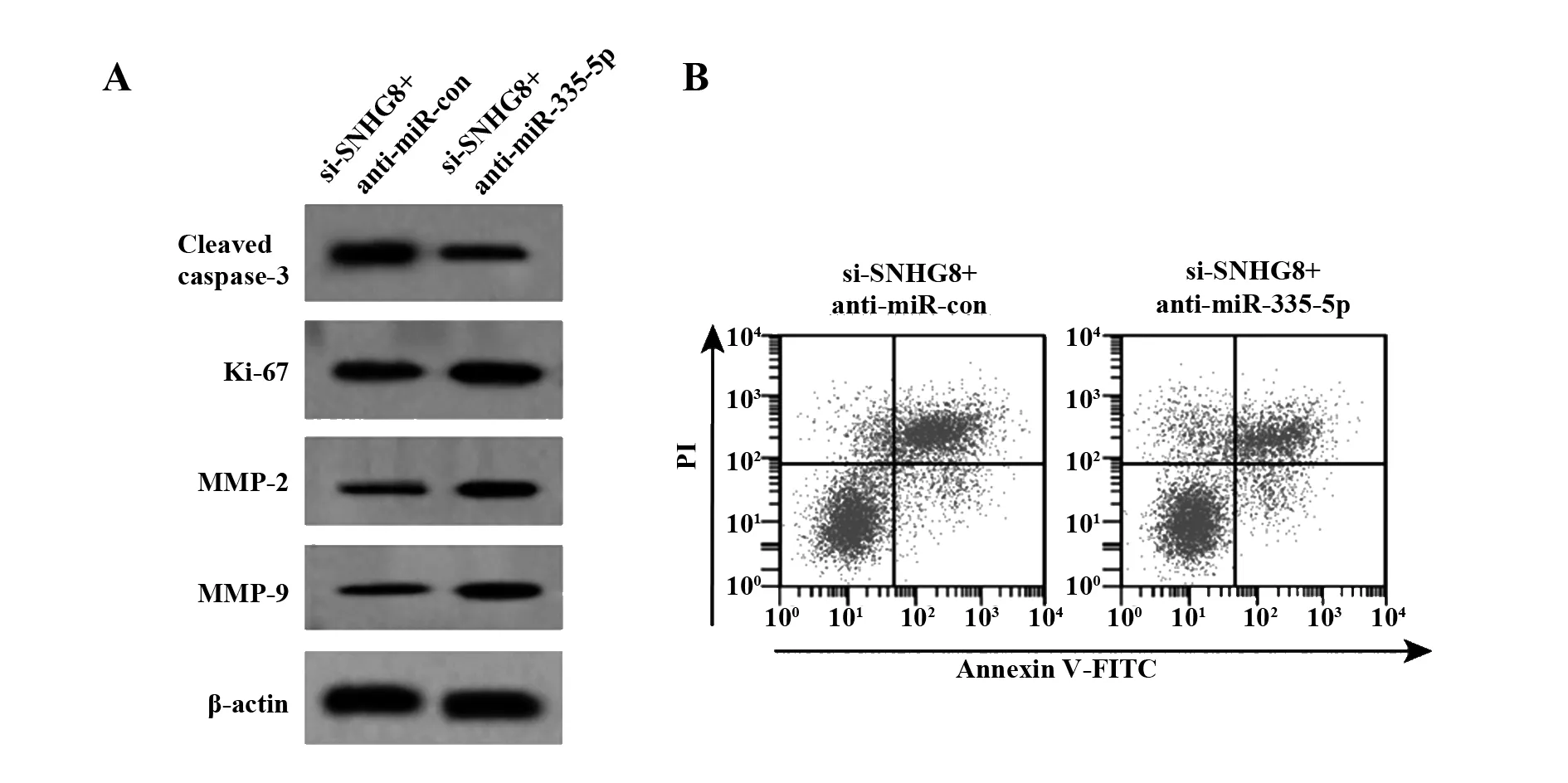
图5 转染anti-miR-335-5p部分逆转沉默SNHG8对膀胱癌细胞SW780凋亡以及增殖、迁移、侵袭和凋亡相关蛋白表达的影响
3 讨论
SNHG8在人类的很多癌症中均作为致癌基因发挥促进癌症发生发展的作用,但是其在膀胱癌中的研究甚少[8]。ZHEN等[9]在研究中发现,SNHG8在结直肠癌组织和细胞中显著上调,另外,敲低SNHG8能够明显抑制结直肠癌细胞的增殖、迁移和侵袭,并且miR-663可与SNHG8相互作用,通过双重荧光素酶报告基因分析证实了二者之间的靶向关系,此外,回补实验表明SNHG8通过调节miR-663发挥了促进肿瘤恶化的作用,揭示了SNHG8在结直肠癌中被上调,并通过靶向miR-663促进结直肠癌的增殖、迁移和侵袭。DONG等[10]在研究中报道,在肝癌组织和细胞中,lncRNA SNHG8的表达水平明显增加,并且是患者肿瘤复发的独立预后因素,此外,SNHG8的敲低抑制细胞增殖、侵袭,而SNHG8的过表达则具有相反的作用,并且SNHG8可作为miR-149的靶标,明显削弱miR-149在肝癌细胞中的抑癌作用,揭示lncRNA SNHG8可通过靶向抑制miR-149促进肝癌的发生和转移。我们在本研究中检测了膀胱癌细胞中SNHG8的表达,发现其异常升高,且沉默SNHG8能够抑制癌细胞的增殖、迁移和侵袭并促进凋亡,这与SNHG8在结直肠癌、肝癌中的作用相一致,说明了SNHG8也具有促进膀胱癌恶化的功能,这是首次发现该基因在膀胱癌中的功能;进一步通过生物信息学预测、双荧光素酶报告基因检测实验发现SNHG8可靶向负调控miR-335-5p,这表明SNHG8在膀胱癌中的功能可能与调控miR-335-5p有关,也为膀胱癌的精准治疗提供了新的作用靶标。这些实验结果为SNHG8在其他癌症中的功能开发提供了新的理论参考。
miRNA在癌症的进展中具有重要的调控作用,其可作为上游的Lnc RNA、Circ RNA的靶标,也可与下游的靶基因结合进而干扰靶基因的表达,以发挥调控作用[11-12]。有研究报道,miR-335-5p能够通过靶向丝裂原活化蛋白激酶1、Rho相关卷曲螺旋形成蛋白激酶,抑制膀胱癌细胞的增殖、迁移和侵袭[13-14]。LIU等[15]发现,miR-335表达明显降低,而CT10激酶样蛋白的调节因子(CRKL)表达则明显升高,CRKL被证实是miR-335在膀胱癌细胞中的特异性靶标,并且CRKL与miR-335表达之间的关系在膀胱癌组织中呈负相关,此外,膀胱癌细胞中的CRKL siRNA基团或miR-335模拟物能够明显抑制细胞增殖和迁移,揭示了miR-335可通过上调CRKL抑制膀胱癌细胞增殖和迁移。YANG等[7]在研究中发现,长链非编码核糖核酸SLCO4A1-AS1(SLCO4A1-AS1)在膀胱癌中具有促进癌症进一步恶化的作用,其机制之一为靶向miR-335-5p进而抑制八聚体结合转录因子4(OCT4),可见miR-335-5p在膀胱癌恶化中的重要作用。本研究发现,miR-335-5p在膀胱癌细胞中的表达异常降低,并且过表达miR-335-5p可抑制膀胱癌细胞的增殖、迁移和侵袭并促进凋亡,而抑制miR-335-5p可部分逆转沉默SNHG8对膀胱癌细胞的增殖、迁移、侵袭和凋亡的影响。这些实验结果与前人的研究结果相一致,说明miR-335-5p为SNHG8的下游靶标之一,为癌症的治疗提供新方向。
综上所述,长链非编码RNA SNHG8可调控膀胱癌细胞的增殖、迁移和侵袭并促进凋亡,其机制与靶向miR-335-5p有关,为膀胱癌的治疗提供参考依据。
