miR-186-5p与α-MSH互作对绵羊黑素细胞黑色素生成的影响
2021-03-01许冬梅朱芷葳唐中伟李鹏飞董常生赵宇军
许冬梅,朱芷葳,唐中伟,李鹏飞,董常生,赵宇军
(1.山西农业大学生命科学学院,太谷 030801; 2.山西农业大学动物医学学院,太谷 030801)
皮肤是人体的第一道屏障,具有重要的保护功能,其中黑素细胞产生的皮肤色素除了可以对抗高温和吸收紫外线外,还具有抗氧化剂和清除自由基的作用,黑色素由黑素细胞中的细胞器黑素体产生。黑色素的生成、转运和沉着除了由遗传物质决定外,还受环境和内分泌调节的影响[1]。酪氨酸酶(tyrosinase, TYR)、酪氨酸酶相关蛋白1(tyrosinase related protein 1, TYRP1)和酪氨酸酶相关蛋白2(tyrosinase related protein 2, TYRP2)是催化黑色素生成的关键因子,其中TYR是限速酶[2]。小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)是调控黑色素形成关键酶的重要转录因子[3]。促黑素细胞激素 (alpha-melanocyte stimulating hormone, a-MSH)是一种神经内分泌激素,由皮肤的黑素细胞和角化细胞合成和分泌[4],α-MSH与黑素皮质素受体1(melanocortinreceptor-1, MC1R)结合是皮肤色素合成与沉着起始的关键步骤,二者的结合不仅能激活和提高TYR的酶活性,上调其表达,促进真黑素的生物合成[5],还能促进黑素细胞树突的形成,使黑素小体更易转运到角化细胞,促进黑色素的沉着[6]。a-MSH/MC1R是黑色素生成的主要信号通路,可通过上调MITF的表达促进TYR、TYRP1和TYRP2 的表达,进而促进黑色素的合成[7]。
据报道,大约98%的基因组被转录为非编码RNA[8],microRNAs (miRNA, miR) 是大约18~25个碱基对的非编码单链RNA分子,主要在转录后水平上对基因表达发挥调节功能,通常miRNA与靶标基因的3′-非翻译区(UTR)不完全结合,抑制靶标基因蛋白质的翻译,其功能涉及细胞增殖、细胞分化、细胞凋亡、血管生成以及癌症和糖尿病等疾病的进程[9],如miR-186与细胞的增殖、分化和凋亡有关,且在各种癌症组织中表达异常,具有类似抑癌基因的作用,研究表明,miR-186与多种癌细胞和黑色素瘤细胞的增殖和迁移有关[10-13]。近年来发现,miRNAs与黑色素的生成和皮肤的色素沉着有关,且一些miRNAs如miR-25、miR-137、miR-145、miR-148-3p、miR-218等通过调控MITF参与毛色形成[14-17],许冬梅等[18]也发现,miR-186可能通过调控MITF影响绵羊黑素细胞的增殖、迁移和黑色素的合成。
一般对miRNA的研究都与其靶基因联系在一起,而且miRNA都是负调控其靶标基因的表达,本研究为了揭示miR-186-5p与α-MSH共同作用对绵羊黑素细胞及黑色素生成的影响,在绵羊黑素细胞中转染miR-186-5p,同时添加α-MSH因子使二者共同作用绵羊黑素细胞,为更深入地探讨miRNAs 的调节作用提供有力的理论依据。
1 材料与方法
1.1 载体构建与引物合成
本试验所用真核表达载体为带有绿色荧光蛋白的pcDNA6.2-GW/EmGFPmiR (Invitrogen)载体,包括miR-186-5p表达载体和阴性对照(negative control, NC)表达载体。所用引物均由北京六合华大公司合成,所有引物序列见表1。绵羊黑素细胞系由本实验室分离鉴定培养。

表1 目的基因引物序列Table 1 Primer sequences of target genes
1.2 主要试剂和仪器
反转录PCR试剂盒(TaKaRa, 大连),Trizol试剂(Invitrogen,美国),黑素细胞培养基(ScienCell,美国),RIPA裂解液(碧云天,上海),SYBR Prime Script TMRT PCR KIT (TaKaRa,大连),TYR抗鼠多克隆抗体(abcam,美国),TYRP1抗鼠多克隆抗体(abcam,美国),TYRP2抗鼠多克隆抗体(abcam,美国),MITF抗鼠多克隆抗体(Thermo,美国),抗 β-actin 兔多克隆抗体(CWBIO,北京),质粒中提试剂盒(QIAGEN,美国);高速低温冷冻离心机(Sigma,德国),超净工作台(SW-CJ-CO,苏州),7500 Fast Real time PCR System(Life technologies,美国),核酸蛋白测定仪(Thermo,美国)。
1.3 黑素细胞的复苏、转染、添加与划痕处理
液氮中取出保存的绵羊黑素细胞,在37 ℃预热的水浴中溶解复苏后接种于6孔培养板中, 37 ℃、5% CO2培养24 h更换培养基,细胞密度长到80%左右时进行转染、添加与划痕处理[18]。
试验共分为3组,分别为miR-86-5p组(绵羊黑素细胞中转染miR-86-5p真核表达载体)、阴性对照组(negative control,NC,转染NC真核表达载体)、miR-86-5p+α-MSH互作组(黑素细胞中转染miR-86-5p的同时添加α-MSH,α-MSH的添加浓度为10-9mol·L-1[19])。
1.4 qRT-PCR检测相关基因mRNA表达水平
收集转染、添加后培养48 h的绵羊黑素细胞,通过Trizol法提取细胞总RNA,使用反转录试剂盒反转录获得cDNA,根据NCBI上发布的序列设计绵羊MITF、TYR、TYRP1、TYRP2与18S的qRT-PCR扩增引物(表1),以浓度统一后的cDNA为模板,按照荧光定量试剂盒说明进行qRT-PCR扩增,每个样品重复3次。
1.5 Western blotting检测相关蛋白质表达水平
收集转染、添加后培养48 h的黑素细胞,使用蛋白提取试剂盒提取绵羊黑素细胞总蛋白,各组蛋白浓度统一后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),5%脱脂牛奶封闭转到NC膜上的蛋白质1 h,然后,将载有蛋白质的NC膜放入抗体孵育盒中一抗孵育4 ℃过夜,第2天TBST缓冲溶液洗涤NC膜3次,37 ℃摇床孵育二抗1 h,TBST洗涤3次,最后,通过Ecl发光液试剂盒,在凝胶成像系统中蛋白条带扫描成像。
1.6 分光光度法测定黑色素含量
转染、添加后培养48 h的黑素细胞PBS (磷酸缓冲液)洗涤3次,0.25%胰酶消化,PBS混悬细胞,取其中一部分细胞悬液进行细胞计数,剩余部分加入0.2 mol·L-1NaOH裂解液,在80 ℃金属浴中裂解5~10 min,细胞裂解液加入96孔的酶标板中,酶标仪测量475 nm 波长时的吸光值,最后根据吸光值和细胞计数值计算各组细胞的黑色素含量(μg/106个细胞)。
1.7 免疫组织化学检测MITF的表达与定位
转染、添加后培养48 h的黑素细胞PBS (磷酸缓冲液)洗涤3次,4%多聚甲醛固定30 min,3% H2O2孵育10 min去除内源性过氧化酶,血清封闭液中37 ℃孵育30 min,一抗稀释液中4 ℃静置孵育过夜(阴性对照PBS缓冲液代替一抗),次日复温后去除一抗,37 ℃恒温箱中二抗孵育30 min,避光条件下DAB显色,最后显微镜观察、拍照。
1.8 统计学分析
所有试验重复3次以上,利用SPSS 19.01进行统计分析,数据间比较使用单因素方差分析,P<0.05表示差异显著具有统计学意义。
2 结 果
2.1 miR-186-5p与α-MSH对相关基因转录水平的影响
收集并提取各试验组细胞总RNA,并反转录获得cDNA,以cDNA为模板通过qRT-PCR检测各试验组TYR、TYRP1、TYRP2和MITF基因转录水平的差异。结果显示,miR-186-5p转染组中,4种基因的转录水平均有所下降,分别为对照组的31.1%(TYR)、38.4%(TYRP1)、57.5%(TYRP2)和24.7%(MITF)(图1),其中,TYR和MITF基因表达极显著下降(P<0.01),TYRP1表达显著下降(P<0.05)。但当miR-186-5p和α-MSH同时存在时,4种基因转录水平的下调趋势均有所减缓但未恢复到对照水平,分别为对照组的70.5%(TYR)、84.4%(TYRP1)、68.9%(TYRP2)和68.3%(MITF),说明α-MSH缓解了miR-186-5p对TYR、TYRP1、TYRP2和MITF表达的抑制作用。

*. P<0.05, **. P<0.01,***.P<0.001。下同*. P<0.05, **. P<0.01,***.P<0.001. The same as below图1 miR-186-5p转染组、miR-186-5p+α-MSH互作组和对照组中TYR、TYRP1、TYRP2 和MITF mRNA相对表达量Fig.1 Relative expression levels of mRNA for TYR, TYRP1, TYRP2 and MITF in miR-186-5p transfected group, miR-186-5p+α-MSH interaction group and negative control group
2.2 miR-186-5p与α-MSH对相关蛋白表达的影响
收集各试验组细胞并提取细胞总蛋白,通过Western blotting检测基因表达产物的变化情况。结果显示,与对照NC组相比,miR-186-5p转染组和miR-186-5p+α-MSH互作组中4种蛋白质表达量都有所下降(图2)。miR-186-5p转染组中TYR、TYRP1、TYRP2和MITF蛋白表达分别为对照组的85%、68%、78%和62%,且差异均显著(P<0.05)。与mRNA表达类似,miR-186-5p+α-MSH互作组中,α-MSH缓解了miR-186-5p对TYR、TYRP1、TYRP2和MITF蛋白表达的抑制作用,分别为对照组的96%(TYR)、81%(TYRP1)、85%(TYRP2)和86%(MITF),且差异均显著(P<0.05)。

A.TYR、TYRP1、TYRP2 和MITF蛋白免疫印迹图;B. TYR、TYRP1、TYRP2 和MITF蛋白表达量A.Western blotting of TYR, TYRP1, TYRP2 and MITF; B. The relative protein expression of TYR, TYRP1, TYRP2 and MITF图2 miR-186-5p转染组、miR-186-5p+α-MSH互作组和对照组中TYR、TYRP1、TYRP2 和MITF的蛋白相对表达量Fig.2 The relative protein expression of TYR, TYRP1, TYRP2 and MITF in miR-186-5p transfected group, miR-186-5p+α-MSH interaction group and negative control group
2.3 miR-186-5p与α-MSH对绵羊黑素细胞中黑色素含量影响
为了进一步检测 miR-186-5p与α-MSH对绵羊黑素细胞中黑色素含量的影响,运用分光光度法对各试验组细胞进行黑色素含量测定。结果显示,miR-186-5p能极显著的降低绵羊黑素细胞中的黑色素含量(P<0.001),其含量仅为对照的50.8%(图3)。而miR-186-5p+α-MSH互作组的黑色素含量较之显著回升。由此可见, miR-186-5p通过抑制靶基因及相关基因的表达,最终抑制了黑色素的生成。而α-MSH能缓解miR-186-5p对黑色素生成的抑制作用。
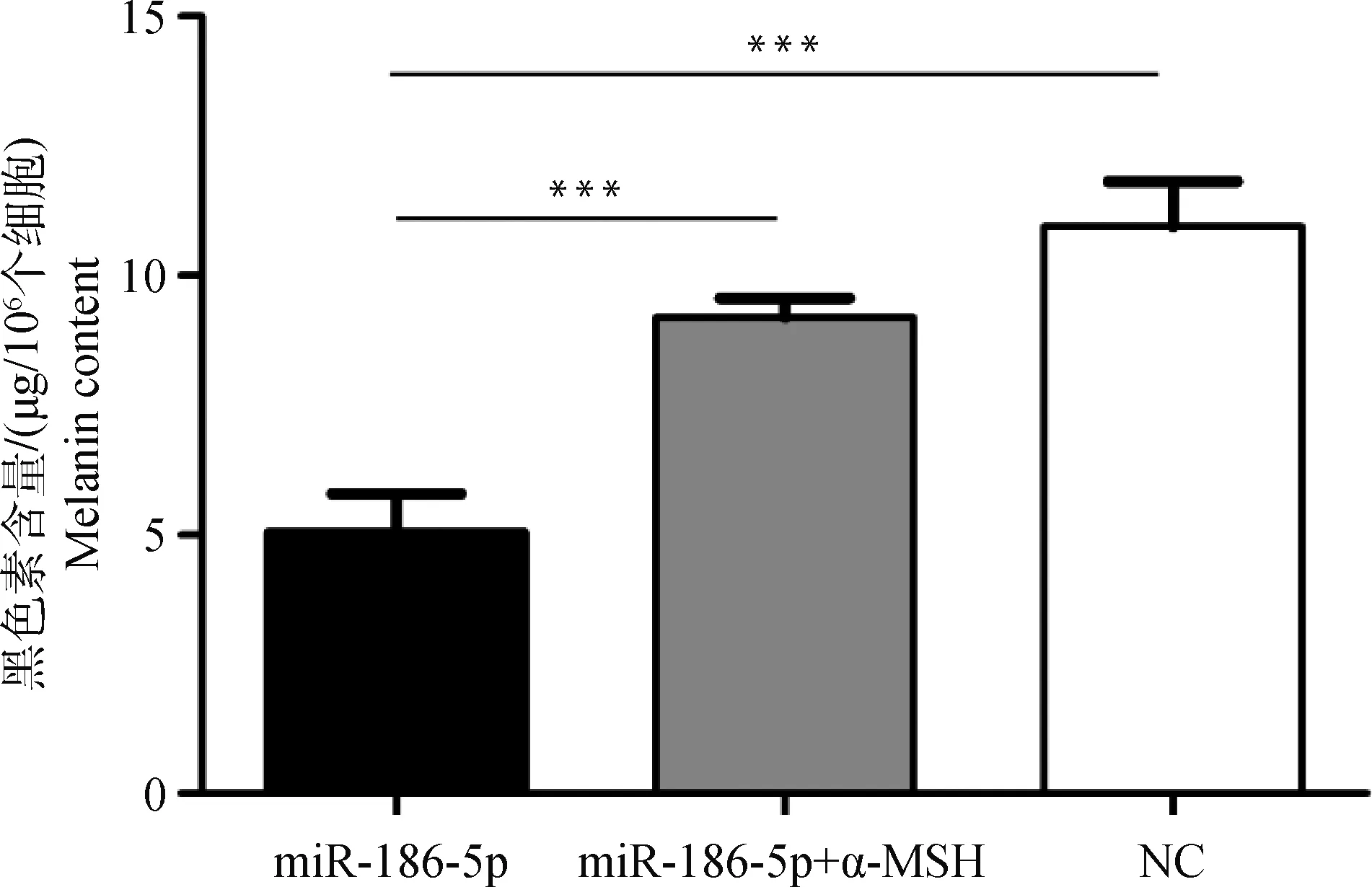
图3 miR-186-5p转染组、miR-186-5p+α-MSH互作组和对照组中黑色素含量Fig.3 The melanin content in miR-186-5p transfected group, miR-186-5p+α-MSH interaction group and negative control group
2.4 免疫组化检测MITF在不同转染组细胞中的表达差异
为了进一步了解miR-186-5p对MITF蛋白表达的影响,对不同处理组细胞中MITF蛋白进行了免疫组化定位。结果如图4显示,在阳性试验组中MITF都有表达,且分布于细胞核和细胞质。与对照组相比,miR-186-5p转染组和miR-186-5p+α-MSH互作组中MITF蛋白着色都变浅,其中miR-186-5p转染组着色最浅,miR-186-5p+α-MSH互作组略深,对照组着色最深。该结果再次证明,在绵羊黑素细胞中miR-186-5p抑制了MITF蛋白的表达,而α-MSH能缓解miR-186-5p对MITF蛋白表达的抑制作用。
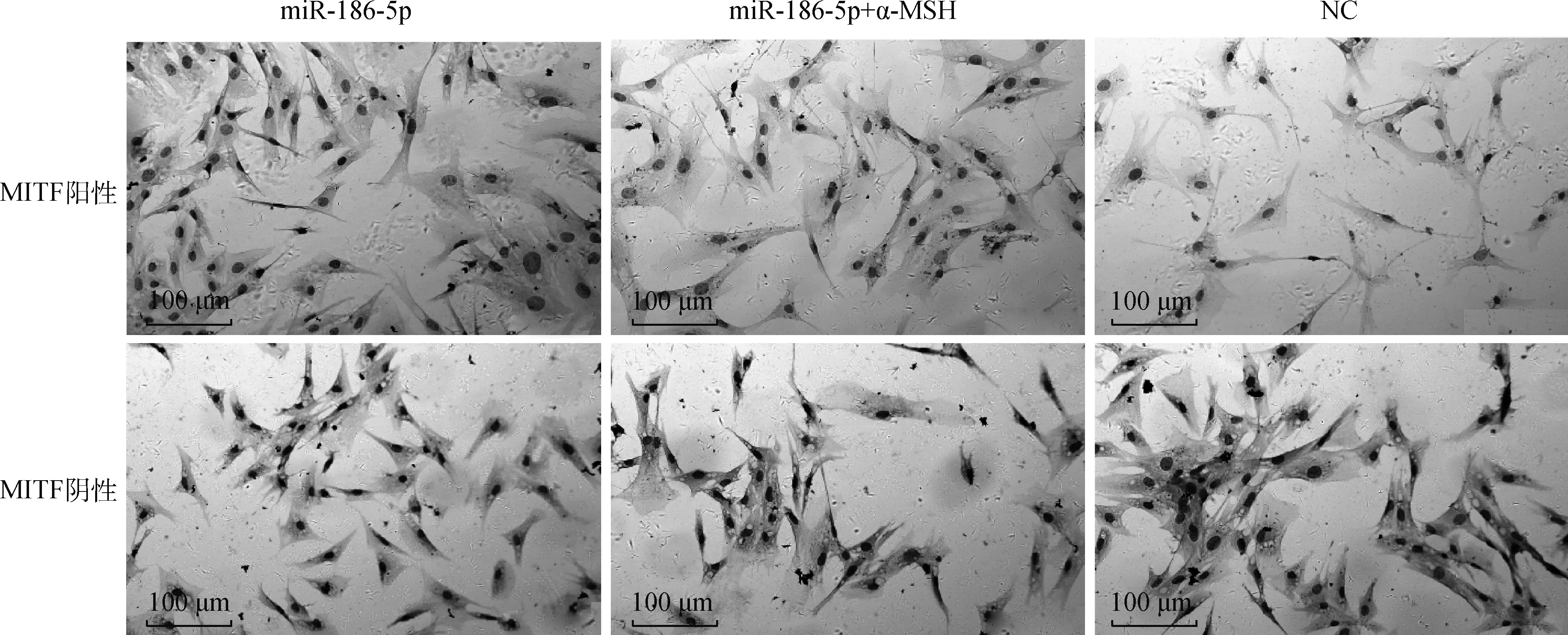
图4 miR-186-5p转染组、miR-186-5p+α-MSH互作组和对照组中绵羊黑素细胞MITF的免疫组化染色 (200×)Fig.4 Immunohistochemical staining of sheep melanocytes MITF protein in miR-186-5p transfected group, miR-186-5p+α-MSH interaction group and negative control group(200×)
2.5 miR-186-5p与α-MSH对黑素细胞迁移的影响
传代培养的绵羊黑素细胞长到80%左右进行处理(转染miR-186-5p和添加α-MSH),同时用10 μL枪头在培养板中间轻轻划出痕迹。每隔一段时间进行观察并拍照,观察不同处理对黑素细胞迁移能力的影响。由图5可看出,无论是对照组还是miR-186-5p转染组或miR-186-5p+α-MSH互作组,在处理后24 h划痕处细胞增殖、迁移均不明显,而36 h 后划痕处细胞生长出现差异。此时,对照组划痕处细胞密度最大,而miR-186-5p转染组和miR-186-5p+α-MSH互作组细胞密度相近。48 h后,对照组划痕已完全被细胞覆盖,而miR-186-5p转染组和miR-186-5p+α-MSH互作组仍能看到划痕痕迹。这些结果表明,miR-186-5p过表达能抑制绵羊黑素细胞的迁移,miR-186-5p与α-MSH协同作用时细胞的迁移能力没有明显变化,由此说明,α-MSH对绵羊黑素细胞的增殖、迁移影响不大。
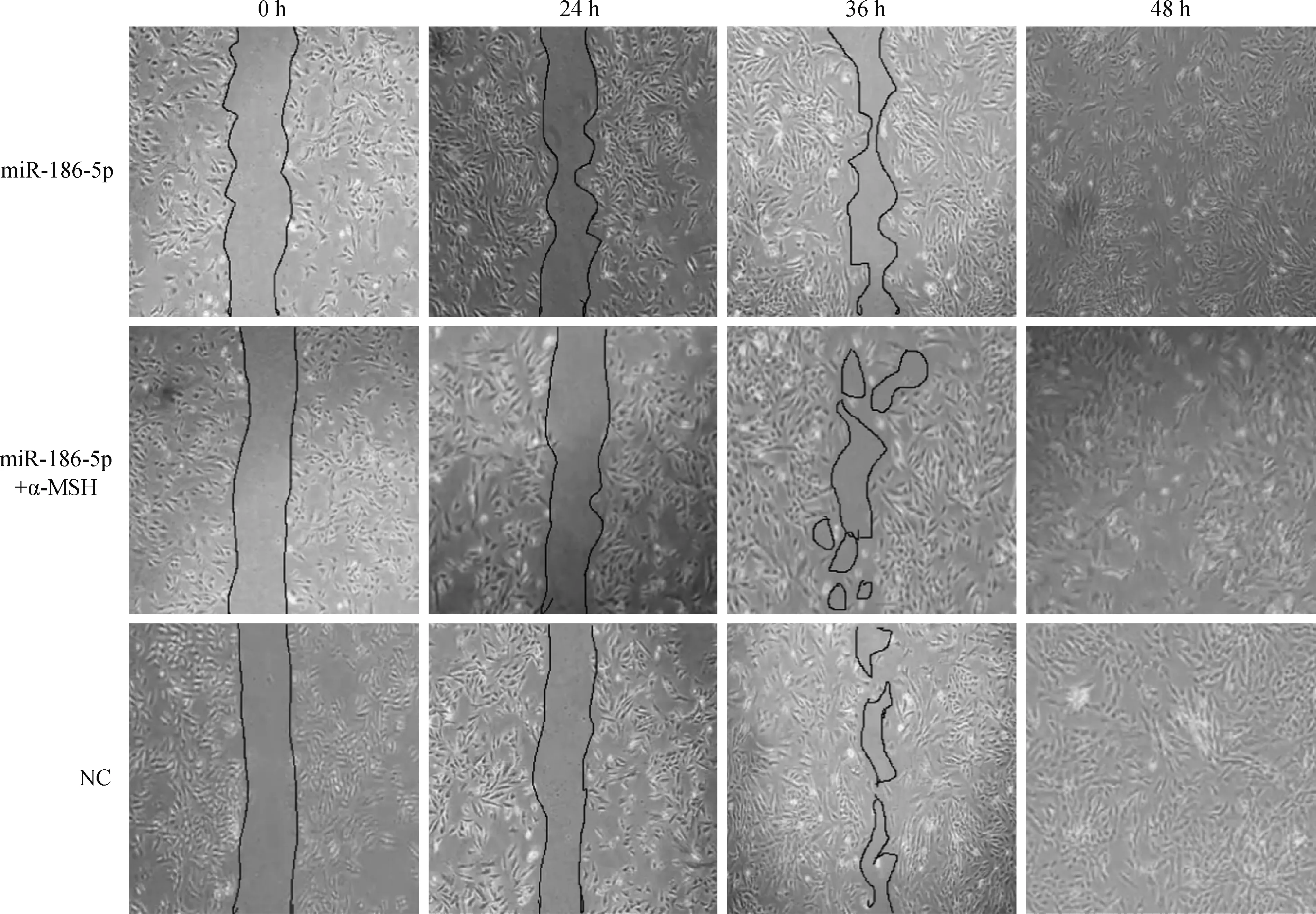
图5 miR-186-5p转染组、miR-186-5p+α-MSH互作组和对照组中绵羊黑素细胞的迁移能力 (40×)Fig.5 The migration capability of melanocyts in miR-186-5p transfected group, miR-186-5p+α-MSH interaction group and negative control group (40×)
3 讨 论
Tsatmali等[20]研究表明,动物外周皮肤中存在α-MSH的表达,且与皮肤色素沉着有关,α-MSH/MC1R与黑素细胞分化和黑色素的合成有关,MC1R是黑色素合成的开关基因,MC1R突变会使动物毛色性状改变。研究表明,黑素细胞中添加α-MSH可上调TYR的表达,促进黑色素的生成[21];Furumura等[22]发现,在人黑素细胞中,α-MSH/MC1R通过调控螺旋-环-螺旋转录因子调控MITF的表达,MITF通过与黑色素生成关键酶TYR、TYRP1和TYRP2的启动子结合,调控TYR、TYRP1和TYRP2的表达,进而影响黑色素的生成。杨柳和吕荣锋[23]通过免疫组织化学检测发现,α-MSH在白色毛皮的小鼠和豚鼠中呈阴性表达,而在黑色小鼠和棕黄色豚鼠的表皮中呈阳性表达;Hunt等[24]发现,α-MSH能促进黑素细胞树突的增加;Suzuki等[25]报道,紫外线照射能使黑素细胞停留在细胞周期的G1期, 但α-MSH能缓解紫外线的抑制作用而使细胞进入S期。Dorr等[26]报道,皮肤注射合成的强效促黑色素皮质激素[Nle4-D-Phe7]-α-MSH,能促进面部及前臂皮肤黑色素的沉着,且主要表现在真黑素合成比率增加。
Halaban[27]报道,在体外培养的细胞中,α-MSH与一些促分裂剂协同作用能促进细胞DNA的合成,但不会造成细胞数量的变化;有研究证实,α-MSH对黑色素产生的调控作用主要通过促进酪氨酸酶的合成及表达和黑素细胞有丝分裂,使其快速增殖来实现的[28]。于志慧等[19]报道,适当浓度的α-MSH添加到体外培养的羊驼黑素细胞中,不仅黑素细胞的分裂、增殖加快,而且黑素细胞的树突变得更细、更长;但Wakamatsu等[29]报道,α-MSH对人黑素细胞没有显著影响;Kim等[30]研究发现,α-MSH会抑制黑色素瘤细胞中酪氨酸酶的活性,但不影响细胞的分裂增殖;Swope和Abdel-Malek[31]研究报道,α-MSH、内皮素-1(ET-1)和碱性成纤维细胞生长因子共同作用人黑素细胞,不仅抑制UVR诱导的细胞凋亡,而且刺激细胞的增殖和黑色素的生成。本研究发现,在绵羊黑素细胞中添加α-MSH对细胞的增殖、迁移没有明显影响,但能促进黑色素的生成,与以往报道的α-MSH能促进黑色素生成一致,但在黑素细胞中添加α-MSH是否影响细胞增殖与细胞特性、培养条件、α-MSH的添加浓度等密切相关。
以往的研究表明,miR-186与肿瘤细胞的增殖、分化、凋亡有关。如miR-186通过结合不同的靶基因抑制多种癌细胞的增殖和迁移[10-12,32];研究发现,在绵羊黑素细胞中转染miR-186-5p能抑制黑素细胞的增殖和迁移[18],本研究中,miR-186-5p与α-MSH共同作用时,对绵羊黑素细胞分裂增殖起抑制作用的主要是miR-186-5p。
Bemis等[33]研究发现,在黑素细胞中miR-137抑制靶基因MITF的表达,而当α-MSH与miR-137协同作用时,α-MSH能减缓miR-137对MITF表达的抑制作用,缓解因miR-137过表达引起的黑色素生成减少;MITF是miR-141-3p和miR-200a-3p的靶基因,在三维重建的人类皮肤组织中转染miR-141-3p 和miR-200a-3p能抑制α-MSH刺激的黑色素生物合成[34];姬凯元等[35]研究发现,在体外培养的羊驼黑素细胞中同时转染 lpa-miR-nov-66 和添加α-MSH时, lpa-miR-nov-66能通过调控cAMP路径抑制α-MSH对黑色素生成的正调控。
综上,a-MSH/MC1R是黑色素生成的主要信号通路,是皮肤色素合成与沉着起始的关键步骤,二者的结合一方面激活和提高TYR家族的酶活性,促进黑色素的合成[5],还能促进黑素细胞树突的形成,加速黑素小体到角化细胞的转运,促进黑色素的沉着[6],另一方面通过调控螺旋-环-螺旋转录因子上调MITF表达,促进TYR、TYRP1和TYRP2的表达,进而影响黑色素的生成[22],而许冬梅等[18]发现,MITF是miR-186-5p的靶基因,且miR-186-5p能通过MITF抑制黑素细胞的增殖和迁移。本研究中,在绵羊黑素细胞中转染miR-186-5p的同时添加α-MSH,α-MSH能缓解miR-186-5p对靶基因MITF及黑色素生成关键基因家族TYR家族的抑制作用。
4 结 论
本研究结果显示,在绵羊黑素细胞中miR-186-5p通过负调控MITF抑制相关基因和蛋白的表达,同时抑制黑色素的生成,而添加α-MSH激活了α-MSH/MC1R信号通路,促进相关基因和蛋白的表达以及黑色素的生物合成,因此,在绵羊黑素细胞中miR-186-5p和α-MSH协同作用时,α-MSH能减弱miR-186-5p对黑色素生成的抑制作用,由于α-MSH 对黑素细胞的增殖影响不大,因此,在细胞划痕试验中α-MSH并不能缓解miR-186-5p对绵羊黑素细胞迁移的抑制作用。综上,在绵羊黑素细胞中转染miR-186-5p的同时添加α-MSH抑制了MITF及TYR家族的表达,进而抑制了黑色素的生成和细胞的迁移。
