沙棘多糖分离纯化及抗氧化活性
2021-03-01魏晨业包晓玮何梦梦曾兰君张亚涛
魏晨业,包晓玮,王 娟,何梦梦,曾兰君,张亚涛
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
沙棘(Hippophae rhamnoides)为落叶灌木或小乔木,属胡颓子科(Elaeagnaceae)[1],不仅能够防风固沙,还富含蛋白质[2]、多糖[3]、维生素[4]、胡萝卜素、黄酮[5]、碳水化合物、有机酸、氨基酸[6]和矿物质等[7]营养成分和药用成分,其不同部位,尤其是浆果,被认为是新疆、内蒙古和西藏的传统药物,具有多种活性,如抗菌、抗氧化和抗衰老作用[8]。沙棘多糖(sea buckthorn polysaccharides,SBP)在医药方面,具有抗肿瘤,预防心、脑血管系统[9]疾病等作用。多糖是在动物细胞膜、高等植物和微生物细胞壁[10]中发现的天然聚合物,无毒[11]、副作用小、生物活性广泛,是天然存在的重复单元(单糖或双寡糖)聚合碳水化合物,通过糖苷键连接在一起,是生命活动中必不可少的生物大分子,具有免疫调节[12]、抗肿瘤[13]、抗氧化等功能,在功能和医学领域得到了广泛的研究。
氧化对于生物体内能量的产生具有重要的意义,活性氧,例如羟自由基、过氧化氢和超氧阴离子自由基,可以通过多种方式在生物体中产生。在正常生理条件下,产生少量自由基是有益的。然而,过量的活性氧会产生氧化应激和可能引起多种疾病,还有可能会威胁到人类的健康[14]。目前,大多数合成抗氧化剂对人体都有潜在的危害[15],寻找天然抗氧化剂而不是合成抗氧化剂显得尤为重要。
本实验通过对沙棘进行提取、分离纯化得到SBP,并对其单糖组分、结构表征及抗氧化活性进行分析,旨在为SBP的开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
沙棘产自新疆阿勒泰;纤维素柱D E A E-5 2北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 美国Sigma公司;三氟乙酸等其他试剂为分析纯;单糖标准品:核糖、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖(均为色谱纯) 上海源叶生物科技有限公司。
1.2 仪器与设备
KQ-250DE超声波处理器 济宁金百特电子有限责任公司;7890A-5975C气相色谱-质谱联用仪 美国Agilent公司;FDU-2100冷冻干燥机 日本Eyela公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;Nicolet iS50型红外光谱仪 赛默飞世尔科技公司。
1.3 方法
1.3.1 沙棘粗多糖的制备
根据课题组研究的方法进行[16]。将200 g沙棘干果粉碎,过40 目筛,加入10 倍体积石油醚回流提取2 次,每次1 h,待除去其中的脂溶性物质,抽滤,留滤渣待用。准确称取预处理后的沙棘果渣适量,按料液比1∶20(g/mL)加入蒸馏水,70 ℃超声波辅助提取,提取液浓缩至一定体积,加入3 倍体积无水乙醇,4 ℃静置12 h使沉淀产生,沉淀离心,用Sevag法[17]除蛋白共5 次,置40 ℃烘箱干燥即得沙棘粗多糖。
1.3.2 SBP的分离纯化
称取100 mg沙棘粗多糖样品,溶于10 mL蒸馏水中,配制成质量浓度为10 mg/mL的多糖溶液,7 000 r/min离心10 min去除不溶性物质,将离心后的多糖溶液过0.45 µm过滤膜,加样至DEAE-52纤维素柱[18],用蒸馏水、0.2、0.4、0.6、0.8 mol/L的NaCl溶液进行梯度洗脱,每个梯度洗脱200 min,自动收集器收集(流速为0.6 mL/min,每管收集9 mL),蒽酮-硫酸法[19]检测多糖,合并主要吸收峰洗脱液,氯化钠洗脱部分透析48 h除盐,浓缩冷冻干燥。
1.3.3 SBP单糖组成测定
1.3.3.1 标准单糖的衍生化
分别准确称取5 mg各标准单糖,包括核糖、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖及半乳糖,放入试管中。分别加入8 mg盐酸羟胺及0.5 mL吡啶,溶解后置于90 ℃水浴中,使其反应30 min。取出后,冷却至室温。接着加入0.5 mL乙酸酐,再置于90 ℃水浴加热[20],反应30 min,氮吹仪吹干,加入1.0 mL氯仿,产物用于气相色谱-质谱联用分析。
1.3.3.2 SBP样品的水解及衍生化
准确称取5 mg多糖纯品,溶解于4 mL 2 mol/L三氟乙酸中,置于安瓿瓶,酒精喷灯封管。鼓风干燥箱中于110 ℃密闭水解反应6 h。反应结束,酸水解的样品中加入5 mL甲醇,旋蒸蒸干,重复3 次,除掉剩余的三氟乙酸。按1.3.3.1节标准单糖衍生化方法处理,反应产物进行气相色谱分析。
1.3.3.3 气相色谱条件
毛细管色谱柱OV-1701(30 cmh 0.32 mm,0.25 μm);火焰离子化检测器,检测器温度270 ℃;进样口温度250 ℃。色谱柱采用程序升温,起始温度160 ℃,保留5 min,以5 ℃/min速率升至190 ℃,保留5 min,再以5 ℃/min速率升至230 ℃,保留5 min。以氮气为载气[21],进样体积1 μL。
1.3.4 SBP红外光谱的测定
称取多糖样品各1.5 mg[22]与适量KBr粉末置于玛瑙研钵中研磨,研磨至极细粉末后压片。在4 000~400 cm-1范围内进行红外光谱扫描。
1.3.5 SBP抗氧化活性分析
1.3.5.1 DPPH自由基清除活性测定
根据冯炘等[23]的方法稍作修改。取不同质量浓度SBP及VC溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)各1 mL,分别加入2 mL 0.2 mol/L DPPH自由基的乙醇溶液,混合均匀,在室温避光静置30 min,在波长517 nm处测定吸光度,以VC为阳性对照,清除率按式(1)进行计算:
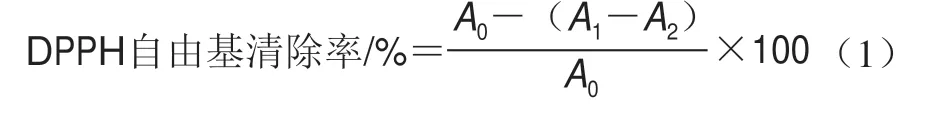
式中:A1为待测样DPPH自由基的乙醇溶液;A2为待测样+无水乙醇;A0为无水乙醇+DPPH自由基的乙醇溶液。
1.3.5.2 ABTS阳离子自由基清除活性测定
根据刘宇琪等[24]的方法稍作修改。配制不同质量浓度的SBP溶液各取1 mL,加入4 mL ABTS工作液,完全混合,暗处反应6 min,734 nm波长处测定吸光度,以VC为阳性对照,按式(2)计算其清除率:
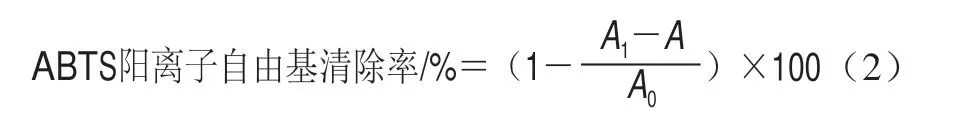
式中:A1为试样与ABTS混合溶液吸光度;A为不含ABTS样品溶液吸光度;A0为取代样品溶液的蒸馏水的吸光度。
1.3.5.3 还原能力的测定
根据张瑞娟等[25]的方法稍作改进。配制不同质量浓度的SBP溶液,取1 mL,加入0.2 mol/L的PBS(pH 6.6)2 mL,质量分数1%的铁氰化钾溶液2 mL,均匀混合后,在50 ℃水浴中反应20 min,加入10%三氟乙酸溶液2 mL,3 000 r/min离心10 min。取离心后上层液50 μL,加2 000 μL蒸馏水与1%六水氯化铁200 μL,摇匀,反应10 min。蒸馏水作为空白对照,VC作为阳性对照,在700 nm[26]波长处测定吸光度。
2 结果与分析
2.1 SBP DEAE-52纤维素柱纯化结果
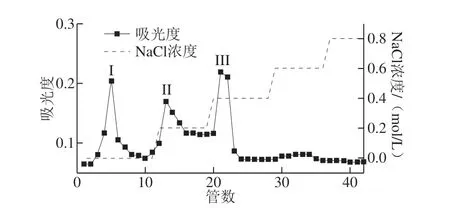
图1 DEAE-52纤维素柱洗脱结果Fig.1 Elution curve of crude polysaccharides on DEAE-52 cellulose column
如图1所示,SBP通过DEAE-52层析柱分离,得到3 个明显的洗脱峰,分别是以蒸馏水、0.2、0.4 mol/L NaCl溶液洗脱得到。在用蒸馏水洗脱时,一些不带电或带电能力弱的组分[27],不易被DEAE-52纤维素吸附,因此首先被洗脱出即得到第1个组分SBP-I。从洗脱曲线还可看出,NaCl溶液中的Cl-吸附性强,可将被DEAE-52纤维素吸附的有负电荷的部分洗脱下来,即得到由0.2、0.4 mol/L NaCl溶液洗脱的SBP-II和SBP-III组分。
2.2 红外光谱分析

图2 SBP-I(A)、SBP-II(B)、SBP-III(C)红外光谱图Fig.2 FTIR spectra of SBP-I (A), SBP-II (B) and SBP-III (C)
如图2所示,在4 000~400 cm-1[28]范围内3 种组分均出现了典型的多糖吸收峰。3 420 cm-1左右的宽峰为Oü H的伸缩振动峰;2 920 cm-1附近的吸收峰为Cü H伸缩振动峰[29];1 620 cm-1左右的吸收峰是多糖水合振动峰;1 400 cm-1左右是Cü H面内弯曲振动信号峰;1 000~1 200 cm-1之间3 个弱吸收峰是Cü O键伸缩振动吸收峰Cü Oü H的弯曲振动峰;835 cm-1附近的吸收峰是α-糖苷的特征峰;880 cm-1附近的吸收峰为β-糖苷的特征峰[30],可推断SBP-I及SBP-II属于α-构型的多糖;SBP-III属于β-构型的多糖。
2.3 气相色谱分析
利用糖腈乙酸酯衍生化方法处理样品,根据气相色谱的定性分析,测定3 种多糖组分的单糖组成。所设定条件下测得的混合标准品及样品的乙酰化衍生物色谱图如图3、4所示。SBP-I单糖组成主要有阿拉伯糖(3.11%)、木糖(2.63%)、甘露糖(5.78%)、葡萄糖(84.65%)及半乳糖(3.81%),物质的量比为阿拉伯糖∶木糖∶甘露糖∶葡萄糖∶半乳糖=1.18∶1∶2.20∶32.17∶1.45;SBP-II单糖组成主要有木糖(40%)、甘露糖(11.2%)、葡萄糖(40.8%)及半乳糖(8.0%),物质的量比为木糖∶甘露糖∶葡萄糖∶半乳糖=1∶0.28∶1.02∶0.20;SBP-III单糖组成主要有木糖(29.15%)、葡萄糖(62.68%)及半乳糖(8.16%),物质的量比为木糖∶葡萄糖∶半乳糖=1∶2.15∶0.28。
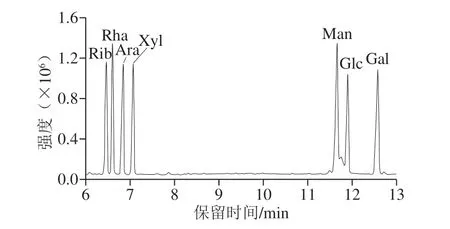
图3 单糖标准品气相色谱图Fig.3 GC chromatogram of mixed standard monosaccharides
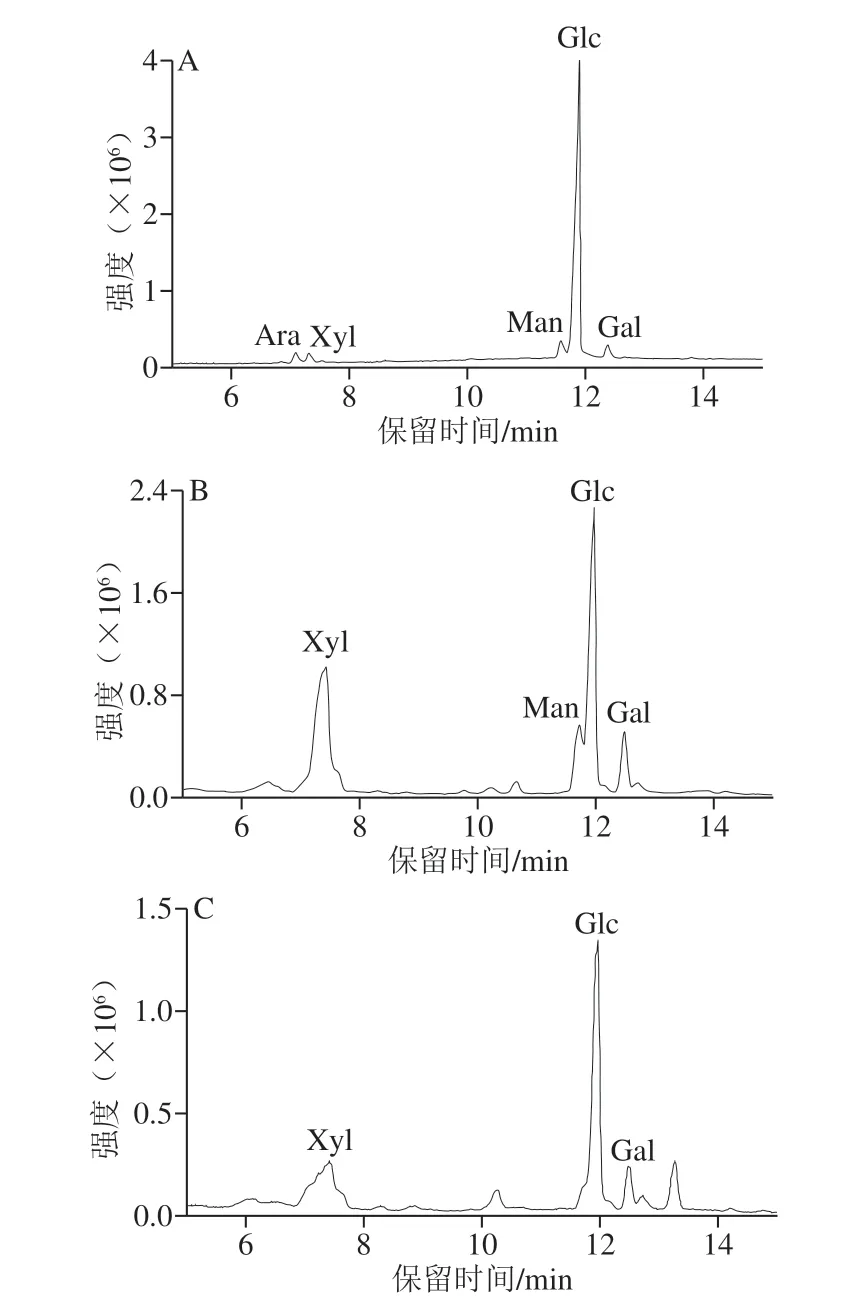
图4 SBP-I(A)、SBP-II(B)、SBP-III(C)的气相色谱图Fig.4 GC chromatograms of SBP-I (A), SBP-II (B) and SBP-III (C)
2.4 SBP体外抗氧化活性结果
2.4.1 DPPH自由基清除活性
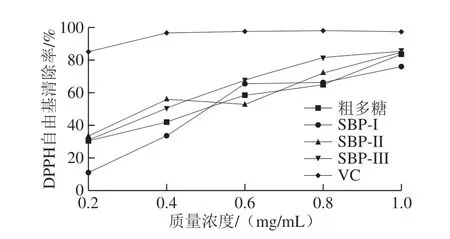
图5 SBP-I、SBP-II、SBP-III及粗多糖对DPPH自由基的清除能力Fig.5 DPPH radical scavenging activities of SBP-I, SBP-II, SBP-III and crude polysaccharides
如图5所示,SBP-I、SBP-II、SBP-III对DPPH自由基的清除能力随质量浓度增加而逐渐升高,SBP-III对自由基清除力略高于其他2 种多糖,当质量浓度达到1 mg/mL时,SBP-III和SBP-II的清除率达到85.19%左右,SBP-I的自由基清除能力在一定质量浓度范围内有小幅度升高,清除率最高为76.21%,但3 种多糖自由基清除能力均小于VC。多糖的抗氧化活性可能与单糖组分、分子大小、结构和构象有关[31]。多糖中的单糖是还原剂,因为它们可以提供氢,氢可以与自由基结合,形成稳定的DPPH-H终止自由基反应。上述结果中的SBP-I、SBPII、SBP-III可能作为供氢剂,与DPPH自由基反应生成更稳定的产物,从而清除DPPH自由基,推测纯化后的多糖可能是清除自由基的主要成分,而粗多糖由于其中含有的复杂成分[32],使得供氢能力减弱,与DPPH自由基结合较少,影响了其抗氧化活性,确切原因尚待进一步研究。
2.4.2 ABTS阳离子自由基清除活性
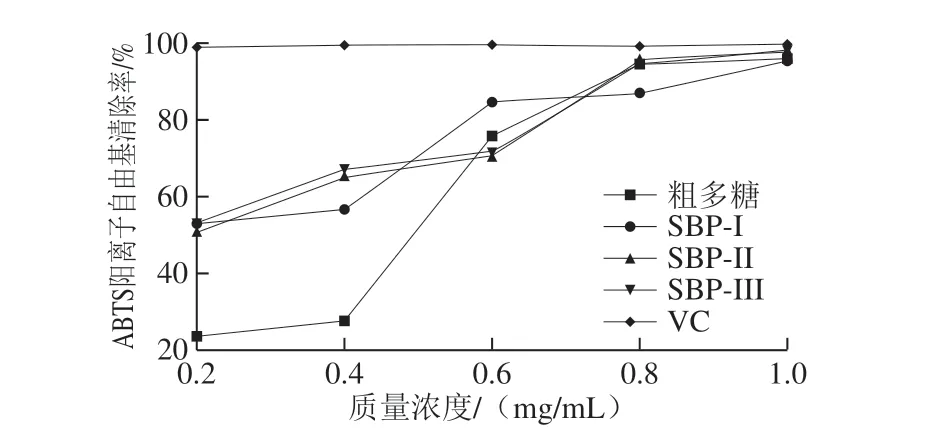
图6 SBP-I、SBP-II、SBP-III及粗多糖对ABTS阳离子自由基的清除能力Fig.6 ABTS cation radical scavenging activities of SBP-I, SBP-II,SBP-III and crude polysaccharides
本实验基于抗氧化剂通过H原子转移的自由基猝灭或通过单电子转移的还原对稳定ABTS阳离子自由基产生清除能力[33]。如图6所示,粗多糖及3 种纯化组分均对ABTS阳离子自由基具有一定的清除能力,且各组分的清除能力均呈现出质量浓度依赖性,当质量浓度达到0.8 mg/mL时,SBP-II、SBP-III的清除率分别为94.3%和95.52%,SBP-I为86.98%,即SBP-III对ABTS阳离子自由基的清除能力最好,其次是SBP-II,SBP-I的清除能力最弱。粗多糖对ABTS阳离子自由基清除率随质量浓度的增大而不断增加,且当质量浓度在0.4~0.6 mg/mL时,清除率迅速增高,质量浓度为0.8 mg/mL时,对ABTS阳离子自由基的清除率逐渐趋于稳定。
2.4.3 还原能力
还原性能通常与还原剂的存在有关,还原剂可以通过破坏自由基链,给出氢原子并发挥抗氧化作用。因此,化合物或提取物的还原能力可能是其抗氧化活性的一个重要指标[34]。如图7所示,VC的还原能力在质量浓度0.2~1.0 mg/mL时迅速增加,当质量浓度为1.0 mg/mL时,SBP-III的还原能力略高于SBP-I、SBP-II,但低于VC,粗多糖还原能力最低,且各组分随着质量浓度的增加,还原能力逐渐增强。有研究表明多糖抗氧化性与其结构有关[31],可能由于酸性多糖SBP-III中含有的—COOH、—OH增大了多糖的抗氧化性[20],而粗多糖分子体积较大且含有复杂成分[35],不利于其跨膜进入生物体内发挥生物活性,即提供氢原子的能力低于SBP-I、SBP-II、SBP-III,使其还原能力减弱。
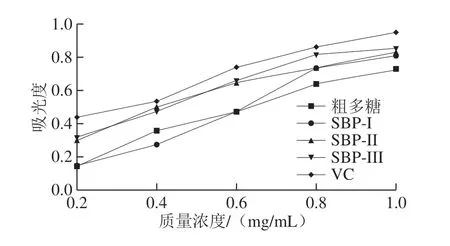
图7 SBP-I、SBP-II、SBP-III及粗多糖还原能力Fig.7 Reduction capacities of SBP-I, SBP-II, SBP-III and crude polysaccharides
3 结 论
沙棘粗多糖经DEAE-52纤维素柱分离纯化后得到3 种组分中性多糖SBP-I和酸性多糖SBP-II、SBP-III,通过单糖组成分析得出3 种多糖主要由木糖、葡萄糖和半乳糖以不同物质的量比构成,其中葡萄糖含量最高,3 种多糖中葡萄糖占比分别为84.65%、40.8%和62.68%,说明3 种多糖均是由葡萄糖为主要成分组成的杂多糖。红外光谱表明3 种多糖均含有糖类化合物的特征峰且推断出SBP-I及SBP-II属于α-构型的多糖;SBP-III属于β-构型的多糖。抗氧化结果表明SBP-I、SBP-II、SBP-III及粗多糖对DPPH自由基和ABTS阳离子自由基均具有一定的清除作用,且随质量浓度的增加清除率逐渐升高,其中SBP-III的清除作用高于SBP-I、SBP-II和粗多糖,还原能力大小依次为:SBP-III>SBP-II>SBP-I>粗多糖。由此可看出酸性多糖SBP-III、SBP-II抗氧化性高于中性多糖SBP-I,推测可能由于酸性多糖中含有—COOH、—OH,增大了多糖的抗氧化性。结果表明SBP作为天然的抗氧化剂,在健康食品的开发和生产中具有一定的研究意义。
