亚牛磺酸对南美白对虾多酚氧化酶活性及酶构象的影响
2021-03-01周雅琪黄佳茵陈美玉葛雨珺胡亚芹
周雅琪,黄佳茵,陈美玉,葛雨珺,李 苑,胡亚芹,*
(1.浙江大学生物系统工程与食品科学学院,馥莉食品研究院,智能食品加工技术与装备国家(地方)联合实验室,农业农村部农产品产后处理重点实验室,农业农村部农产品营养功能评价实验室,浙江省农产品加工技术研究重点实验室,浙江 杭州 310058;2.浙江大学宁波研究院,浙江 杭州 315100)
南美白对虾(Penaeus vannamei)是占全球水产养殖虾产量80%的重要商品虾[1],黑变会严重影响其感官品质和货架期。虾体内酶促褐变的关键酶多酚氧化酶(polyphenoloxidase,PPO)会催化无色酚形成有色醌,再通过非酶促褐变形成不溶性黑色素[2]。传统抑制对虾黑变的方法主要是采用低温和化学保鲜剂,最常用的化学保鲜剂就是亚硫酸盐。亚硫酸盐是无机盐,易分解产生二氧化硫残留在食品中,容易导致食用者发生过敏以及哮喘反应,在美国和欧盟国家已被禁止使用[3]。因此,研究亚硫酸盐替代品,寻求天然、安全、高效的防对虾黑变抑制剂对于保障食品安全、提高对虾的商业效益具有重要意义。目前一些化学和天然的食品保鲜剂已经被研究作为对虾的抗黑变剂,化学合成的如4-己基间苯二酚、阿魏酸、固载二氧化氯,以及石榴提取物、腰果提取物、葡萄籽提取物等天然获得的物质,均可通过抑制PPO活性减缓对虾的黑变[4]。
由于酶的功能与其结构密切相关,因此近年来除研究黑变抑制剂对酶活性的抑制作用,其对酶蛋白高级结构的影响也被深入探究。如Xiong Shangling等[5]通过抑制动力学与分子动力学研究了邻苯三酚对酪氨酸酶活性和结构的抑制作用,Zhou Lei等[6]研究了超声波与苹果酸的协同作用对蘑菇PPO活性和构象的影响,Hridya等[7]研究了花青素3-槐糖苷对PPO的抑制机理及其对苹果酶促褐变的影响,刘琦琦[8]研究了香豆素类物质对PPO的抑制机理及酶构象的影响,这些研究都有助于在分子水平上进一步研究PPO,从而为有效抑制酶活提供思路。
亚牛磺酸(hypotaurine,HTU)作为一种生物保鲜剂而受到关注。它是生物体内广泛存在的一种天然产物,可以从贻贝、牡蛎、文蛤、章鱼、鱿鱼等海洋生物中提取获得,也是人体内半胱氨酸代谢为牛磺酸的中间体。Schulbach等[9]通过对蓝贻贝中发现的酶促褐变的抑制剂进行液相色谱和质谱鉴定,率先发现了HTU的抗黑变效果。Zhang Ying等[10]研究了HTU对桃保鲜效果的影响,发现HTU可以延缓贮藏期间桃果实的成熟。由于HTU具有PPO的抑制活性,目前在果蔬防黑保鲜领域中已经被使用,如HTU能明显抑制桃[11]、山药[12]等的褐变,显示出了良好的护色保鲜效果。HTU在水产品中广泛存在,且其在人体内终产物为牛磺酸,具有方便获得和无毒无害的优点,之前研究也表明其对果蔬的抗酶促褐变具有很好的效果,但在水产领域特别是对南美白对虾PPO活性的抑制及酶结构的影响鲜见报道,对其抗黑变效果和机制也尚不明确。本研究旨在对南美白对虾PPO进行分离纯化,研究HTU对其活性和结构的影响,为从分子水平上进一步研究南美白对虾PPO抑制剂的安全高效使用提供参考依据,同时也为将HTU应用于南美白对虾的保鲜提供理论支撑。
1 材料与方法
1.1 材料与试剂
新鲜的南美白对虾购于浙江杭州骆家庄农贸市场,其养殖产地为浙江舟山,挑选无病害,有活力质量大小为(12f 1)g左右的对虾,经保氧运回实验室并在冰中猝死后放于-80 ℃冰箱备用;HTU 美国Sigma公司。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)变性丙烯酰胺凝胶快速制备试剂盒、5×蛋白质加样缓冲液、Real Band蛋白预染Marker、高灵敏快速考马斯亮蓝染色试剂盒、8-苯胺-1-萘磺酸(8-(phenylamino)naphthalene-1-sulfonic acid,ANS) 生工生物工程(上海)股份有限公司;左旋多巴(levodopa,L-DOPA)、SDS、十二烷基聚乙二醇醚(Brij35)、甘氨酸、磷酸氢二钠、磷酸二氢钠等均为分析纯。
1.2 仪器与设备
UV-2550紫外分光光度计 日本岛津公司;EPS300电泳仪 上海天能科技有限公司;J-1500型高性能圆二色光谱仪 佰泰科技有限公司;Cary Eclipse荧光分光光度计 赛默飞世尔科技有限公司;TGL20M型低温冷冻离心机 湖南凯达科学仪器有限公司。
1.3 方法
1.3.1 PPO的粗提取和活性测定
根据Simpson等[13]的方法,并略作修改。采用Lowry等[14]的方法测定粗酶的蛋白浓度。
1.3.2 HTU对PPO处理前后最大吸收波长的测定
在离心管中加入0.4 mL的粗酶液,1.0 mL浓度为15 mmol/L的L-DOPA以及1.6 mL 0.05 mol/L pH 6.5的磷酸盐缓冲液。37 ℃水浴反应3 min,用紫外分光光度计在300~700 nm波长范围内每隔2 min进行扫描直至10 min,确定产物的最大吸收波长。再按上述方法,测定经质量浓度分别为1、5、10、15、20 g/L的HTU溶液处理后酶液的波长,检测其产物吸收峰。
1.3.3 HTU对PPO活性抑制率的测定
将100 μL不同质量浓度的HTU溶液与100 μL PPO粗提取物混合,在室温下反应30 min。将400 μL 0.05 mol/L pH 6.0的磷酸盐缓冲液、100 μL去离子水以及600 μL 15 mmol/LL-DOPA的溶液加入引发反应,在37 ℃反应3 min后通过紫外分光光度计记录475 nm波长处的吸光度的变化。酶活性定义:每毫升酶液每分钟在475 nm波长下吸光度增加0.001为1 U。通过从反应混合物中分别排除底物和酶制备酶和底物空白,并使用去离子水代替。用去离子水代替HTU作为对照,以相同的方式进行。PPO抑制活性用抑制率表示,计算公式如下:
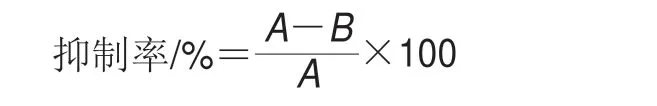
式中:A为对照的PPO活性;B为加入HTU后的PPO活性。
1.3.4 HTU对PPO的抑制机理
配制不同质量浓度的HTU溶液,在0.05 mol/L pH 6.5的磷酸盐缓冲液中固定加入0.1 mL HTU,再加入不同量的酶液,混合30 min后,加入1.0 mL 15 mmol/LL-DOPA,每隔30 s记录一次475 nm波长处吸光度,共测定5 min,计算酶促反应速率代表酶活性。以HTU作用后的酶活性对酶浓度作图,测定不同HTU质量浓度下,酶浓度增加时酶促反应速率的变化。
1.3.5 HTU对PPO的抑制类型与抑制常数的测定
配制不同质量浓度的HTU溶液,在离心管中加入1.6 mL 0.05 mol/L pH 6.5的磷酸盐缓冲液与0.3 mL酶液,以及0.1 mL不同质量浓度的HTU,混合30 min后加入1.0 mL不同浓度(2、4、6、8、10 mmol/L)的L-DOPA,计算酶促反应速率。通过以L-DOPA浓度的倒数为横轴,酶促反应速率的倒数为纵轴,进行Lineweaver-Burk双倒数作图,判断HTU的抑制类型。
1.3.6 SDS-PAGE测定
按照Laemmli[15]方法对南美白对虾中PPO粗提物进行SDS-PAGE测定。将提取物与不同质量浓度的HTU溶液反应30 min后,与5×蛋白质加样缓冲液以1∶1的体积比混合。制备6%分离胶和5%浓缩胶,样品和Marker的加样量分别为20 μL和5 μL。采用恒压电源先80 V跑0.5 h,再120 V进行约1.5 h。电泳结束后,将凝胶浸泡在考马斯亮蓝R-250中染色,用25%甲醇和10%乙酸溶液进行脱色。选择Real Band蛋白Marker估计蛋白的表观分子质量。
1.3.7 圆二色谱的测定
参考Yi Jianyong等[16]的方法并作修改,取200 μL PPO样品及与不同质量浓度的HTU溶液反应后的PPO置于样品池后立即扫描,扫描波长为280~190 nm,扫描速度为50 nm/min,带宽1 nm,在室温下重复扫描3 次,取平均值。圆二色谱数据用平均椭圆率表示,单位为(mdegg cm2)/dmol。PPO质量浓度为0.2 mg/mL,采用Dichroweb网站的SELCON 3算法计算PPO二级结构的含量。
1.3.8 表面疏水性的测定
参考Kobayashi等[17]方法并略作修改,取不同质量浓度HTU溶液处理过的PPO样品4 mL,加入8 mmol/L的ANS溶液20 μL,置于4 ℃黑暗处15 min。在激发波长374 nm、发射波长范围420~600 nm、缝宽5 nm处测定荧光强度。以荧光强度和蛋白浓度作图,曲线的初始斜率表示为表面疏水性指数。
1.3.9 荧光光度的测定
将不同质量浓度HTU溶液处理过的PPO样品放入荧光比色皿中,样品的蛋白质质量浓度为0.3 mg/mL,仪器激发波长为280 nm,扫描范围为300~400 nm,激发和发射缝均为5 nm,扫描速率为1 200 nm/min。
1.4 统计分析
实验均进行3 次平行后取平均值,并计算标准偏差。对于所有参数,通过方差分析(ANOVA)确定差异显著性,P<0.05,差异显著。使用Duncan的多范围测试测定平均值的差异。数据之间的相关性由Pearson相关系数进行判断。该分析由SPSS 21版软件执行。
2 结果与分析
2.1 南美白对虾PPO的纯化结果
通过对南美白对虾的头胸部进行研磨、均质、离心、盐析和透析得到对虾PPO粗酶液。王凌燕[18]研究了不同饱和度的盐析方法下PPO的纯化结果,发现用40%~75%饱和度的(NH4)2SO4进行蛋白盐析沉淀是较好的PPO提纯方法,因此本实验采用40%的(NH4)2SO4进行纯化,通过对粗酶液进行酶活性和蛋白浓度测定,得到酶活性为182.25 U/mL、蛋白质量浓度为5.306 mg/mL、比活力为34.45 U/mg的PPO粗酶液用于后续酶活性实验的测定。其中磷酸盐提取液中含有的Brij-35是一种可以提取膜蛋白的非离子表面活性剂,PPO作为一种含铜离子的膜蛋白酶,使用Brij-35可以提高得率[19]。
2.2 HTU对PPO活性抑制作用分析

图1 HTU对PPO的抑制动力学分析Fig.1 Kinetics of inhibition of PPO by HTU
通过紫外分光光度计研究HTU对PPO活性的影响,图1A是未加抑制剂时,不同时间下PPO与酶底物L-DOPA反应的紫外光谱图,由于PPO会催化L-DOPA形成多巴醌,进而聚合形成黑色物质,所以醌类物质在可见光区有一定的吸收,可以发现在495 nm波长处形成了一个特征峰,因此推测这可能是酶促反应过程中形成的醌类物质,且反应时间越长,形成的醌类物质越多。图1B、C分别是加入了HTU抑制剂后的光谱图和光度图,随着抑制剂的加入,延缓了495 nm波长处特征峰的上升,且质量浓度越大上升的越慢。图1D是HTU对PPO的活性抑制率,随着HTU质量浓度的增加,PPO活性的抑制率在前期呈现较慢的上升趋势,当质量浓度在10~20 g/L时上升较快,其抑制率最高达到79.38%,其最大半数抑制浓度(half-maximal inhibitory concentration,IC50)值为16.09 g/L。
综上所述,HTU可以抑制PPO活性,且质量浓度越高其抑制能力越强,推测其原因一可能是HTU与醌类物质反应形成了硫-醌复合物,阻碍了酶促反应的进行,另一种推测是HTU作为一种强还原剂,将形成的醌类物质还原成酚,研究同时表明硫原子在抑制PPO活性中起到了极其重要的作用[20]。因此HTU对PPO活性的抑制能力很可能是减缓冷藏期间南美白对虾中由PPO引起黑变现象的主要原因。
2.3 HTU对PPO的抑制作用
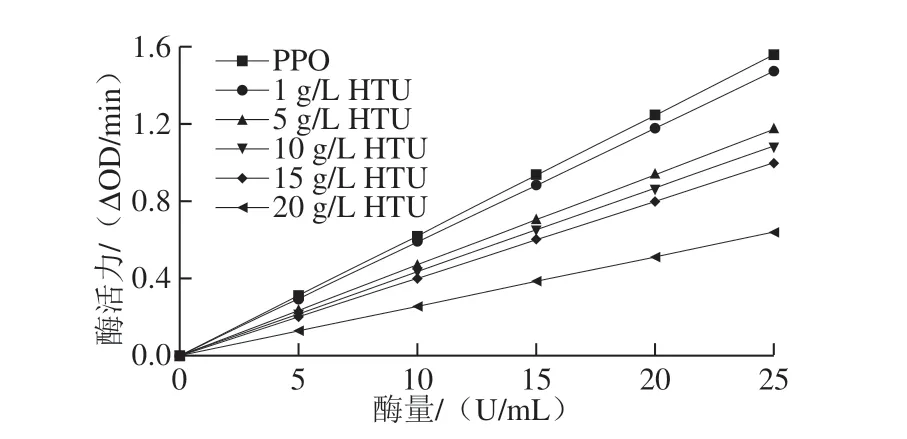
图2 在不同质量浓度HTU下PPO活性和酶量的关系Fig.2 Relationship between PPO activity and its concentration in the presence of different concentrations of HTU
如图2所示,HTU质量浓度越大,直线的斜率越小,表明其酶促反应速率下降,且每条直线都穿过原点,推测HTU可能并未与PPO形成共价键,而是存在非共价的分子间相互作用。HTU与PPO的可逆结合抑制了其活性,酶量没有减少,但酶活性下降。该结果表明HTU可能是PPO的可逆抑制剂,且此现象与用芹菜素[21]、槲皮素[22]对酪氨酸酶的抑制趋势一致。
用Lineweaver-Burk图确定HTU对PPO活性的抑制类型,如图3所示,观察到垂直轴截距(1/Vmax)和水平轴截距(-1/Km)的变化,5 条直线相交于Y轴上的一点,计算最大反应速率(Vmax)和米氏常数(Km),可以发现Vmax不变(2 mmol/(Lg min)),Km随着HTU质量浓度的增大而增大,因此推测HTU是一种竞争性抑制剂。HTU对酶活性的影响可能是通过与酶进行结合,而不与酶-底物的络合物结合,根据HTU质量浓度与米氏方程斜率的二次作图,可得到HTU对PPO的抑制常数KI为0.445 mmol/L。研究表明曲酸、肉桂酸、含羞草素等都是PPO的竞争性抑制剂,可以和底物竞争酶的结合位点,阻止底物和酶的结合,从而抑制酶促反应的进行,若是增加底物的浓度,则可以增大与酶活性位点结合的概率,从而缓解抑制剂对酶的抑制作用[23]。
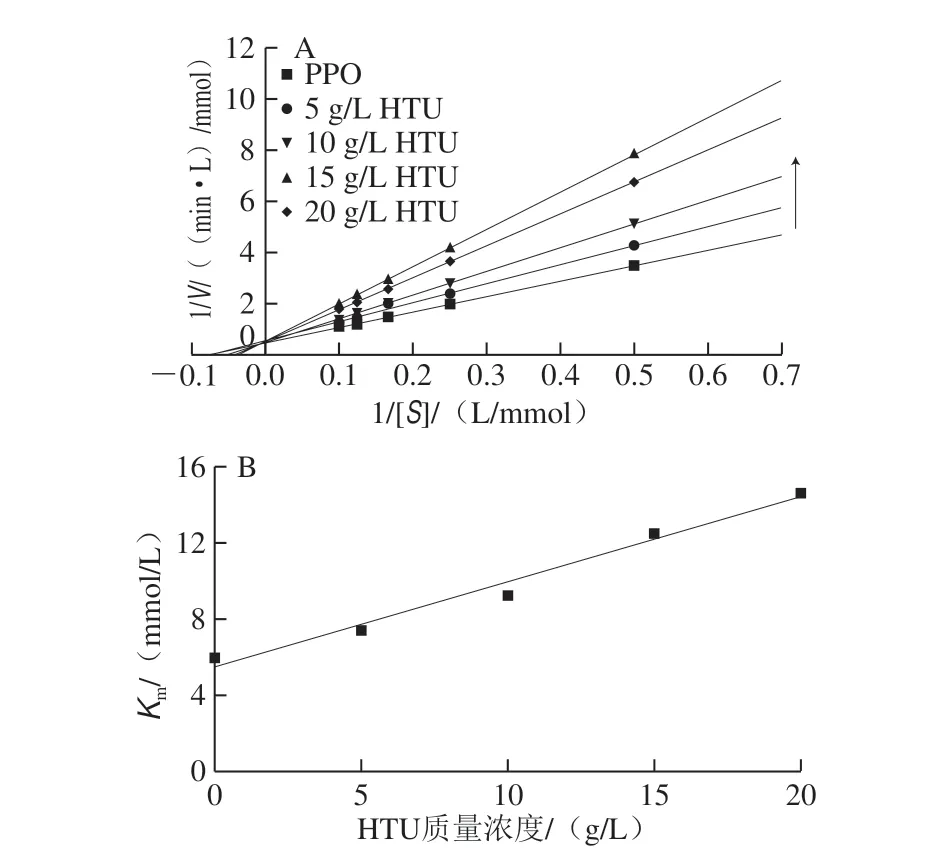
图3 HTU对PPO抑制作用的Lineweaver-Burk曲线(A)和米氏常数(B)Fig.3 Lineweaver-Burk curve (A) and inhibition constant (B) of HTU against PPO
2.4 SDS-PAGE分析

图4 SDS-PAGE分析Fig.4 SDS-PAGE analysis
如图4所示,通过对凝胶进行考马斯亮蓝染色,发现在凝胶上出现了PPO的单一蛋白条带,通过迁移率对比,其分子质量约为200 kDa,和Manheem等[24]测定的表观分子质量一致。据报道来自不同虾的PPO具有不同的异构体,分子质量也会有所不同,例如深水粉红虾的PPO分子质量为500 kDa和200 kDa,而白虾的分子质量为20 kDa和25 kDa[25]。图中经过不同质量浓度HTU处理后PPO的条带数目与位置并未发生明显变化,推测HTU可能不是通过破坏PPO蛋白分子质量和电泳特性而影响酶活力,该结果与4-羟基香豆素处理PPO时的电泳结果一致[8]。
2.5 圆二色谱结果分析

表1 不同质量浓度HTU处理后对PPO二级结构比例的影响Table 1 Influence of different concentrations of HTU on secondary structure contents of PPO
酶结构的轻微变化都可能导致其功能和性质发生改变,本实验采用圆二色谱检测蛋白质二级结构的变化。如表1所示,利用Dichroweb网站计算了样品中各结构比例,PPO的二级结构主要由25.41%的α-螺旋和41.92%的无规卷曲组成。随着HTU质量浓度的增大,PPO的α-螺旋和β-折叠比例出现下降,而β-转角与无规卷曲的比例上升。有研究表明α-螺旋是通过肽链的羰基氧和氨基氢之间的分子内氢键维持蛋白结构的稳定[26],而α-螺旋比例的下降说明其结构发生了变化。推测可能是HTU的加入,诱导了PPO蛋白的展开,使得α-螺旋的氢键遭到破坏,并促使α-螺旋和β-折叠向β-转角和无规卷曲进行转变,导致疏水基团的暴露,使得酶的催化活性降低,且HTU的质量浓度越高,蛋白的结构破坏的越明显。Anantharaman等[27]研究了类胡萝卜素对酪氨酸酶构象的影响,也发现酶的α-螺旋比例降低导致疏水性增强引起酶活性变化。吕艳芳等[28]在研究曲酸对南美白对虾PPO构象的影响的实验中也得到了相似的结论。因此推测HTU的加入,可能导致PPO的二级结构发生了改变,从而引起了酶活性的降低。
2.6 表面疏水性分析
蛋白质的表面疏水性是表征蛋白构象变化的重要指标,它能够反映蛋白质表面疏水性氨基酸残基的分布情况,而PPO作为一种酶蛋白,其表面疏水性的变化可能会引起蛋白结构的变化,进而导致酶活性发生改变。如图5所示,相比对照组的PPO,添加HTU能够显著增加PPO的表面疏水性(P<0.05)。随着HTU质量浓度的增大,蛋白的表面疏水性在前期呈现逐渐上升的趋势,当HTU质量浓度为15 g/L时,其上升程度有所减缓。天然酶蛋白的疏水性残基一般集中在螺旋的核心,因此PPO表面疏水性的增加表明HTU的处理导致了PPO蛋白结构的展开,使得疏水性氨基酸暴露于蛋白的表面,酶分子之间聚集的程度下降,从而影响PPO的活性。而后续表面疏水性的上升程度减缓可能是由于更多的酶分子的疏水性基团暴露,酶分子之间由于疏水相互作用而发生聚集,从而导致了疏水性的上升减慢。Jia Na等[29]在研究芦丁对蛋白的疏水性影响中也得出了类似的结论,同时这也与上述圆二色谱的结果相一致。综上所述,HTU的加入能够提高PPO的表面疏水性,这可能影响PPO的二级或三级结构,从而影响酶活性。

图5 HTU对PPO表面疏水性的影响Fig.5 Effect of HTU on surface hydrophobicity of PPO
2.7 内源荧光光谱分析
当激发波长为280 nm时,蛋白质中的色氨酸、酪氨酸残基能够发射荧光,因此对于蛋白质周围微环境的变化非常敏感,当其他分子与蛋白质相互作用时,蛋白质的这些氨基酸残基的内源荧光强度也会受到影响,从而可以通过荧光强度的变化监测蛋白质构象的变化[30]。
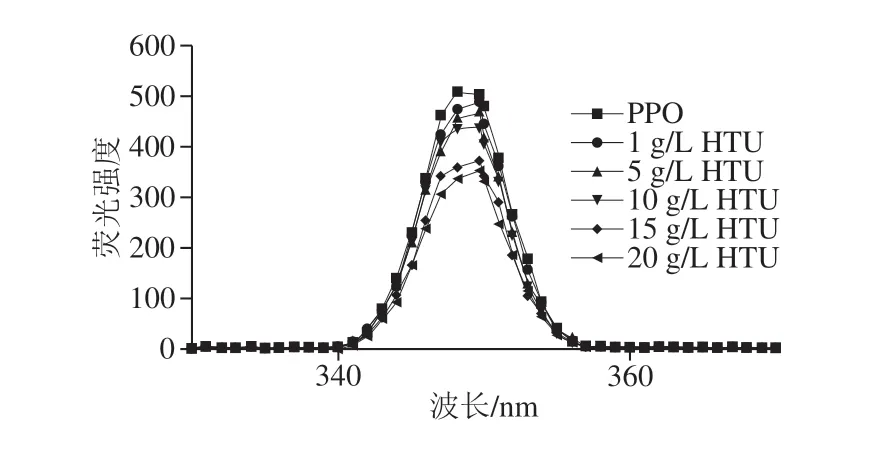
图6 HTU对PPO內源荧光光谱的影响Fig.6 Effect of HTU on endogenous fluorescence spectrum of PPO
如图6所示,未加入HTU时,PPO具有较大的荧光强度和较短的最大荧光发射波长(λmax),说明色氨酸等氨基酸残基位于蛋白质的核心,酶蛋白处于折叠状态。HTU的添加以质量浓度依赖的方式降低了PPO内源荧光强度,当HTU质量浓度为20 g/L时,PPO的内源荧光强度比原酶降低了29.85%。同时随着HTU质量浓度的增加,PPO的λmax显示出了348.2~349.7 nm轻微红移。这表明HTU与PPO相互作用后,蛋白质发生解折叠,导致色氨酸等疏水性氨基酸残基位于蛋白质的表面,暴露于亲水环境中,使得氨基酸残基周围环境的极性增强,因此HTU的加入降低了PPO的荧光强度并使λmax发生红移[16]。Liu Wei等[31]研究表明柠檬酸会导致蘑菇酪氨酸酶发生荧光猝灭,最大荧光发射波长从341 nm红移到344 nm。方志超等[32]对乳酸处理后的蘑菇酪氨酸酶构象进行了研究,发现酶的最大峰值从346 nm移动到353 nm。这些结论与HTU处理后PPO内源荧光强度的改变类似,同时上述蛋白表面疏水性的增加也能证明PPO发生了解折叠,导致了疏水性基团的暴露。因此可以推测HTU可能诱导PPO分子构象发生部分去折叠,猝灭了其固有荧光,导致酶的最大发射波长发生红移,从而使得酶的三级结构发生了变化,同时酶活性也随之下降,表明酶构象的变化可能影响了酶活性,两者之间存在一定的相关性。
3 结 论
对南美白对虾进行分离纯化,获得了比活力为34.45 U/mg(182.25 U/mL)的PPO粗提液。研究表明HTU质量浓度与PPO抑制活性呈正相关,说明HTU是PPO活性的有效抑制剂,当HTU质量浓度为20 g/L时,其抑制率最高达到79.38%,IC50值为16.09 g/L。HTU对PPO活性的抑制属于竞争性抑制,其抑制常数KI为0.445 mmol/L。随着HTU的加入,PPO分子质量没有发生显著变化,圆二色谱结果表明酶的α-螺旋与β-折叠含量降低,而β-转角和无规卷曲的含量略有增多,表明酶蛋白分子展开,导致了疏水性氨基酸残基的暴露。表面疏水性的结果也证实了PPO的疏水性随着HTU质量浓度的增加而增强。内源荧光光谱的结果说明HTU会导致酶发生荧光猝灭,最大发射波长发生红移。这些结果均说明HTU与PPO结合后,可能通过影响酶空间结果导致酶活性发生变化。
