腔镜在下肢筋膜外及筋膜下穿支静脉离断术中的应用
2021-02-27王志青孙宝华
王志青,孙宝华
(济南市第四人民医院血管外科,山东 济南,250031)
目前在临床上针对下肢静脉功能不全引起的溃疡多通过结扎反流的穿支静脉解决。传统手术包括选择性及非选择性的穿支静脉结扎术,可于筋膜外进行,如Bassi手术[1],亦可选择筋膜下进行,如经典的Linton[2]手术及Cockett[1]手术等,但均有较多的并发症而被逐渐废弃。近年,热消融技术及泡沫硬化剂技术均能达到良好的微创效果,但似乎远期再通率较高[3]。理想的手术应在深筋膜水平妥善处理穿支静脉且复发率低,并发症少。因此由Hauer[4]提出的腔镜筋膜下穿支静脉离断术(subfascial endoscopic perforator surgery,SEPS)仍有不可替代的地位。腔镜筋膜外层面离断穿支静脉的手术则鲜有报道[5]。本文现就我院近两年开展的腔镜筋膜外穿支静脉离断术(epifascial laparoscopic perforator surgery,ELPS)与SEPS进行初步比较,并探讨其操作技巧。
1 资料与方法
1.1 临床资料 收集2017年1月至2019年7月我院收治的下肢静脉疾病患者,经系统病史询问及体格检查,按照CEAP分级选取C4~C6级患者,测踝肱指数均>0.8,并排除深静脉血栓后综合征、髂静脉压迫综合征等深静脉病变情况,排除双下肢病变患者。按入组顺序进行编号,单双号分别为SEPS组与ELPS组。共选取40例患者、40条肢体,男27例,女13例;C4级19例,C5级14例,C6级7例。两组患者临床资料见表1。术前均行超声多普勒检查,采用Valsalva实验及小腿挤压释放实验判断并记录深浅静脉反流及穿支静脉功能不全的情况,直径大于2 mm或存在往返血流为需要处理的标准,将该穿支静脉于皮肤表面予以标记。36例患者小腿有明显的静脉曲张、脂质硬化或溃疡,4例为大隐静脉术后复发合并溃疡患者。术前均采用静脉临床严重程度评分表(venous clinical severity score,VCSS)[6]进行评分并登记。该研究已通过医院伦理委员会批准,患者均知晓手术方式并签署手术知情同意书。
1.2 手术方法 采用神经阻滞或腰硬联合麻醉。患肢髋关节屈曲、外展并外旋,膝关节屈曲135度,垫高踝部及膝关节处,暴露小腿区域。两孔法施术,第一个套管(A)一般选择在胫骨结节以远10 cm、胫骨旁开约5 cm处,以最大限度保证器械的活动度;第二个套管(B)放置在A套管下后方5 cm处,A套管置入腔镜。有时为保证充分暴露,会将两切口尽量向远端平移,如术前标记的穿支静脉处,切开同时处理该处的穿支静脉。以不切开有病变的皮肤为原则。为方便处理后方穿支静脉,A、B套管可随时在观察套管与操作套管之间切换。SEPS组切口直接显露深筋膜并切开,手指分离筋膜下间隙后置入套管,进一步采用镜推法或卵圆钳轻柔扩展间隙,建立气腹,压力维持在12~15 mmHg。ELPS组切口显露深筋膜,手指扩张筋膜外间隙。该间隙位于浅筋膜深层与深筋膜之间,易于分离。压力维持在8~15 mmHg。该间隙发生粘连时可用超声刀缓慢分离,宁深勿浅。穿支静脉用电凝或超声刀切断。并将处理的穿支静脉数量进行记录。合并大、小隐静脉曲张的患者进行相应的剥脱或激光闭合手术。术前存在溃疡时先进行创面清创,覆盖无菌敷料并用手术薄膜覆盖后进行手术。术毕吸除积血,必要时冲洗创面,排除CO2,缝合筋膜及切口,用弹性绷带加压包扎患肢。术后2~5 d切口换药出院,更换为中级压力的弹力袜治疗6个月。溃疡患者定期于门诊处理创面,患者随访至术后6个月进行VCSS评分,并于术后1年、2年分别电话随访一次,记录有无溃疡复发情况。
1.3 疗效比较 对比两组患者术前标记的穿支数量及术中穿支静脉处理情况,术前、术后两组VCSS评分及溃疡愈合时间、溃疡复发率、术中出血、术后麻木、皮肤损伤、肌肉损伤、皮下气肿、深静脉血栓等指标。

2 结 果
2.1 两组患者临床资料的比较 术前两组患者在年龄、性别、CEAP分级、VCSS评分及穿支静脉的检出数量方面差异无统计学意义。见表1。SEPS组术中镜下可见穿支静脉位于肌肉与筋膜之间,走行较垂直(图1)。ELPS组术中镜下见穿支静脉位于深浅筋膜之间,走行扭曲(图2)。通过电凝、结扎等方式离断穿支静脉。见图3、图4。

表1 两组患者一般资料的比较

图1 SEPS镜下所见(箭头处为穿支静脉) 图2 ELPS镜下所见(箭头示穿支静脉)
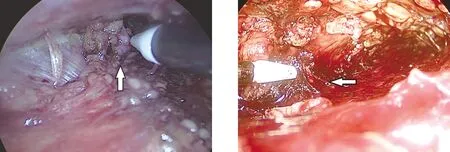
图3 SEPS术中电凝离断穿支静脉(箭头示穿支静脉) 图4 ELPS术中电凝离断穿支静脉(箭头示穿支静脉)
2.2 两组术中情况的比较 SEPS组术前标记的穿支静脉中3支术中未发现,与术前相比差异无统计学意义(P=0.379)。ELPS组则发现更多的穿支静脉,与术前相比差异有统计学意义(P=0.012)。两组术中发现的穿支静脉数量差异有统计学意义。SEPS组手术时间长于ELPS组(P=0.001)。两组患者术后VCSS评分、溃疡平均愈合时间差异无统计学意义。见表2。

表2 两组患者手术相关指标的比较
2.3 术后并发症 ELPS组中1例患者炎症渗血较多,但无影响手术操作的出血出现。SEPS组术中出血影响手术操作3例,经压迫止血,增加戳孔,寻找出血血管予以超声刀或电凝止血后完成手术;发生肌肉损伤2例,为早期手术患者;发生术后足底麻木2例。ELPS组术后小腿麻木1例,症状均在随访过程中消失;发生皮肤损伤1例,造成皮肤溃疡延迟愈合至术后12周;皮下气肿2例,术后很快吸收;小腿肌间静脉血栓形成1例,术后抗凝治疗好转。两组均有2例患者随访过程中发生溃疡复发。
3 讨 论
在下肢静脉系统中,穿支静脉因沟通深浅静脉系统的特殊地位在慢性静脉功能不全的发病过程中发挥重要作用。其静脉瓣膜在正常状态下只允许血流由浅静脉流向深静脉。而瓣膜功能一旦丧失,血液则由压力较大的深静脉反流至浅静脉,造成浅静脉扩张、曲张,皮肤色素沉着、溃疡等一系列改变。CEAP分级与下肢穿支静脉的数量、直径、血流方向有明显相关性,C4级以上一般存在穿支功能不全。穿支静脉的功能丧失在慢性静脉功能不全的病理生理学中发挥重要作用[7]。临床上初次尝试对穿支静脉进行结扎的是Linton手术[2],继而是经多普勒定位及通过小的筋膜切口行穿支静脉结扎,但均可能需要在不健康的皮肤上进行切开从而导致术后切口并发症较多。得益于内镜技术的发展,SEPS术式应运而生,其最早由Hauer[4]报道,手术在深筋膜下与肌肉之间的间隙进行,有效性、安全性已得到多个临床中心的证实[8]。
ELPS的操作均在深筋膜外与浅筋膜深层的间隙进行。该区域是一潜在间隙,易于分离,理论上位于大隐静脉深层。穿支在该间隙中的走行不像筋膜下间隙那样基本垂直于筋膜,而是走行各异。此技术最早由胡三元[5]团队提出并实施。但在国内外文献检索中鲜有类似报道。我们在借鉴该技术的基础上进行了自己的探索,病例有限,但也得出一些有意义的数据。实践过程中发现ELPS也有其优势。虽然目前也有采用热消融及硬化剂技术处理穿支静脉的报道,但由于其特殊的解剖位置及生理作用,这些微创技术似乎均无法达到手术的效果[3]。
本组患者术前均经多普勒超声定位标记并计数预计切口以下部位的穿支静脉数量,与术中所发现的穿支静脉对比。SEPS组略少于术前标记数量,3条术前标记的穿支静脉SEPS术中未发现;而ELPS组发现的穿支数量多于术前定位;两组相比差异有统计学意义。我们分析这与两者所走行的层面不同有关。ELPS术中镜下所见的连接深筋膜与浅层组织的血管均被认定为穿支静脉,但并不能确定所有被认定的穿支均是实际意义上的穿支,不排除浅静脉交通支的存在。此外,直接连接大隐静脉与深静脉的穿支静脉也可经该间隙离断。而SEPS则不存在这个问题。另一方面与SEPS术中特有的解剖学层面有关。临床上有重要意义的穿支主要分布在小腿中下段内侧的CockettⅡ/Ⅲ组,也就是我们需重点处理的穿支静脉。其与大隐静脉不直接相通,而是沟通胫后静脉与大隐静脉的属支或后副隐静脉。而其中62%的穿支走行在小腿后骨筋膜鞘的浅鞘中,其余则经深鞘穿过胫骨旁深筋膜直接与浅静脉沟通,而不经过浅鞘。如果SEPS术中未切开深浅鞘之间的筋膜膈,可能造成穿支遗漏[9]。这也可能是早期SEPS手术时间偏长及遗漏穿支静脉的原因之一。部分患者遗漏少量穿支静脉,但术前标记的直径3 mm以上的穿支静脉均妥善处理。虽然未发现有统计学差异的复发表现,但在疾病的发展过程中遗漏的穿支可能进一步恶化,从而引起溃疡复发。两组在术后溃疡愈合时间、VCSS评分及复发率方面差异无统计学意义。
有报道指出SEPS术中约有9%的出血率[10]。因穿支静脉管壁较薄,并在筋膜下一般为垂直走行,因此SEPS术中因扩张筋膜下间隙,可能造成穿支静脉撕裂出血,甚至不得不终止手术。本组3例术中出血均为早期病例,因缺乏经验,推进镜头扩大间隙的过程中造成静脉撕裂出血。而在ELPS术中则无影响手术的出血病例。这与其走行较浅有关,即使有出血也可经皮轻易控制。再者穿支静脉在浅筋膜中的走行多有一定的可伸展性,在扩大间隙的过程中,穿支静脉可被拉直,从而更容易辨认。
ELPS组早期发生1例皮肤坏死,该患者因同时剥脱脂质硬化并色素沉着部位的大隐静脉,加上筋膜外手术造成皮下组织进一步破坏,沿大隐静脉走行出现皮肤坏死,愈合延迟至术后12周。另一个重要的原因是,病变皮肤区的大隐静脉剥脱会造成一定程度的皮下组织空虚、积血及继发感染,加重皮肤损伤。使用超声刀及悬空电凝操作可在一定程度上避免皮肤的热损伤[9,11-12]。此外,术中皮下组织致密、炎症粘连是手术困难的因素之一,尤其ELPS术式。炎症也会加重术后皮肤相关并发症。因此术前适当时间的保守治疗是关键。我们在后续的病例中加强术前护理,并对膝下无明显曲张的大隐静脉主干不予特殊处理,未再发生类似情况,而只处理膝上大隐静脉主干也是目前所认可的。本研究中,ELPS组因走行在深筋膜外,无胫后神经、肌肉损伤发生,但发生1例隐神经损伤;而SPES组发生2例胫后神经损伤,表现为足底内侧麻木感。文献报道,神经损伤的患者足底麻木症状有一直持续存在的可能[10,12]。幸运的是本组中2例患者于术后数周内症状恢复,考虑为神经的轻度损伤。我们的经验是在处理靠近远端的穿支静脉时,尽量选择双极电凝或超声刀操作,以减少热损伤。因此处操作空间明显变小,且神经血管组织无肌肉覆盖,不当操作容易造成组织损伤。SEPS组1例肌肉撕裂伤为穿刺第二个套管时进入过深层面所致,另1例为术中器械操作导致损伤,这两例同样是早期病例。轻柔操作可尽量避免此类并发症的发生。
早期SEPS需要使用驱血带以创造无血视野、防止CO2栓塞,压力一般维持在30 mmHg。目前大多数应用无驱血带技术,采用螺纹套管防止漏气,压力控制在10 mmHg左右可获得良好视野[13]。本研究中均采用两孔法施术,选用螺纹套管以防止移动增加稳定性,并在低压力下(8~15 mmHg)完成。ELPS组发生2例皮下气肿,术后数小时内消失,未遗留后遗症。我们认为同样条件下,ELPS组可能需要更小的压力,尤其皮下组织不是特别紧密的病例,行ELPS可适当降低CO2压力,从而防止皮下气肿的发生。
不管是SEPS抑或ELPS,均能妥善处理病变的穿支静脉,术后效果相当。而ELPS似乎能发现并处理更多的穿支静脉。手术技巧方面,体位需要髋、膝关节的屈曲,并充分垫高,不适当的体位严重影响手术操作,并可能造成组织损伤。手术间隙的建立至关重要。SEPS需切开小腿后方深浅筋膜鞘之间的隔膜,以免遗漏重要的穿支静脉。术前超声标记穿支静脉穿过深筋膜的位置尤其重要;开放手术中则无需严格要求,穿支静脉的准确定位在ELPS术中具有重要意义。电凝及超声刀均有使用,两者无显著差异,但在防止出血、减少损伤及易用性方面超声刀更具优势。一旦发生出血,先予以压迫止血,再更换吸引装置并增加戳孔以确保手术成功。ELPS手术操作相对容易,适合初学者掌握。术后虽有1例肌间静脉血栓形成,但经抗凝治疗好转,无明显后遗症。电凝操作使穿支静脉迅速闭合并血栓化,因此术后抗凝治疗在预防深静脉血栓形成方面具有重要意义。
综上所述,我们认为在保证围手术期管理及规范操作的前提下,ELPS更易操作,能发现更多的穿支静脉,对术后患者评分及溃疡愈合无不良影响,可用来进行下肢静脉功能不全的穿支静脉离断。不足之处是样本数量有限,对其疗效及并发症的进一步探索仍需大样本的长期随访研究。
