核酸混样检测中假反应性的原因分析和质量控制
2021-02-26张龙穆袁欣杨忠思
张龙穆,袁欣,杨忠思*
(1.青岛市中心血站,山东 青岛 266000;2.青岛大学附属医院,山东 青岛 266000)
0 引言
核酸检测(nucleic acid amplification test,NAT)技术因检测灵敏度高、特异性强,极大地降低输血传播病毒的残余危险度[1,2],欧美地区等发达国家从上世纪90年代开始逐渐将NAT技术应用到血液筛查中[3]。2016年开始NAT已全面应用于国内献血者血液标本的筛查[4],为进一步推进核酸检测,规范开展核酸检测后献血者传染病筛查的技术和流程,国家卫计委颁布了《血站技术操作规程(2019版)》[5]。但国内采供血系统NAT检测人员相对较少,日常工作忙碌而繁琐,在试验过程中可能更注重结果的有效性,难免出现对试验过程中的可能出现的假反应性问题的重视不足,对混样阳性pool拆分试验阳性率低的问题未引起足够重视。核酸检测拆分阳性率低不仅浪费试剂,还可能威胁到血液安全,目前国内外对核酸拆分阳性率低的原因和对策研究较少,我们通过对本实验室工作中各环节进行针对性分析,找出核酸检测拆分阳性率低的主要原因加以改进,从而进一步提高血液质量,降低输血途径传播病毒的可能性。
1 资料与方法
1.1 一般资料
采血管:为本站当前使用的EDTA-K2抗凝的分离胶试管,为一次性无菌无RNA酶真空采血管(BD公司)。
1.2 仪器与试剂
仪器:罗氏cobas S201核酸检测系统(美国罗氏),Hamilton STAR加 样 仪(瑞 士Hamilton),Thermo低 速 离 心机(美国)。试剂:HBV、HCV、HIV-(1+2)NAT联合检测试剂(cobasTaqScreen MPX)V2.0(美国罗氏)。
1.3 方法
分析核酸检测拆分试验阳性率低的原因:统计本2017年1月至8月阳性拆分率,从人、机、料、法、环多个方面,逐项列出可能导致拆分阳性率低的原因(图1),主要包括:操作人员不良操作习惯、仪器维护擦拭不规范、试剂上机时间长、强阳性标本同步太多、环境定期清洁不足等有关问题。核酸实验室全体人员集体讨论,并邀请罗氏技术支持进行现场指导,最后初步确认为标本处理环节交叉污染所致,主要改进方向:尽量避免核酸与酶免同步检测,即减少强阳性标本进行核酸检测的次数,同时强化实验室工作人员的防污染意识。统计分析实施改进措施前后拆分阳性率的差异,评价改进效果。
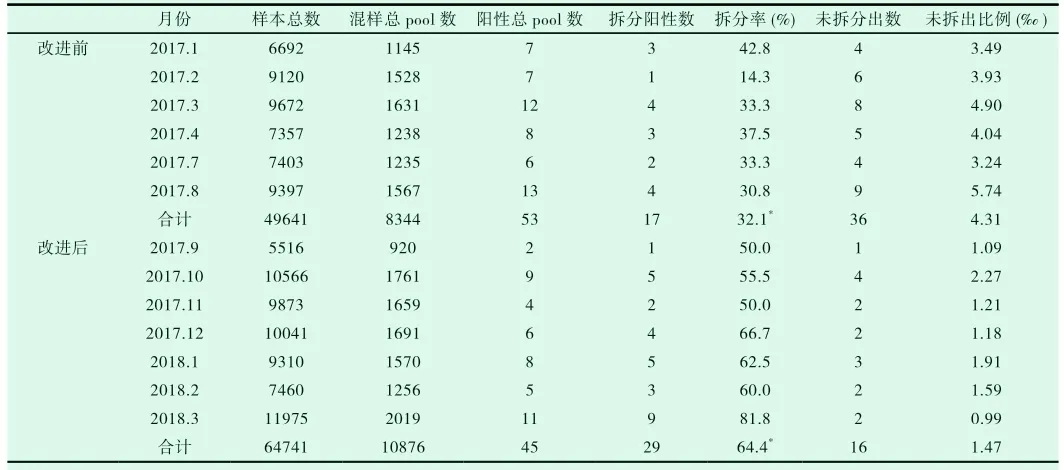
表1 改进前后NAT检测拆分阳性情况对比

图1 实验室可能导致拆分阳性率低的原因
1.4 统计学分析采用
SPSS 13.0软件对不同时间段拆分阳性率进行比较分析,拆分阳性率比较采用χ2检验,P<0.05认为差异有统计学意义。
2 结果
2017年1月至2017年8月份,罗氏核酸系统检测49641份ELISA检测阴性标本中,NAT混样混项目阳性53例,经拆分后共检出阳性17例,占总检测人数的0.034%,拆分阳性率为32.1%。2017年9月至2018年3月份,罗氏核酸系统检测64741份ELISA检测阴性标本中,NAT混样混项目阳性45例,经拆分后共检出阳性24例,占总检测人数的0.037%,拆分阳性率为64.4%。实施改进措施前后拆分阳性率统计学分析。2017年1月至2018年3月份实验结果,对实施改进措施前后拆分阳性率比较,采用χ2检验进行统计分析,差异有统计学意义(χ2=10.238,P<0.05),见表1。从9月份实施改进措施以后拆分阳性率明显升高(图2)。
3 讨论
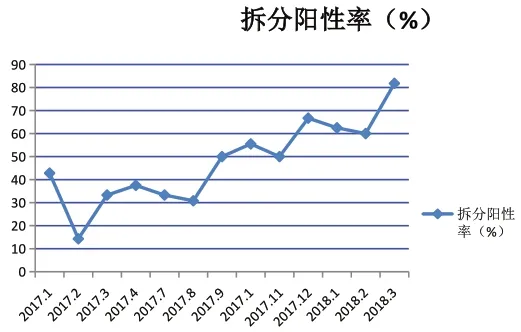
图2 拆分阳性率pool比例变化
核酸扩增技术能显著缩短人类免疫缺陷病毒(HIV)、丙型肝炎病毒(HCV)、乙型肝炎病毒(HBV)等病毒检测的窗口期,提高病毒的检出率,2010年开始逐步应用于国内献血者血液标本的筛查,降低了经输血途径传播病毒的风险[6]。考虑到核酸试剂成本等方面,现阶段国内还是主要以混样模式(6混样或8混样)进行献血者的血液筛查[1,6],核酸混样检测模式相对于单人份检测模式,虽然节约核酸检测成本,也带来一些问题。以本实验室使用的罗氏S201检测系统为例,如果初次混样阳性(6混样),为确定具体的阳性标本,需要进一步进行单样本拆分试验,但有一部分拆分试验结果为全部阴性,据各地试验数据统计,2016年山东省使用罗氏核酸检测拆分阳性率为64.3%(内部交流数据,未公开发表),而本实验室2017年1-8月拆分阳性率仅为32.1%(表1,2)。按照试剂说明书判定规则,拆分全阴性的6个标本全部判为核酸检测合格。虽然初次混样阳性结果以假反应性对待,但也并不排除某些原因导致核酸拆分试验的假阴性问题的可能性,如核酸检测标本的处理、保存不当,会造成病毒核酸降解[7,8]。相关报道显示,酶免阴性核酸阳性的献血者通过追踪或补充实验,多数为隐匿性感染,病毒载量多数都低于定量检测的检测下限[9-11],说明隐匿性感染时一般血液中的病毒载量也非常低,混样检测会降低试剂的检测灵敏度[12],导致低病毒载量的标本核酸检测的确存在检出概率问题,有研究显示通过超高速离心的方法使低浓度的阳性标本鉴别率明显提高[13],因此拆分阴性标本是否可以断定初次混检就是假反应性也有待考证。
核酸检测影响因素众多,如操作人员因素、仪器误差因素、献血者血液标本及试剂质量因素、实验操作因素、环境因素等。笔者针对拆分阳性率低的问题进行可能原因分析(图1),核酸实验室全体人员集体讨论,并邀请罗氏技术支持进行现场指导,最后初步确认为标本处理环节交叉污染所致,主要原因可能是前期酶免核酸同步检测较多(2016至2017年因生育政策调整,本实验室产假人数较多,导致核酸工作人员不足),确定主要改进方向:避免核酸与酶免同步检测,即减少强阳性标本进行核酸检测的次数,同时通过实验室全体人员集体讨论的方式,也使实验室工作人员主动提升的日常工作中的防污染意识。采取积极有效的改进措施后,2017年9月至2018年3月份,罗氏核酸系统检测64741份ELISA检测阴性标本中,NAT混样混项目阳性45例,经拆分后共检出阳性24例,占总检测人数的0.037%,拆分阳性率为64.4%。采取有效的措施使改进前后未拆分出数量明显减少(32.1% VS 64.4%,P<0.05),差异有统计学意义。笔者认为因各实验室情况各异,出现类似拆分率低的情况应列出的可能的原因,应结合实验室具体情况进行逐个排除,最后针对主要的一个或几个原因进行改进,当然每一次改进主要还是应该重视人的因素,重视改进-培训-评估的重要性。
虽然有学者认为NAT混样混项目阳性而未拆分出的标本,不能完全排除极低病毒浓度的情况出现[14,15]。但本室每次拆分实验所设阴性室内质控均在控,故可认为假阴性导致的未拆分出实验为小概率事件(当然也不能完全排除极低病毒浓度的情况出现),对于本文的拆分阳性率的统计比较误差可以忽略。笔者认为对于未拆分出样本,可以考虑增加拆分次数或用另一种不同原理的检测系统再次检测,验证能否提高拆分阳性率,我们将通过后续试验加以验证。
实验室从2017年9月份实施的上述一系列改进措施,明显提高了核酸检测拆分阳性率。针对拆分阳性率低的问题进行可能原因分析,核酸实验室全体人员集体讨论,最后初步确认为标本处理环节交叉污染所致,主要原因可能是前期酶免核酸同步检测较多,确定主要改进方向:避免核酸与酶免同步检测,即减少强阳性标本进行核酸检测的次数,同时通过实验室全体人员集体讨论的方式,也使实验室工作人员主动提升的日常工作中的防污染意识。
