青赤散保留灌肠治疗左半结肠型溃疡性结肠炎的网络药理学研究Δ
2021-02-26周正华
赵 帅,周正华
(天津中医药大学第一附属医院消化科,国家中医针灸临床医学研究中心,天津 300381)
溃疡性结肠炎(ulcerative colitis,UC)是一种以腹痛、腹泻和黏液脓血便反复发作为主要临床表现的慢性炎症性肠病,可伴有消瘦、发热和贫血等全身症状,内镜下可见黏膜血管纹理紊乱、消失及溃疡形成[1]。目前,现代医学以氨基水杨酸类药物治疗轻度UC患者,以激素、免疫抑制剂和生物制剂缓解中重度UC患者的临床症状,尚无针对性药物用于UC的治疗[2]。中医根据症状及发病特点将UC归属于“痢疾”“久痢”“肠澼”和“大瘕泄”等范畴[3]。中医内治法治疗UC已取得一定疗效[4]。但存在胃肠道损伤、药物利用率低等弊端,故临床多采用内服汤剂结合外用灌肠的方式综合治疗。青赤散是天津中医药大学第一附属医院消化科周正华主任根据多年临床经验,结合UC的肠镜病理表现,以“痈疡”辨病创制而成的灌肠方,对于左半结肠型UC疗效显著[5]。全方组成包括青黛、赤石脂、炉甘石、黄柏、苦参、儿茶、白及和三七,已有研究结果证实青赤散灌肠不仅可降低三硝基苯磺酸(TNBS)诱导的UC大鼠血清中肿瘤坏死因子(TNF)α的含量及结肠上皮细胞凋亡率,而且可显著抑制右旋葡聚糖硫酸钠(DSS)诱导的UC小鼠体内白细胞介素(IL)1β、IL-6的分泌,但全方配伍发挥药效的具体分子免疫机制尚未明确[6-7]。因此,本研究运用网络药理学方法及分子对接技术,探讨青赤散所含活性成分、靶点蛋白和信号通路之间的相互作用关系,揭示其治疗UC的潜在分子机制,以期有益于后续的基础及临床研究。
1 资料与方法
1.1 青赤散活性成分及作用靶点筛选
利用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)[8],检索青黛、黄柏、苦参、儿茶、白及和三七的全部活性成分。设定筛选标准为:生物利用度(oral bioavailability,OB)≥30%,提示有效成分易被人体吸收利用;类药性(drug-likeness,DL)≥0.18,表明活性成分具有良好的药动学特性;肠道上皮渗透性(Caco-2)>-0.4,说明活性成分可通过肠上皮渗透吸收,确定候选活性成分及相关蛋白靶点后,通过Uniprot数据库(https://www.uniprot.org/uniprot/)转换为标准基因名称(Gene names)[9-10]。由于TCMSP数据库中未收录赤石脂、炉甘石2味中药,查阅相关文献[11-14],补充赤石脂活性成分为AL2O3、SiO2和Fe2O3,炉甘石的活性成分为ZnO、Fe2O3、MgO和CaO,在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获得上述活性成分的分子结构式,通过STITCH数据库(http://stitch.embl.de/)预测潜在作用靶点。
1.2 疾病靶点筛选
在GeneCards(https://www.genecards.org/)、Drugbank(https://www.drugbank.ca/)和人类孟德尔遗传综合数据库(online mendelian inheritance in man,OMIM)(https://omim.org/)数据库中输入关键词“Ulcerative Colitis”进行检索,将3个数据库的查询结果进行去重合并,得出UC的疾病靶点。
1.3 构建青赤散“成分-靶点”网络
将药物名称、活性成分和作用靶点导入Cytoscape 3.7.2软件进行“成分-靶点”网络构建,并通过Network Analyzer分析该网络的拓扑学特征,根据Degree筛选得到青赤散的主要活性成分。
1.4 构建蛋白质-蛋白质相互作用(protein-protein Interaction,PPI)网络
将UC靶点与青赤散靶点取交集后录入String 11.0平台(https://version-11-0b.string-db.org/)[15]构建PPI网络,“Organism”选择“Homo sapiens”,“minimum required interaction score”设置为0.7,隐藏独立节点,将获取的蛋白相互作用关系数据下载保存为TSV格式,Combined score≥0.7,导入Cytoscape 3.7.2软件进行拓扑分析,根据Degree筛选得到核心靶点,以柱状图形式显示结果。
1.5 核心靶点基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
利用Metascape数据库(https://metascape.org/gp/index.html/main/step1)[16]对青赤散作用于疾病的核心靶点进行富集分析,选择“Custom Analysis”,设定P<0.05,进行GO功能富集分析,包含分子功能、生物学过程及细胞组分,并进行KEGG通路富集分析,将核心靶点映射到KEGG数据库的通路上,选择相关通路进行分析。
1.6 “药物-成分-靶点-通路”网络构建
将青赤散的主要活性成分与核心靶点相互关系及KEGG通路中前25位信号通路导入Cytoscape 3.7.2软件中,构建“药物-成分-靶点-通路”网络。
1.7 分子对接分析
从RCSB PDB数据库(http://www.rcsb.org/)获取核心靶点的三维结构,从PubChem数据库获取主要活性成分的化学结构,利用Schrödinger软件将主要活性成分与相对应的核心靶点进行分子对接,得到对接分数(Docking Score)及分子对接图。
2 结果
2.1 活性成分及靶点筛选
根据筛选条件及文献检索补充,获得黄柏活性成分23种,作用靶点166个;苦参活性成分23种,作用靶点170个;青黛活性成分6种,作用靶点45个;儿茶活性成分11种,作用靶点145个;白及活性成分5种,作用靶点16个;三七活性成分6种,作用靶点152个;赤石脂活性成分1种,作用靶点10个;STITCH数据库中未查询到炉甘石活性成分的靶点预测信息,尚待进一步研究与开发,见表1。

表1 青赤散活性成分
2.2 青赤散“成分-靶点”网络图
将药物名称、活性成分和作用靶点相互关联导入Cytoscape 3.7.2软件进行成分-靶点网络的构建,见图1。该网络共有282个节点和885条边,其中7个中药名称节点,68个活性成分节点,206个作用靶点。节点越大,Degree越高,在网络中发挥的作用越明显;根据Degree运用cytoHubba插件筛选出10种主要活性成分,分别为槲皮素(quercetin)、山柰酚(kaempferol)、木犀草素(luteolin)、β-谷甾醇(beta-sitosterol)、刺芒柄花素(formononetin)、豆甾醇(stigmasterol)、靛玉红(indirubin)、异紫堇杷明碱(isocorypalmine)、氢化小檗碱[(S)-canadine]和卡文定碱(cavidine),作为青赤散发挥治疗作用的关键活性成分。

图1 青赤散成分-靶点网络图
2.3 青赤散与UC交集靶点的PPI网络构建
筛选出青赤散作用靶点206个,与4 744个UC疾病靶点取交集,共得到142个交集靶点。将142个交集靶点录入String 11.0进行分析,得到PPI网络,隐藏6个孤立节点,见图2。图中共有136个节点和1 214条边,节点的平均Degree为17.8。根据Degree≥2倍中位数筛选出27个核心靶点,并绘制核心靶点图,见图3。

图2 PPI网络图

图3 核心靶点图
2.4 GO功能富集分析及KEGG通路富集分析结果
利用Metascape得到27个核心靶点的GO功能富集分析,取前20条进行可视化分析,见图4。分子功能中,核心靶点在转录因子结合(transcription factor binding)、蛋白激酶结合(protein kinase binding)和激酶结合(kinase binding)方面的富集度高;生物学过程中,核心靶点在炎症反应(inflammatory response)、脂多糖应答(response to lipopolysaccharide)和细胞凋亡信号通路(apoptotic signaling pathway)方面的富集度较高;细胞组分中,核心靶点在脂筏(membrane raft)、细胞膜微结构域(membrane microdomain)和质膜蛋白复合物(plasma membrane protein complex)方面的富集度较高。KEGG通路富集分析前25条核心通路,见表2。包含MAPK信号通路、IL-17信号通路、PI3K/Akt信号通路、TNF信号通路、Toll样受体信号通路和EBV信号通路等,见图5。
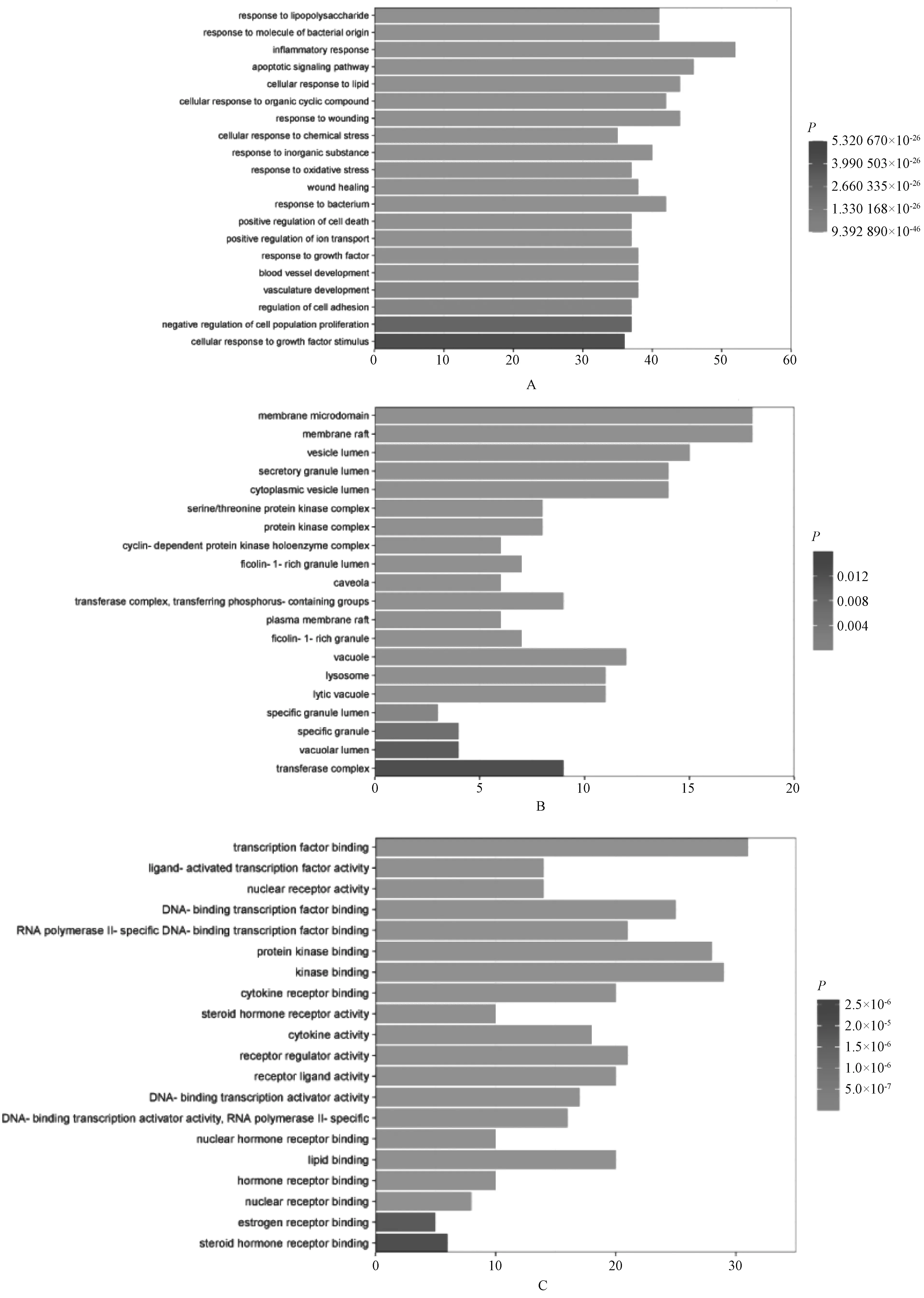
A.生物学过程;B.细胞组分;C.分子功能

图5 KEGG通路富集分析

表2 青赤散KEGG通路富集分析(前25位)
2.5 “成分-靶点-通路”网络
将青赤散的主要活性成分与核心靶点相互关系及KEGG通路中前25位信号通路导入Cytoscape 3.7.2软件中,构建“成分-靶点-通路”网络,结果显示,活性成分10种,核心靶点27个,信号通路25条,见图6。
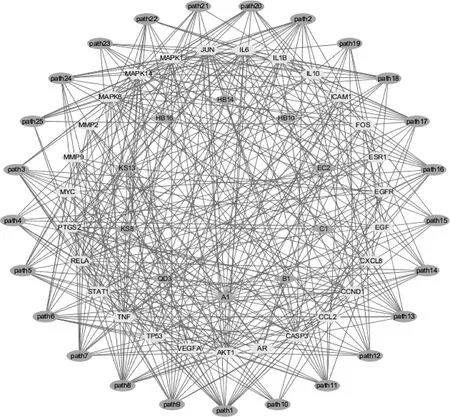
图6 “药物-成分-靶点-信号通路”网络
2.6 分子对接结果
将青赤散“成分-靶点”网络图中Degree排序居前3位的主要活性成分槲皮素、山柰酚和木犀草素与PPI网络中Degree排序居前5位的核心靶点ATK1、TP53、TNF、IL-6和MAPK1进行分子对接后,得到Docking Score分值,见表3。活性成分小分子化合物与核心靶点蛋白的结合越紧密,所得Docking Score的绝对值越大,具体对接情况见图7。由图7所示,槲皮素通过氨基酸残基TRY151、SER60、Q79、W80、Y272和TYR119与AKT1、TNF靶点蛋白形成氢键作用;山柰酚通过GLN79、THR211、SER205、GLN61和TYR151与AKT1、TNF靶点蛋白形成氢键作用;木犀草素通过GLN79、THR211、ASN54、TYR119和TYR115与靶点蛋白AKT1、TNF形成氢键作用。

A.槲皮素-AKT1;B.山柰酚-AKT1;C.木犀草素-AKT1;D.槲皮素-TNF;E.山柰酚-TNF;F.木犀草素-TNF

表3 主要活性成分与核心靶点蛋白分子对接结果
3 讨论
UC的主要病机概括为湿热蕴肠,气血失和,肠络瘀阻,病位在大肠。青赤散可直达病所,发挥清热化湿、解毒敛疮、生肌止血之效。灌肠的给药方式可确保药物吸收率,起效迅速,重建黏膜屏障,调整肠道菌群,充分发挥药效,有利于改善UC患者腹痛、里急后重和便脓血等临床症状[17]。
青赤散中含有的主要活性成分包括槲皮素、山柰酚、小檗碱、木犀草素、刺芒柄花素、靛玉红和卡文定碱等。槲皮素广泛存在于黄柏、苦参、儿茶和三七中。Dodda等[18]发现,槲皮素通过调节乙酸诱导的结肠炎大鼠体内的髓过氧化物酶(MPO)、谷胱甘肽(GSH)水平来抑制氧化应激过程,抑制IL-6的表达,减轻结肠炎症反应。黄柏中的小檗碱治疗UC的机制与调节免疫反应、降低氧化应激、保护肠道屏障及影响肠道微生物群有关[19]。β-谷甾醇存在于黄柏、青黛和三七中。研究结果表明,β-谷甾醇通过NF-κB通路抑制炎症因子IL-1β、TNF-α和IL-6的表达,改善结肠黏膜的充血水肿[20]。儿茶中所含的天然黄酮类化合物山柰酚是一种高效的抗炎剂,可通过保护结肠黏膜屏障的完整性而发挥对UC的治疗和预防作用,增强上皮细胞跨膜电阻值,降低肠黏膜的渗透性,减轻炎症损伤[21]。亦有研究结果证实,山柰酚可抑制DSS诱导的UC模型小鼠结肠黏膜中MPO的活动水平,降低免疫反应[22]。苦参中包含木犀草素、刺芒柄花素。木犀草素通过降低DSS诱导的UC大鼠体内NF-κB、IL-17和IL-23的水平缓解结肠炎症损害,并可改变肠道菌群的组成,增加乳酸杆菌、拟杆菌的含量而丰富菌群多样性,改善UC临床症状[23]。刺芒柄花素可增加上皮细胞紧密结合蛋白Claudin-1、ZO-1的表达,维持和恢复结肠黏膜的完整性,亦可抑制NLRP3炎症通路,显著降低IL-1β的分泌,减轻结肠炎的严重程度[24]。青黛中的活性成分靛玉红通过降低Toll样受体(TLR)4、NF-κB的表达,使DSS诱导的UC大鼠疾病活动指数、体重、结肠长度及病理均有明显改善,但对肠道菌群的影响较弱[25]。Niu等[26]发现,黄柏中所含的卡文定碱通过调节氧代谢产物,阻断NF-κB通路,降低TNF-α、IL-6炎症因子的表达等多途径发挥显著的结肠保护作用。白及中所含的白及多糖、菲类化合物可显著激活凝血因子,并促进血栓素的形成,发挥止血作用[27];还通过促进血管内皮生长因子(VEGF)的表达,加速上皮细胞的生长与成纤维细胞的增殖,促进溃疡愈合。
从PPI网络得知,青赤散作用于AKT1、TP53、IL-6、VEGFA、MAPK3、TNF、CASP3、PTGS2和JUN等靶点,起到治疗UC的效果。AKT是巨噬细胞的重要调节器,有研究结果表明,小檗碱通过AKT1抑制巨噬细胞M1极化,在炎性肠病(inflammatory bowel disease,IBD)中表现出抗炎作用[28]。调查结果显示,UC患者结肠黏膜TP53基因突变与结肠癌的发生关系密切[29]。IL-6基因表达与IBD的进展紧密相关[30]。线粒体激活蛋白激酶(MAPK)广泛参与细胞的增殖分化,实验结果表明,在TNBS诱导的结肠炎大鼠体内MAPK1、MAPK3的表达显著增加[31]。TNF在UC炎症反应中发挥了关键作用[32]。此外,PTGS2表达巨噬细胞参与炎症调节[33]。激活的JUN参与UC的氧化应激过程及炎症级联反应[34]。VEGF由内皮细胞产生,通过激活特定受体KDR与Flt-1促进血管生成,改善肠道微循环,有助于溃疡的修复与愈合[35]。另有研究结果指出,维西珠单抗诱导固有层T细胞的凋亡取决于CASP3依赖性途径,可迅速消除肠道黏膜中的病原T细胞[36]。
通过对核心靶点的KEGG富集分析,可以得出青赤散治疗UC主要涉及PI3K/Akt、MAPK、IL-17、Toll样受体、细胞凋亡和EBV感染等信号通路。其中Degree较高的23个靶点如AKT1、TP53、MAPK3、MAPK8、VEGFA和TNF等均作用在MAPK通路上。MAPK是多条信号通路的控制器,在级联反应中将上游与下游的信号行动联系起来,家族成员ERK1/2、p38和JNK1/2的激活释放大量TNF-α、IL-1、IL-6和IL-8等炎症因子,损伤结肠组织,诱发UC,还可激活NF-κB通路,进一步加重氧化应激和免疫反应[31]。
TLR信号通路可识别细菌、病毒并参与人体的免疫调节过程。朱东东等[37]发现,UC患者紊乱的肠道菌群使血清中TLRs的表达增加,引起免疫损伤。TLR4是TLR蛋白家族中具有代表性的跨膜受体,介导肠上皮细胞对菌壁的成分反应,TLR4的高表达可打乱肠上皮细胞与肠道菌群间的信号传递,增加炎症因子的表达水平,放大免疫反应[38]。而且,UC患者的疾病严重程度与血清TLR4的表达水平成正比[39]。故推测青赤散通过调节肠道菌群、抑制Toll样受体信号通路的激活等途径对UC起到治疗作用。
AKT1、TNF、MAPK1和CASP3等核心靶点均富集在细胞凋亡通路与TNF信号通路上。肠道上皮细胞维持黏膜屏障功能并参与免疫反应,一项关于上皮细胞凋亡与UC临床特征关系的研究结果显示,UC患者的上皮细胞凋亡率主要受局部炎症反应影响,微观炎症的增加与Fas配体的细胞凋亡反应呈负相关[40]。TNF介导的通路在诱导上皮隐窝细胞凋亡中起关键作用。Goretsky等[41]发现,T细胞活化刺激TNF和iNOS,使p53稳定存在并发挥介导作用,促进上皮隐窝细胞凋亡。故推测青赤散通过槲皮素、山柰酚等活性成分直接抑制UC患者细胞凋亡通路,保护肠道上皮细胞的完整性,提高黏膜防御力,或通过抑制TNF通路的激活,减少TNF-α的释放,延缓细胞凋亡。
EBV是疱疹病毒家族成员,由于免疫抑制剂的使用和肠屏障功能障碍,局部的炎症刺激驱动EBV在增殖的淋巴细胞中大量复制,使UC患者具有很高的EBV感染风险。一项UC肠道EBV感染的临床病理学研究结果显示,EBV浓度与疾病活动性之间呈正相关[42]。病例报告亦证实,难治性UC患者外周血及结肠黏膜中均检测出高浓度的EBV,说明EBV在结肠中被重新激活,继而损伤结肠黏膜,加重UC的炎症反应[43]。本研究中发现,AKT1、TP53、TNF、IL-6、JUN和MAPK8等31个靶点富集在EBV感染通路,故推测青赤散可发挥显著的抗EBV作用,较早采取灌肠干预或可降低难治性UC患者感染EBV的风险,对UC合并EBV感染的患者同样具有积极的临床意义。
IL-17信号通路上富集有CASP3、CCL2、CXCL8、FOS和TNF等25个核心靶点。IL-17可诱导免疫细胞在外周组织聚集,参与并放大炎症过程[44]。有研究通过实时聚合酶链反应和免疫化学法评估UC活跃期、缓解期患者与健康患者结肠黏膜中的IL-17表达情况,结果发现,UC活跃期患者结肠黏膜IL-17的基因和蛋白质表达显著高于其他两组,故推测青赤散可能通过上述富集靶点在IL-17信号通路发挥药效作用[45]。PI3K/Akt信号通路控制细胞因子的表达与分泌,本研究发现青赤散中有31个靶点在该通路富集。实验结果证实,阻断PI3K/Akt信号通路可减少TNF-α在UC患者和DSS诱发的结肠炎小鼠肠道黏膜中的分泌,降低疾病活动指数评分,缓解UC患者的临床症状[46]。此外,有研究结果表明,阻断PI3K/Akt信号通路后,可影响IκB磷酸化,从而抑制下游通路NF-κB的激活,减少TNF-α、IL-1的释放,缓解炎症反应[47]。
中药复方网络药理学通过对药物主要活性成分的筛选,构建活性化合物、基因靶点和分子通路间的网络连接,揭示并预测中药药效潜在的生物学作用,再借以分子对接技术理论模拟配体小分子与生物蛋白间可能存在的结合关系,进一步诠释中药复方的具体疗效机制。本研究通过网络药理学方法及分子对接技术分析青赤散灌肠治疗左半结肠型UC的潜在作用机制,结果显示,青赤散通过槲皮素、山柰酚、小檗碱、木犀草素、刺芒柄花素、靛玉红和卡文定碱等主要活性成分,调节AKT1、TP53、IL-6、MAPK3、TNF和CASP3等核心靶点基因的表达,作用于PI3K/Akt、MAPK、IL-17、TLR、TNF、细胞凋亡和EBV感染等多条信号通路,初步证实青赤散治疗UC是多成分、多靶点、多通路共同参与,为进一步实验验证提供了客观依据。但由于数据库的信息局限性,本研究未能对矿物药赤石脂、炉甘石的活性成分治疗UC的分子机制进行充分研究,其具体作用途径尚待进一步探讨。
