紫丁香195个实生单株花表型性状变异分析
2021-02-26何芮庆杨云尧胡增辉1静1冷平生1
何芮庆 杨云尧 胡增辉1,,3 吴 静1,,3* 冷平生1,,3
(1. 北京农学院林木分子设计育种高精尖创新中心,北京 102206;2. 北京农学院园林学院,北京 102206;3. 城乡生态环境北京实验室,北京 102206)
丁香属(Syringa)隶属木犀科(Oleaceae),为多年生灌木或小乔木,主要分布于我国东北、华北、西北和西南地区[1]。全世界丁香属植物约有27种,我国约有22 种,其中18 种为特有种,是丁香属植物种质资源的世界分布中心和栽培起源中心[2]。紫丁香(Syringa oblata)是我国栽培最为广泛的丁香属植物,因其花期早、花色淡雅、花香独特及适应性强等特点深受世人的喜爱,是我国北方园林绿化常用的观花灌木。然而,我国对紫丁香的研究仍处于起步阶段,以化学药用研究为主,包括生物活性检测[3]、化学成分分析[4]、生理特征研究[5]及药用价值探究[6]等方面,但对其遗传变异的研究及育种工作研究相对滞后。目前,紫丁香育种方式仍以传统杂交育种为主,育种周期长、效率低且需要花费大量的人力物力[7]。
遗传多样性为物种涵盖的种群间和种群内个体间遗传变异的总和,反映了生物种内基因的丰富程度,也是生态系统多样性和物种多样性的基础,遗传多样性包括表型、细胞学、生化和分子等多层次遗传变异[8]。其中表型是各种形态特征的组合,是生物受制于生态环境条件的遗传变异的表征[9~10],其表型变异是遗传多样性研究的重要内容[11~12]。同时,利用表型性状研究遗传多样性也最为简便、快速和经济,可以直观地揭示种群的遗传结构与变异大小,是遗传育种工作的基础[13]。对于紫丁香而言,花部性状是人们关注的焦点,本文通过对紫丁香种群的花部表型性状进行测定和分析,旨在揭示其在种群内变异特征、表型分化程度,探明表型性状间的相关关系,以期为紫丁香资源的遗传育种提供参考。
1 材料与方法
1.1 试验材料
本研究于2018~2019 年紫丁香花期,对种植于北京市昌平区北农科技园的1 800 多株紫丁香实生单株进行调查,以尽可能覆盖紫丁香花部表型变异为原则,筛选出具有代表性的紫丁香195株,为本研究的材料。该群体已集中栽培多年,株龄均在8年左右,生长条件良好,各性状表现稳定,栽培管理一致。
1.2 性状调查
依照《植物新品种特异性、一致性、稳定性测试指南(丁香属)》中对丁香性状的描述[14],选取9个花部性状并制定测定标准,包括5个数量性状和4 个质量性状(见表1)。以每个单株为一个样本,每个样本分别从不同方向取5 个花序,按照图1 所示标准用游标卡尺测量花序长和花序宽,然后每个花序再取5 朵小花,测量花冠裂片长、宽及花冠筒长。
为精准定义花色,用色差仪(CR-400)测量花色,测量时选取5 个花序中上部小花25 朵分别从正反两面测量花色,最终取平均值代表该样本的花色。利用Color Mate 5 软件辅助色差仪进行CIELab值的收集和分析,获得明度值(L*)、红度值(a*)和黄度值(b*),以上所有性状均在盛花期测定。
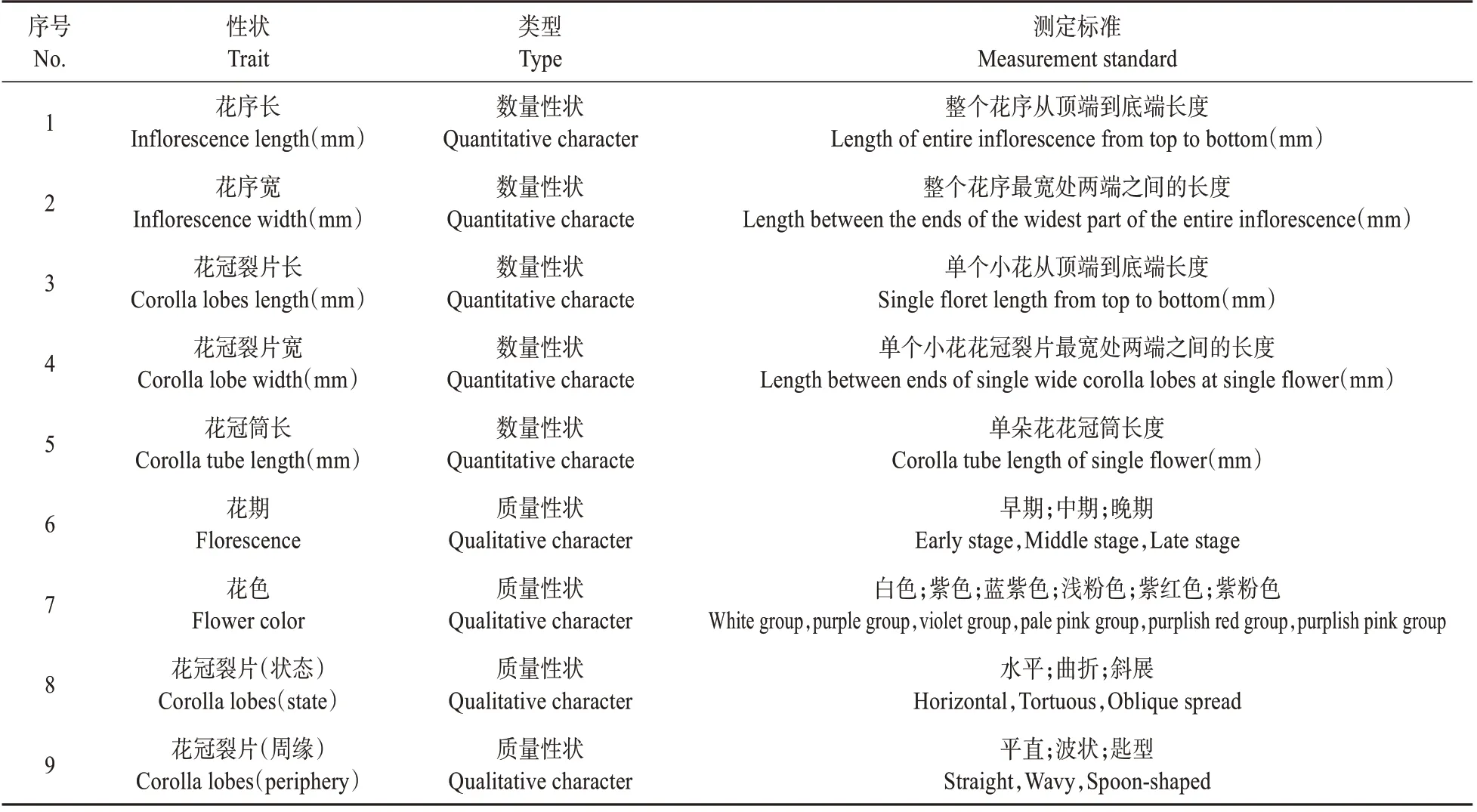
表1 紫丁香9个表型性状测定标准Table 1 Measurement standard for 9 phenotypic traits of S.oblata
1.3 数据分析
对于数量性状,分别计算各性状的平均值、最值、标准差和变异系数(Coefficient of variation,CV),其中CV(%)=(标准差/均值)×100;对于质量性状,统计其在群体中的分布频率,计算多样性指数(H'),其计算公式为:
式中:Pi表示第i 级别内材料份数占总份数的百分比[15]。
使用SPSS 软件进行单因素方差分析(ANOVA)、Pearson 相关性分析和聚类分析。另外,对于花色性状,利用Color Mate 5 软件将L*、a*、b*值转换为蒙塞尔颜色系统[16]的色相H(Munsell Hue)、明度V(Munsell Value)和彩度C(Munsell Chroma),彩度C*和色相角h根据公式计算:
式中:C*值表示到L*轴的垂直距离,距离越大,彩度越大。利用ISCC-NBS 色彩名称表示法[17],此法由美国国内色彩研究学会(Inter Society Colour Council)作成,而另由美国国家标准局(National Bereau of Standand)整理而成。同时参照洪艳等[18]和吴静等[19]对菊花和牡丹花色表型数量分类的方法,对紫丁香花色表型进行分类。
2 结果分析
2.1 数量性状表型变异分析
方差分析表明(见表2),5 个数量性状不同个体间表型变异差异极显著(P<0.01),其中紫丁香花序长的标准差最大,说明花序长的离散程度较高,而花冠裂片宽标准差最小,说明其离散程度低。5个数量性状的变异系数CV范围在19.72%~30.22%,其中花序长变异最大,花冠筒长最小,平均变异系数为24.97%。进一步分析5 个数量性状的表型频率分布发现(见图2),这5 个数量性状在该群体中均符合正态分布。综上所述,5个数量性状变异丰富、个体间差异极显著、基本符合正态分布。参试紫丁香材料中不同样本间极显著的表型差异为紫丁香选择育种提供了重要种质资源。
2.2 质量性状表型变异分析
4个质量性状中,花色是观赏植物重要的表型性状,也是品种分类的重要依据。本研究根据ISCC-NBS 色彩名称表示法,最终将紫丁香花色划分为6 大色系:白色系(white group)、浅粉色系(pale pink group)、紫色系(purple group)、紫红色系(purplish red group)、紫粉色系(purplish pink group)和蓝紫色系(violet group)(见表3)。对各色系的CIELab 颜色系统参数(L*、a*、b*)值进行分析发现,各色系的L*、a*、b*值特征明显,可以区分不同色系,紫红色系的a*值偏大,在10.38~31.71,白色系和浅粉色系的a*偏小,范围为-7.26~2.14,除白色系和浅粉色a*值有负值分布,其他色系的a*值均为正值;b*分布在-7.26~31.71;白色系和浅粉色系的b*值均为正值,紫粉色有部分为正值,其他色系均为负值;彩度C*值介于-16.72~8.66,色相角h值介于178.26~76.09。

表2 参试紫丁香表型性状的描述性统计Table2 Descriptive statistics for phenotypic traits measured in the trail of S.oblata trees
4 个质量性状的分类占比见表4,从花色、花期、花冠裂片(状态)来看,花色紫色、花期中期、花冠裂片(状态)曲折所占比例最高,分别为54.35%、91.79%和52.82%;花冠裂片(周缘)平直所占比例最高,为36.41%,波状和匙型占比相当(31.79%)。4 个质量性状的多样性指数在0.36~1.09,平均数为0.86,总体上反映了紫丁香较高的多样性水平,但不同性状间差异较大,其中花冠裂片状态最大(1.09),花期最小(0.36)。
2.3 表型性状相关性分析
将紫丁香的9 个表型性状进行Person 相关性分析,由表5 可知,5 个数量性状互相之间呈现极显著正相关,其中花序长与花序宽间的相关性系数最大,为0.767。花序长与花冠裂片宽之间的相关性系数最小,为0.447。花冠裂片(状态)与花冠裂片(周缘)呈现极显著正相关,花色与花冠裂片(状态)、花色与花冠裂片(周缘)、花冠裂片宽与花冠裂片(周缘)均呈显著性正相关,其余均无显著相关,表型性状相关性分析可为紫丁香多性状综合选择提供参考依据,也有助于我们更好了解性状之间的互作。

表4 参试紫丁香种质材料4个质量性状的频率分布Table 4 Frequency distribution of 4 qualitative phenotypic traits of S.oblata trees
2.4 表型性状聚类分析
根据紫丁香的9 个表型性状,对195 份紫丁香种质资源进行Q 型聚类分析(见图3),使其形态相似的聚为一类,结果表明:在欧式距离为10 时,可将供试的195 株紫丁香划分为3 大类群,第一类群包含82 个个体,占供试材料总数的42.05%,这一类群材料主要性状表现为花冠筒长,其他表现居中;第二类群包含33 个个体,占供试材料总数的16.92%,主要表现为花序长;第三类群包含80 个个体,占供试材料总数的41.02%,主要表现为花冠裂片长。

表5 紫丁香群体表型性状的相关性分析Table5 Pearson correlation coefficients between each pair of variable of S.oblata
3 讨论
表型是由基因型和外界环境共同作用的结果[20]。本研究供试的材料为成年植株,栽培条件一致,性状表现已经稳定,ANOVA 分析表明,5 个数量性状不同基因型间表型变异差异极显著(P<0.01),可认为群体的表型变异主要取决于基因型差异,表型性状遗传多样性是基因多态性在形态上的呈现[21]。丰富的种质资源是现代育种的物质基础,种质资源多样性的高低与其有效利用有直接关系。表型性状的鉴定以及描述是研究种质资源最基本的方法和途径[22]。明军等[23]以紫丁香的4 个天然群体和1 个栽培群体为材料分析了14 个表型性状的遗传多样性,结果表明,各性状间表现出不同程度的变异,变异系数范围为14.25%~29.13%,其中天然群体变异系数范围为9.22%~35.38%,栽培群体变异系数范围为8.38%~23.68%。本研究测量的5 个数量性状,其变异系数CV 的范围在19.72%~30.22%,这与本研究结果基本一致。张兴等[24]对哈尔滨市不同生境下的紫丁香栽培群体进行花部部分性状表型变异分析,平均变异系数范围为10%~37%,这与本研究的结果也基本一致。龚梅香[25]分析巧玲花7 个表型性状的遗传变异发现,其中花冠筒长度的变异系数最小为14.63%,说明花冠筒长在群体中表现最稳定,这与本研究的结果(19.72%)基本一致。另外,普遍认为若群体表型变异系数超过10%,就认为该群体表型性状变异明显[26],变异系数也可以衡量观测值的离散程度,变异系数范围越大,观测值的离散程度越高,表型变异越丰富[13,27]。本研究中,紫丁香群体5 个数量性状变异系数均超过10%,且群体中各性状都基本符合正态分布。对表型性状相关性的分析发现,各数量性状互相之间呈现显著性正相关,花冠裂片长与花冠裂片之间的正相关系数为0.757,花冠裂片长与花冠筒长之间的正相关系数为0.524,这与龚梅香等[25]对巧玲花表型遗传多样性研究中结果基本一致。由此可见,该群体表型变异丰富,具有代表性,可用于后续的关联分析。
该研究通过ISCC-NBS 色名表示法对紫丁香花色分为6类色系,并整理出了不同色系花色参数分布范围。通过对紫丁香花色表型的L*、a*、b*值分析,发现紫丁香花色单一,多以紫色为主,有研究报道,花青苷和花黄素共同决定丁香的花色,飞燕草色素(Dp)是决定花色呈现蓝色系的重要色素[28~29]。飞燕草素-3-O-芸香糖苷(Dp3Ru)是丁香花瓣的主要色素成分,这种色素基础决定了自然界中丁香花色主要以紫色、蓝紫色调为主[30],这与本研究表型调查的结果也相对应。传统的杂交育种手段已对丁香花色育种做出了重大贡献,但是丁香花色仍以紫色为主,尤其是紫丁香,缺少红色、橙色丁香,天竺葵色素(Pg)和矢车菊色素(Cy)是红色花瓣呈现的化学基础。如何提高紫丁香中这两种色素的含量,对丁香的花色育种有很大的促进意义。丁香的色素组成结果显示,Dp3Ru是丁香花瓣中的主要色素,矢车菊素-3-O-芸香糖苷(Cy3Ru)的含量非常低,色素含量也是影响花色的重要因素[30~31],因此针对色素含量的紫丁香新品种育种仍有很大的育种空间。
4 结论
参试紫丁香种质资源在个体水平上表现变异丰富,多样性高。通过对紫丁香花色的测量及分析,认为紫丁香花色单一,但其蓝紫色表型淡雅,且在花色中不常见,可作为培育新品种的优良选择。该研究结果将为后续进行紫丁香重要观赏性状与标记的关联分析奠定基础,为紫丁香的遗传育种提供技术支持。
