人参种植对林地土壤细菌群落结构和代谢功能的影响
2021-02-25喻海茫于晶晶李迪强张于光
丛 微,喻海茫,于晶晶,李迪强,张于光,*
1 中国林业科学研究院森林生态环境与保护研究所,国家林业和草原局生物多样性保护重点实验室, 北京 100091
2 湖南省长沙县职业中专学校, 长沙 410142
土壤中存在着最丰富多样的微生物,其不同的生理特性与功能直接影响生态环境,驱动生物地球化学物质循环[1-4]。土壤微生物是地上植物群落和土壤养分循环联系的关键纽带[5-7],同时,土壤微生物在构建植物群落、维持植物多样性和植物健康等方面也发挥着重要作用[8-9]。然而,土壤微生物多样性的降低和群落结构的变化会影响多种生态系统功能,如植物多样性、有机质降解和养分的循环与利用[10]。研究发现,土地利用变化将引起土壤微生物群落结构的变化[11],从而导致微生物功能基因丰度和生态功能的变化[12]。

1 研究方法
1.1 土壤样品采集
土壤样品采集于黑龙江省双宝山林场,选取林地(RS0)、林地开垦后种植人参3a(RS3)、种植人参4a(RS4)和已收获人参(种植4a)的空地(AS4)。每种用地类型设置3个重复样地,样地面积为10 m×10 m,样地间隔超过20 m。采用多点采样法采集0—10 cm土壤,每种用地类型采集3份土壤样品。土壤样品分成两部分放入标记好的自封袋中,一部分常温保存,用于土壤理化性质分析;一部分冷冻(-20℃)保存,用于土壤DNA测定分析。
1.2 土壤理化性质测定
土壤理化性质测定采用常规方法[20],包括土壤含水量、pH值、有机碳、全氮、全磷、全钾、水解性氮、有效磷、速效钾、铵态氮、硝态氮的测定。
1.3 土壤细菌DNA提取及测序
使用PowerSoil试剂盒(QIAGEN,德国)提取土壤样品微生物DNA,通过1%琼脂糖凝胶电泳检测DNA完整性,并用NanoDrop2000检测DNA溶液的浓度和纯度。使用16S rRNA基因引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3)对细菌的V3-V4区进行扩增[21]。利用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司,美国)切胶回收PCR产物,Tris_HCl洗脱,2%琼脂糖电泳检测PCR产物。通过MiSeq PE300平台进行测序(美吉生物医药科技有限公司,上海)。
1.4 数据分析
基于Trimmomatic、FLASH软件平台对测序得到的双端序列数据进行拼接以及质控过滤[22-23];使用Usearch软件按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列并选出与OTU代表序列相似性在97%以上的序列,生成OTU数据表格[24];采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在各个水平统计每个样品的群落组成[25]。
土壤细菌α-多样性由Shannon指数、Simpson指数倒数、Richness指数和Pielou均匀度指数表征。细菌群落结构间的差异采用除趋势对应分析(Detrended correspondence analysis,DCA)表征,基于非线性模型对数据进行排序分析的方法。典范对应分析(Canonical correspondence analysis, CCA)和Partial Mantel Test分析影响细菌群落结构的主要环境因子,在进行CCA分析时,首先通过方差膨胀因子(Variance inflation factor, VIF)剔除共线性严重的环境因子,即保留VIF值小于20的环境因子,再进行CCA分析。利用Tax4Fun工具对群落功能进行预测,Tax4Fun是基于SILVA数据库与KEGG数据中原核分类间的线性关系将16S的OTU信息进行功能预测的软件[26]。
2 结果
2.1 土壤养分和理化性质的变化
种植人参后,土壤pH值随种植人参时间的增加而降低,土壤出现酸化的趋势。土壤的水分、有机碳、全氮、速效钾含量显著降低,而全钾、硝态氮含量显著升高(表1)。
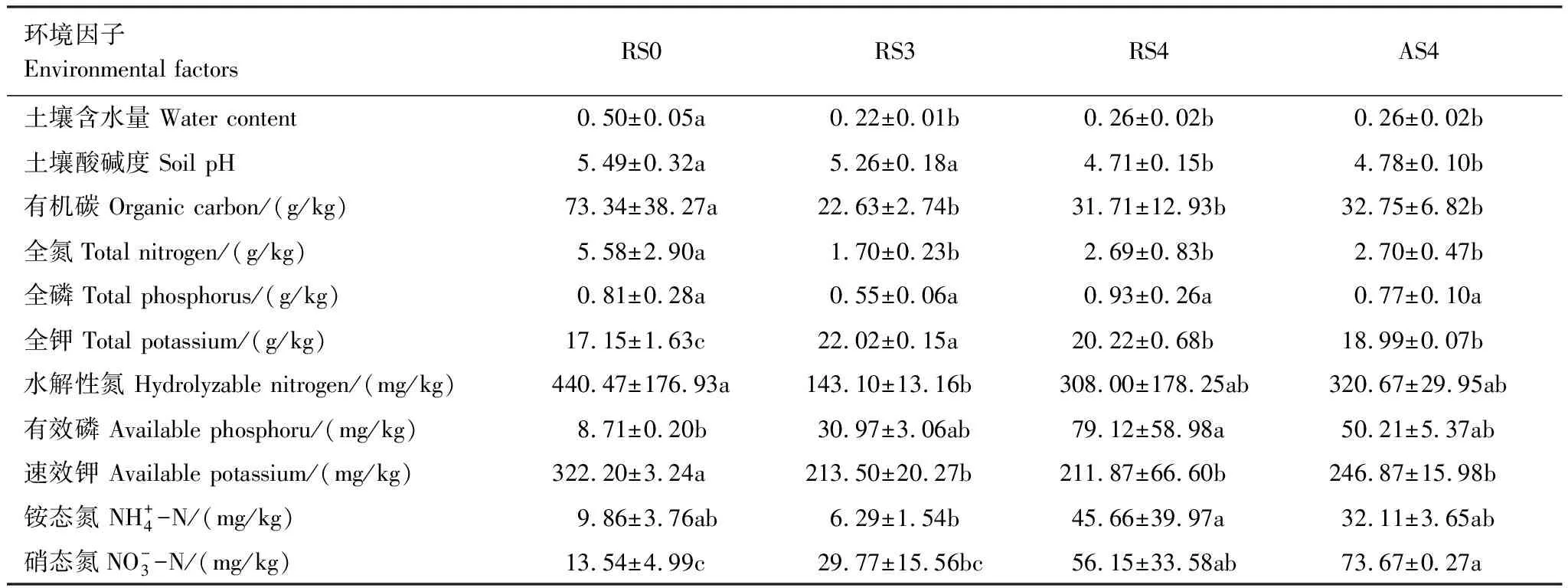
表1 土壤理化性质
2.2 土壤细菌的物种组成
对土壤样品16S rRNA测序及物种注释,共得到10416个OTU,属于36个门类和550个属类。在门水平上,相对丰度大于1%的门类共有9个,其中变形菌门(Proteobacteria, 26.18%)、放线菌门(Actinobacteria, 21.64%)、酸杆菌门(Acidobacteria, 18.86%)、疣微菌门(Verrucomicrobia, 7.62%)、绿弯菌门(Chloroflexi, 5.97%)是主要门类,共占群落组成的80.26%。以林地RS0为对照,对不同种植时间的人参土壤细菌群落组成分析可知(表2),变形菌门相对丰度在RS0样地中最高,种植人参后变形菌门的相对丰度表现出降低的趋势,其中AS4的变形菌相对丰度显著小于RS0。放线菌门相对丰度在种植人参后显著增加,在RS3样地中相对丰度达到最高,随着种植时间的增加相对丰度表现出下降的趋势。酸杆菌门栽参后其相对丰度显著降低,而疣微菌门和绿弯菌门的相对丰度显著增加。在属水平上,相对丰度大于1%的属共有20个(表3),随着种植时间的增加,属Sphingomonas相对丰度先增加后降低;属Kofleria、Gp6和Gp4相对丰度显著降低;属Ktedonobacter相对丰度显著增加。

表2 土壤细菌门水平的相对丰度/%
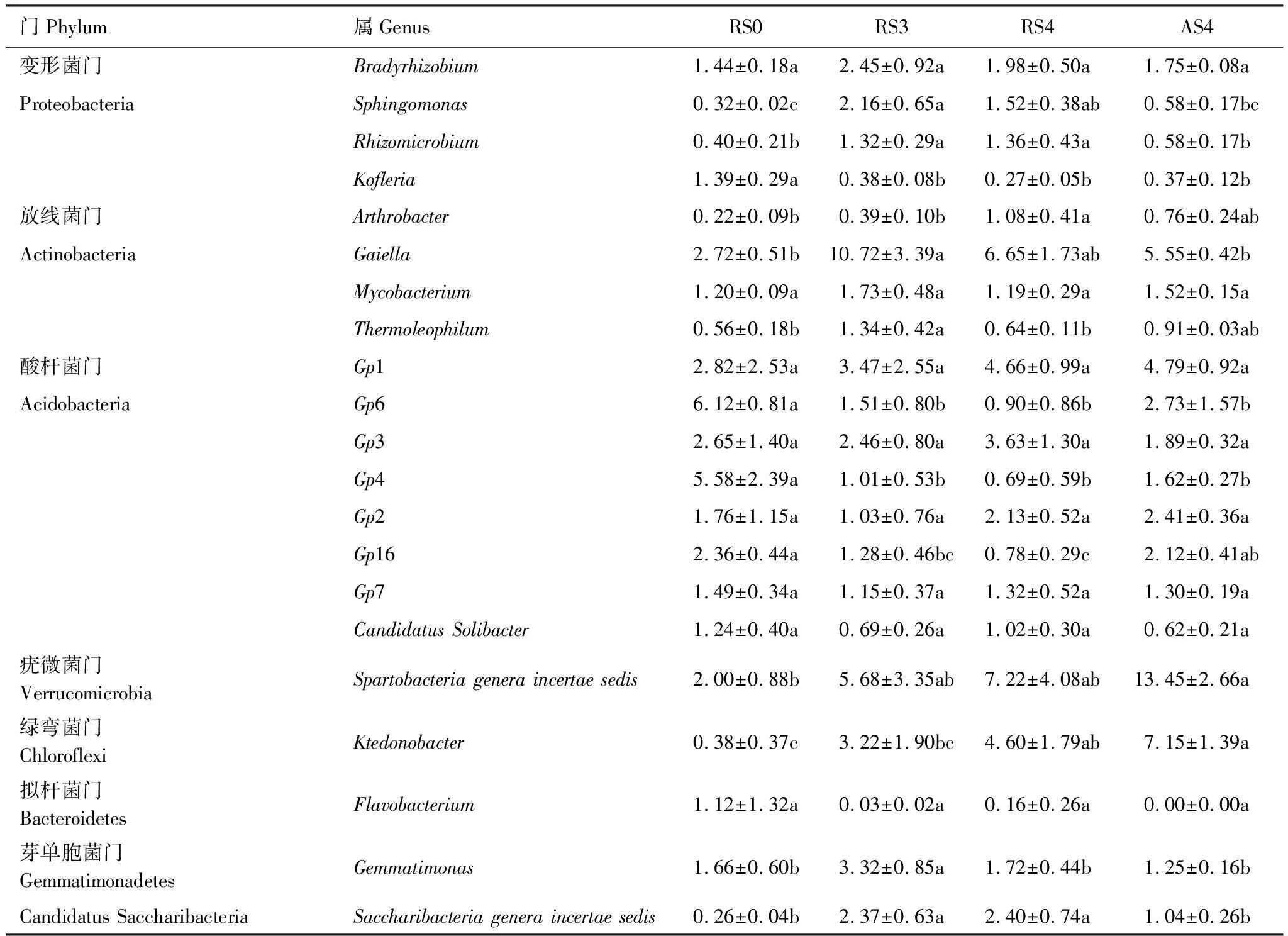
表3 四个样地中相对丰度大于1%的属
2.3 土壤细菌群落的多样性
对土壤细菌α-多样性分析结果表明(表4),林地开垦种植人参后,土壤细菌的多样性显著降低,随种植时间的增加其多样性变化无显著差异。DCA探究人参土壤细菌群落的结构分布,从图1可以看出不同种植时间的人参样地群落结构有着明显的区分,特别地栽参地(RS3, RS4, AS4)与对照样地(RS0)的细菌群落差异显著,主成分一解释度为30.8%,主成分二解释度为12.9%。
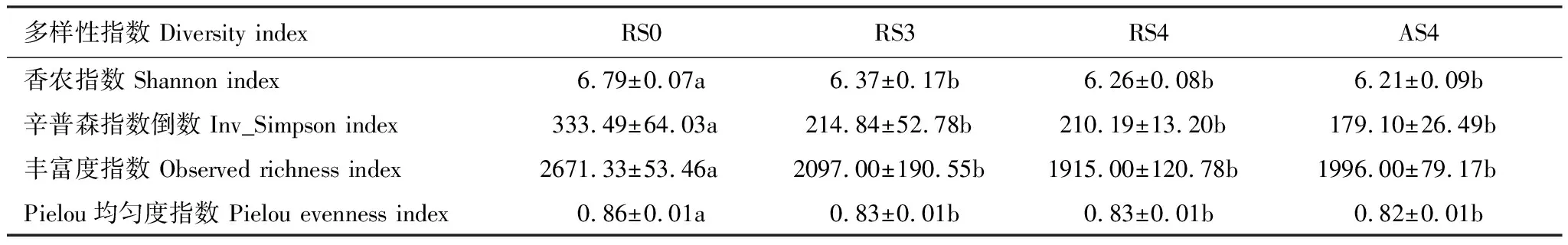
表4 土壤细菌α-多样性

图1 土壤细菌群落除趋势对应分析
2.4 土壤细菌群落与环境的关系
利用CCA分析影响人参土壤细菌群落结构的环境因子,根据方差膨胀因子选入7个环境因子。由CCA排序图可知(图2),CCA第一轴与速效钾和pH具有正相关关系,与全钾呈负相关,表明土壤pH、速效钾和全钾是影响土壤微生物的重要因素。由Partial Mantel Test(表5)分析可知,速效钾和全钾对土壤细菌群落结构具有最显著的影响(r=0.669,P<0.001和r=0.579,P<0.001),土壤pH次之(r=0.478,P=0.012)。因此,速效钾、全钾和土壤pH可能是影响土壤微生物的重要环境因素。
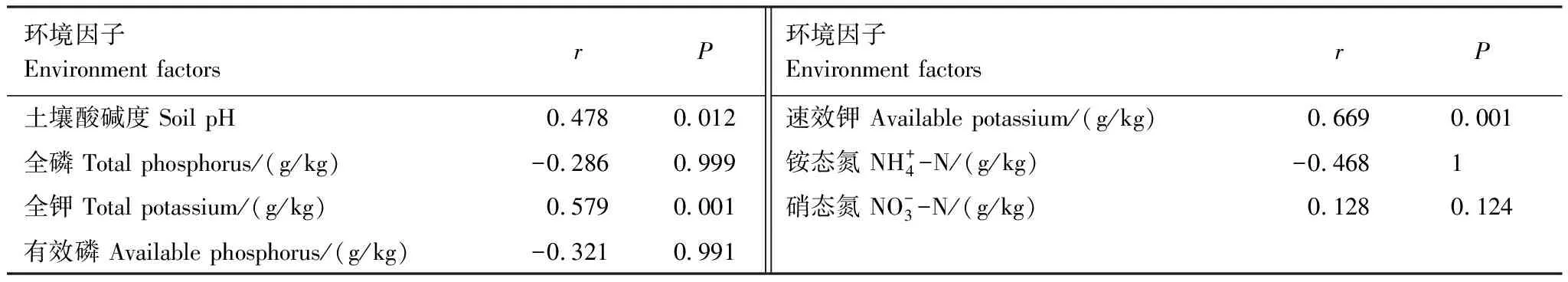
表5 土壤细菌全部OTUs与环境因子之间的Partial Mantel分析
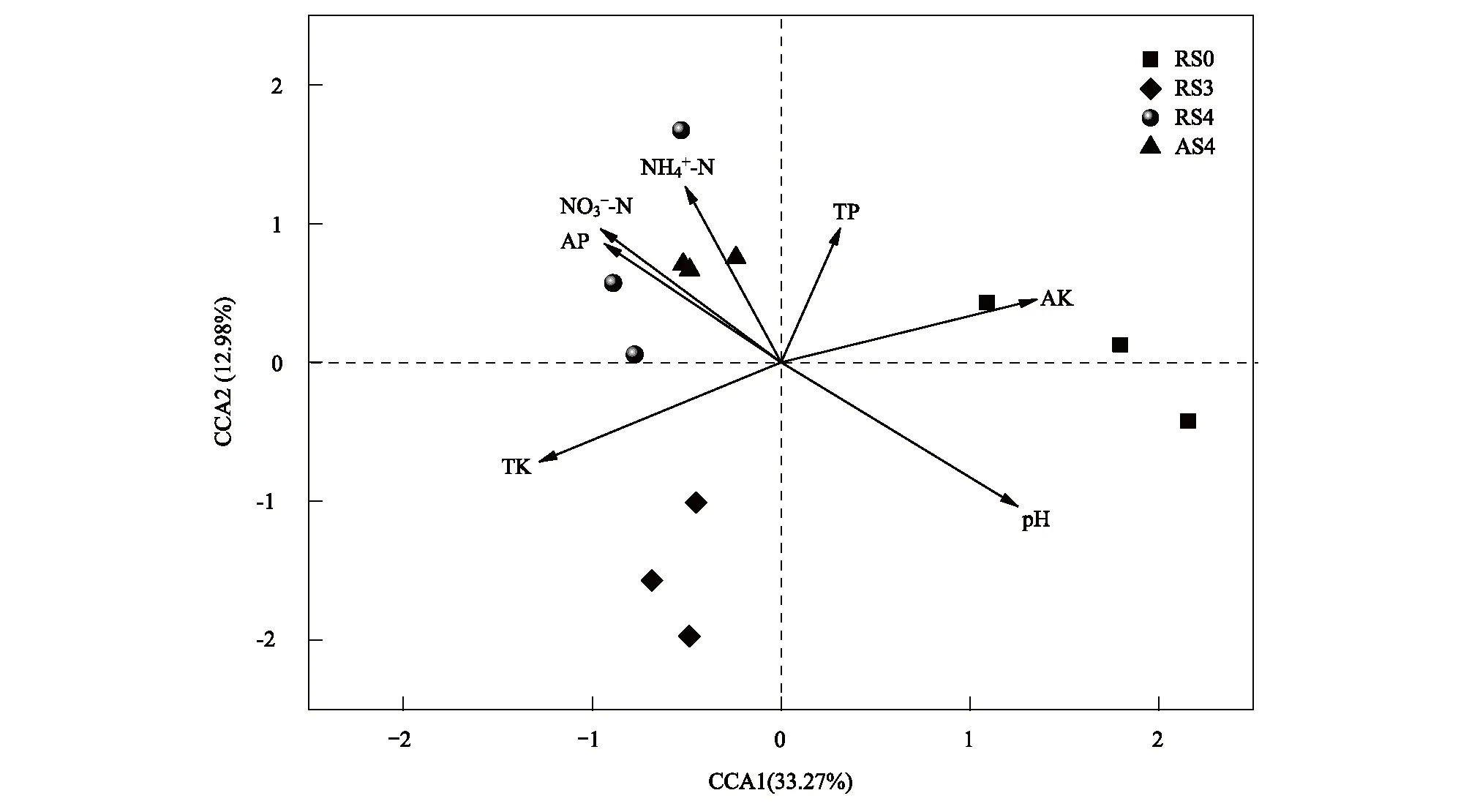
图2 土壤细菌群落与环境因子之间的典范对应分析
2.5 细菌Tax4Fun功能预测分析
基于SILVA数据库与KEGG数据库,通过Tax4Fun工具对16S的OTU信息进行功能预测。结果共获得41种二级(Level 2)功能分组和279种三级(Level 3)功能分组,其中有6种三级功能组相对丰度大于2%,包括ABC转运蛋白(8.00%)、双组分系统(7.50%)、嘌呤代谢(3.01%)、氨酰生物合成(2.59%)、嘧啶代谢(2.07%)、氮代谢(2.01%)。RS3、RS4、AS4与RS0各组间存在显著差异的KEGG代谢途径第二层分类以及在各组的比例如图3所示,人参种植3a后,氨基酸代谢相对丰度最高且显著增加,萜类化合物和聚酮类化合物代谢功能、信号转导功能的相对丰度显著降低。人参种植4a后,核酸代谢、膜转运功能和碳水化合物代谢的相对丰度增加,萜类化合物和聚酮类化合物代谢相对丰度显著降低。收获后的4a生人参样地中,核酸代谢和碳水化合物代谢功能的相对丰度显著增加,信号转导功能的相对丰度显著降低(图3)。
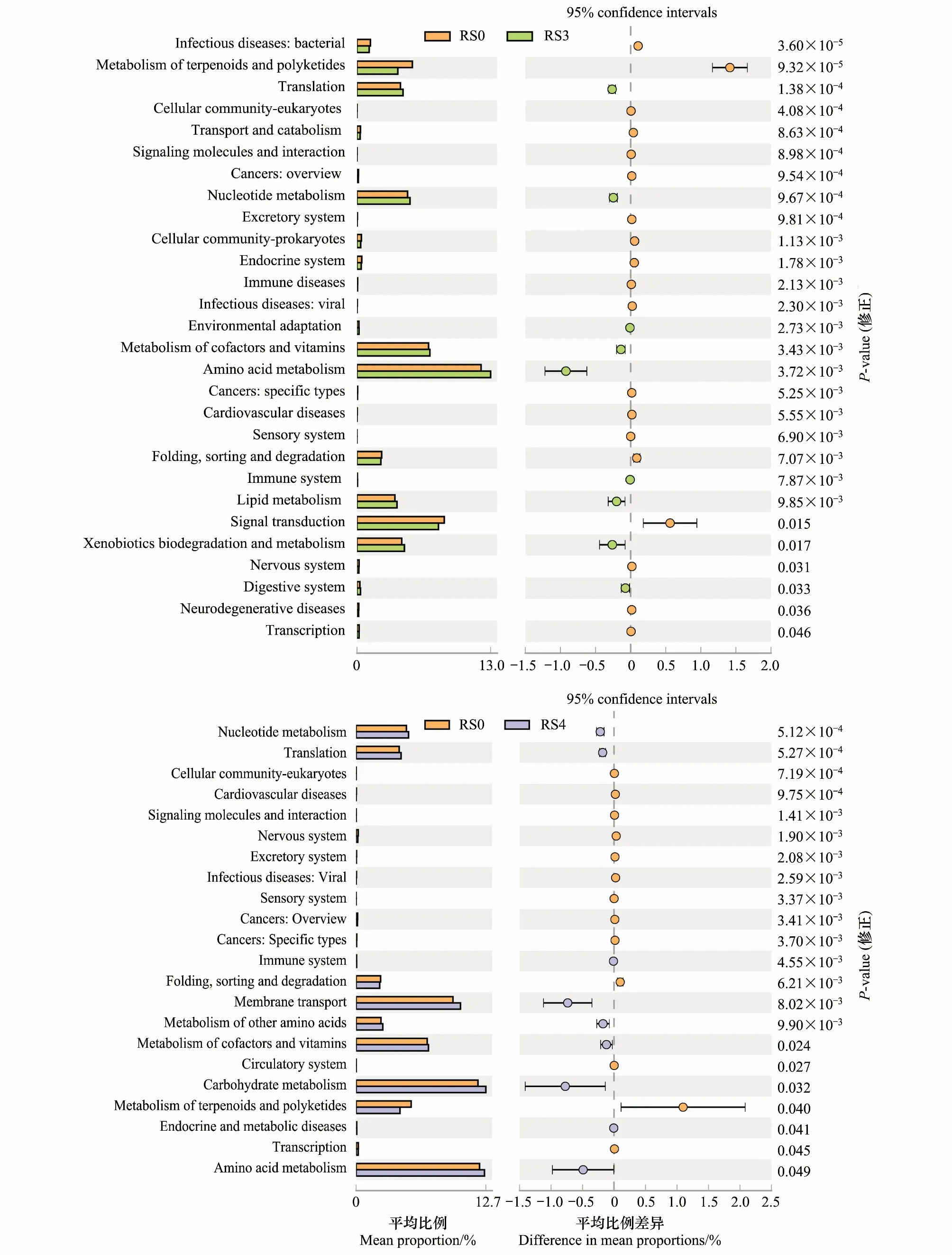
图3 基于Tax4Fun预测的细菌功能分组差异表达(二级功能分组)
3 讨论
人参种植对土壤养分和理化性质产生了直接影响,可能直接产生连作障碍[15-16,27]。人参适于在土壤pH值为5.5—6.5范围内生长,土壤酸化是人参连作障碍的原因之一,酸性土壤可能显著增加人参根系病害的发生,许多土传病害受土壤pH值的影响,例如,由Cylindrocarpondestructans引起的人参根腐病在酸性土壤中的发病率更高[28]。本研究发现林地开垦栽参后,土壤有机碳、全氮、速效钾等养分和土壤pH显著降低,表明人参种植后对土壤养分的吸收利用,导致有机碳含量下降,氮磷钾等营养元素失衡,致使土壤出现酸化趋势,从而可能导致人参连作障碍。土壤酸化由多种原因导致,相关研究表明,人参根系过量摄取阳离子以及硝化过程释放大量离子导致土壤pH降低[15];由于土壤微生物的代谢活动和人参根系产生大量有机酸导致[29];人参生长发育早期,氮和钾元素的缺失导致有机酸和酚酸的分泌致使土壤pH降低[30];随人参栽培年限的增加,营养元素供应不平衡以及土壤吸收性能变差导致土壤趋于酸化[16]。谢忠凯等[31]认为硝态氮含量与氮肥施用量、土壤硝化作用强弱以及硝态氮具有较强的随水移动性有关。本研究中,种植人参后土壤硝态氮含量显著增加,而土壤含水量表现出下降的趋势,可能由于硝态氮随水移动性减弱,空间上的限制导致人参根系吸收硝态氮受阻,从而在土壤中大量积累增加人参根系锈病发生率[32],影响人参生长。
连作影响土壤微生物群落结构和组成,抑制有益微生物的生长,加快病原菌的繁殖,进而影响植物健康[33]。本研究中,林地开垦种植人参后,土壤中酸杆菌门相对丰度降低,可能受栽参后土壤碳、氮含量变化的影响[34-35]。已有研究表明,酸杆菌门具有利用不同碳底物和降解木聚糖、半纤维素等复杂底物的能力,在土壤中硝酸盐、亚硝酸盐、一氧化碳还原和铁氧化还原等方面具有重要作用[19],而土壤中金属元素的积累和较高硝酸盐浓度可增加人参根系锈病发生率[27,32],因此,酸杆菌门相对丰度的减少可能导致土壤中硝酸盐、亚硝酸盐和铁等金属含量的增加,不利于人参的生长。Dong等人[18]对人参根际微生物群落研究发现,人参根际微生态的变化与人参的种植时间和发育阶段有关。本研究也发现,在属水平,随着种植时间的增加,属Sphingomonas相对丰度先增加后降低,属Kofleria、Gp6和Gp4相对丰度显著降低,属Ktedonobacter相对丰度显著增加。
土壤微生物群落和代谢功能的变化是影响植物连作的主要因素[36],不同生长年限的人参由于其根系类型差异和根系分泌物促进了人参微生物群落的变化[18]。萜类化合物是植物次生代谢产物,大多数萜类化合物对植物的抗病性、抗逆性和各种生物相互作用有关[37]。研究发现,免疫变化与信号的改变有关[38-39]。本研究通过Tax4Fun功能预测,对不同生长年限的人参在代谢水平分析发现,人参种植后,萜类化合物和聚酮类化合物代谢与信号转导功能的相对丰度显著降低,这种代谢水平上的变化可能是导致人参连作障碍的主要因素。在RS4和AS4中,膜转运功能的相对丰度高于RS0,与Wu[40]研究一致,发现在患根腐病三七的根际土壤具有较高的膜转运功能,这加快了细菌的移动和侵染根系的速度。此外,本研究发现与人参生长发育相关的代谢途径主要有碳水化合物代谢、氨基酸代谢和核酸代谢,其相对丰度的增加可能会抑制土壤中病害的传播,但这也是一个消耗能量的过程[40]。
4 结论
本研究表明,林地开垦种植人参后,土壤酸化明显,土壤养分、土壤微生物多样性和微生物群落结构等都发生了明显变化。CCA和Partial Mantel Test确定了影响土壤细菌群落结构的环境因子是土壤速效钾、全钾和土壤pH,土壤pH可能通过调节土壤营养而影响细菌群落,表明土壤养分变化可能是土壤微生物群落变化的重要因素。功能预测表明萜类化合物和聚酮类化合物代谢与信号转导功能的相对丰度显著降低,而膜转运功能的相对丰度增加。研究间接证明了林地栽参后土壤微生态失衡和根系酸化可能是人参连作障碍的部分原因。因而,通过提高土壤肥力和调节微生态平衡,有利于减轻人参连作障碍,进而提高人参的产量和质量。
