miR-125a下调Notch1参与调控心肌梗死后心肌纤维化
2021-02-25杨泽福万建平薛世荣
杨泽福,万建平,潘 伟,薛世荣,杨 玲
心肌梗死(Myocardial Infarction,MI)是心脏冠状动脉堵塞导致的急性心肌坏死,常伴随心脏重构性修复后心肌纤维化(Myocardial fibrosis,MF)[1-2]。MF是MI后有助于心脏重塑的一种重要的病理过程和发病机制[3]。据统计,全球每年约有65%的MI患者表现有MF性心脏重构[4]。因而限制MI后的纤维化对预防和治疗心脏病尤为重要。
在正常情况下,心脏成纤维细胞保持相对生长静止,分泌适量的胶原蛋白等细胞外基质(Extracellular Matrix,ECM)以维持心脏的结构完整性和正常功能。当发生MI,心脏成纤维细胞被激活,其增殖并分化为高表达α-平滑肌肌动蛋白(α-Smooth Muscle Actin,α-SMA)的肌成纤维细胞,导致纤维化心肌中过多的I型胶原蛋白等ECM沉积,引起心脏重构。因此,抑制心脏成纤维细胞激活及分泌胶原蛋白等ECM合成是治疗MI后MF的重要靶点。
微小RNAs(MicroRNAs,miRNAs)是一类小型非编码RNA,因其对基因表达的负面调控而备受关注[5]。miRNA通过互补序列与靶mRNA的3′端非翻译区域结合导致翻译抑制,影响细胞增殖凋亡,可以作为生物标志物应用于临床疾病诊断和治疗[4,6-7]中,肝纤维化小鼠高表达miR-125a参与调控肝星状细胞细胞增殖和活化调控[8]。最新研究发现,miR-125a具有调控Notch信号通路参与调节细胞增殖凋亡[9-12]。且Notch信号传导与转化生长因子-β1/Smad3信号传导之间存在相关作用[13]。然而miR-125a是否调控Notch1信号传导以调节MF尚不明确。
因此,本研究旨在分析MI后MF患者临床特点与miR-125a的关系,并研究miR-125a是否通过调控Notch1蛋白参与调控心脏成纤维细胞增殖凋亡及其活化,为miR-125a在MI后MF的干预提供理论支持。
1 材料与方法
1.1 临床资料 选取2015年10月-2018年10月佛山市南海区人民医院235例MI患者,其中115例为MF患者组,120例为非MF患者组,整理分析性别比例、BMI、高血压、糖尿病等危险因子信息,同时分析患者心电图特征,收集外周血并分离血浆后与病变组织共同冻存于-80 ℃备用。本研究经本院伦理委员会审核批准,所有患者均对本研究知情并签署知情同意书。
1.2 方法
1.2.1 切片染色分析和组织羟脯氨酸含量检测 取患者心脏组织50 mg,依据试剂盒(武汉塞维尔生物技术有限公司)说明书,进行羟脯氨酸含量检测。用4%多聚甲醛固定24 h,常规包埋、切片后,标准脱蜡、水化后进行Masson染色,封片并拍照。切片经柠檬酸盐溶液修复后,5%人血清封闭1 h,孵育α-SMA(1∶250,武汉三鹰生物技术有限公司)、Ⅰ型胶原(1∶200,武汉三鹰生物技术有限公司)4 ℃ 12 h,PBST漂洗3次,CY3标记兔抗人二抗(1∶500,武汉塞维尔生物技术有限公司)室温1 h并依据兔SP试剂盒(北京中杉金桥生物技术有限公司)操作进行免疫荧光和免疫组化实验。采用Image-Pro Plus 6.0分析其染色面积。
1.2.2 原代心脏成纤维细胞培养 取人心脏组织100 mg,剪碎后加入1 g/L胰酶(Thermo Fisher公司,美国)和0.8 g/L胶原酶Ⅳ(Thermo Fisher公司,美国),4 ℃消化30 min,加入10%胎牛血清(上海翊圣生物科技有限公司)的Dulbecco的改性Eagle营养混合物F-12培养基(Thermo Fisher公司,美国),用100目细胞过滤筛子过滤混合液,离心收集沉淀,接种于10 mm培养皿中,37 ℃、5%CO2培养,采用α-SMA和Vimentin(武汉塞维尔生物技术有限公司)鉴定心脏成纤维细胞。
1.2.3 CCK-8比色法检测细胞增殖 取第3代原代心脏成纤维细胞,每孔5 000个接种96孔培养板中,24 h后加入40 μmol/L的miR-125a抑制剂(广州锐博生物科技有限公司)和lipo2000(Thermo Fisher公司,美国)混合液处理于37 ℃、5% CO2培养箱中培养0、12、24、48和72 h后,加入CCK-8溶液(武汉塞维尔生物技术有限公司)37 ℃孵育1 h,采用酶标仪(Bio-Tek,美国)测定450 nm的吸光值(OD450)。每组设3个复孔,实验重复3次,以0 h为100%增殖率作参照计算增殖率。
1.2.4 Annexin Ⅴ/PI双标法和4′,6-二脒基-2-苯基吲哚染色检测细胞凋亡 取第3代原代心脏成纤维细胞,每孔2.5×106个接种6孔培养板中,24 h后加入40 μmol/L的miR-125a抑制剂和lipo2000混合液处理24 h,使用1 μg/mL的4′,6-二脒基-2-苯基吲哚(武汉塞维尔生物技术有限公司)染色后利用荧光显微镜进行形态学观察,通过形态学变化评价细胞凋亡。同时,以无酶消化液(武汉塞维尔生物技术有限公司)收集细胞,计数后调整细胞密度为1×106/mL,加Annexin Ⅴ-FITC(Ebioscience,美国)和PI各1 μL,4 ℃孵育30 min,离心漂洗后,以200 mL PBS重悬后,在流式细胞仪(ACEA,美国)测定早期凋亡细胞百分率。
1.2.5 Western Blot检测蛋白的表达 取第3代原代心脏成纤维细胞,每孔2.5×105个接种24孔培养板中,24 h后加入0、20、40、60、80和100 μmol/L的miR-125a抑制剂和lipo2000混合液处理,于37 ℃、5% CO2培养箱中培养24 h,12孔板接种细胞加入20 ng/mL的转化生长因子-β1(武汉罗德生物科技有限公司)处理6 h后,转染40 μmol/L miR-125a抑制剂24 h,收集细胞加入含磷酸化酶抑制剂(武汉塞维尔生物技术有限公司)和Cocktail的RIPA总蛋白裂解液(武汉塞维尔生物技术有限公司)60 mL,冰上裂解20 min,细胞刮收集至1.5 mL EP管,超声破碎,10 000×g、4 ℃离心20 min,取上清液至1.5 mL EP管,以BCA试剂盒(武汉塞维尔生物技术有限公司)检测蛋白浓度,各组取20 mg蛋白,热变性后于10%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,200 mA转膜2 h后封闭,加入一抗(Notch1、α-SMA、CollagenⅠ和Smad2/3稀释比为1∶1 000,p-Smad2/3稀释比为1∶500(R&D公司,美国);GAPDH稀释比为1∶2 500(武汉三鹰生物技术有限公司),4 ℃过夜,洗膜,加入HRP标记二抗(武汉塞维尔生物技术有限公司)室温下作用1 h后ECL显影曝光(Bio-Rad,美国)。以ImageJ分析条带灰度值,统计分析蛋白的表达量,每组实验重复3次。
1.2.6 qRT-PCR检测miR-125a表达 收集患者血浆和组织,按照Trizol一步提取试剂盒(武汉塞维尔生物技术有限公司)提取总RNA并使用NanoDrop2000对RNA浓度和纯度进行检测。参照第一链cDNA合成试剂盒(Thermo Fisher公司,美国)操作步骤将300 ng总RNA逆转录为cDNA。取10 ng cDNA作模版,10 μL qRT-PCR反应体系,SYBGreenⅠ染料(TaKaRa,中国)检测miR-125a水平,反应程序:95 ℃、3 min,95 ℃、5s,60 ℃、30 s,扩增35个循环。以U6为内参,采用2-△△Ct法计算miR-125a相对表达量,每个样本复孔3个,产物用含Goldview(武汉塞维尔生物技术有限公司)的2%琼脂糖凝胶电泳鉴定。
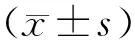
2 结果
2.1 MI后MF患者临床特征分析 本研究中MI后MF患者与MI后非MF患者相比,无明显年龄、性别、BMI和高血压等危险因子显著性差别,表1。

表1 两组患者的临床特征
2.2 MI后MF患者心脏重构和ECM检测 MI后MF患者心脏组织羟脯氨酸、α-SMA和CollagenⅠ含量显著高于MI后非MF患者,Masson染色显示,其心脏组织重构明显高于MI后非MF患者,图1。

图1 MI后MF的ECM特征与MI后非MF比较,*P<0.05
2.3 MI后MF患者的超声心电图特征分析 MI后MF患者与非MF患者相比,心率、每搏输出量、分数缩短、心输出量CO和心脏指数无明显的变化,左心室收缩压显著升高和舒张压显著降低,收缩末期容积、舒张末期容积、射血分数、舒张期末室间隔厚度和左室后壁厚度显著升高,表2。

表2 两组患者的超声心电图表征
2.4 MI后MF患者miR-125a含量检测 MI后MF患者与非MF患者相比,外周血和组织中miR-125a含量显著升高,图2。

图2 miR125a在MI后MF中表达上调与MI后非MF比较,***P<0.001
2.5 miR-125a含量与心功能和纤维化相关性 MI后MF患者显著升高的miR-125a含量与左心室收缩压、收缩末期容积、舒张末期容积、射血分数显著正相关,与左心室舒张压呈显著负相关。与心脏组织HYP、α-SMA和CollagenⅠ含量呈显著正相关,表3。

表3 miR-125a与心功能和纤维化相关分析
2.6 miR-125a对原代心肌成纤维细胞Notch1蛋白表达的影响 40、60、80、100 μmol/L的miR-125a抑制剂组miR-125a表达量明显低于0浓度的miR-125a抑制剂组,Notch1蛋白表达量明显高于0浓度的miR-125a抑制剂组,同时具有剂量依赖性,图3。

图3 miR-125a抑制剂下调心肌成纤维细胞miR-125a和上调Notch1蛋白表达与0 浓度组比较,*P<0.05
2.7 miR-125抑制剂对原代心肌成纤维细胞增殖和凋亡影响 40 μmol/L的miR-125a抑制剂处理组细胞增殖率在24、48和72 h明显低于40 μmol/LmiR-NC组(对照组),且具有时间依赖性。在24 h,其细胞核固缩和Annexin Ⅴ+PI-细胞比例明显高于对照组水平,图4。

图4 miR-125a抑制剂抑制心肌成纤维细胞增殖和促进其凋亡与对照组比较,*P<0.05,***P<0.001
2.8 miR-125抑制剂对转化生长因子-βb1激活的原代心肌成纤维细胞Notch1、p-Smad2/3、α-SMA和CollagenⅠ蛋白影响 转化生长因子-β1和40 μmol/L的miR-125a抑制剂联合处理组的Notch1明显高于转化生长因子-βb1和40 μmol/L的miR-NC联合处理对照组,p-Smad2/3、α-SMA和CollagenⅠ蛋白含量明显低于转化生长因子-β1和40 μmol/L的miR-NC联合处理对照组,图5。

图5 miR-125a抑制剂抑制转化生长因子-β1激活的心脏成纤维细胞中的Notch1,p-Smad2/3,α-SMA和Collagen Ⅰ表达与对照组比较,*P<0.05
3 讨论
MI后MF是心脏功能障碍和死亡的主要原因[14]。心脏成纤维细胞增殖激活是MF发生发展的关键过程[15-16]。明确心脏成纤维细胞增殖和激活的机制将为MF相关心脏病变的预防和治疗提供重要线索。
miRNAs在多种类型疾病中发挥着预防、调控与预测病程的作用[5]。本研究中,首先通过对MI后非MF和MF患者血浆以及组织中miR-125a表达分析发现,MF患者高表达miR-125a,提示其可能参与MF的发生发展。这与文献中报道miR-125a调控纤维化病变相符[8]。其次,本研究分析了其与心电图特征和ECM含量关系,证实其显著相关,从而证明其可能作为MF的治疗和监测生物标志物,是否真的对病程有一定的指示仍有待进一步证实。Notch信号和转化生长因子-β1/Smad3信号传导可诱导心脏成纤维细胞增殖激活并介导MF[13]。然而,miR-125a是否调控二者尚不明确。早期研究表明,转化生长因子-β1诱导的新生大鼠心脏CMT中Notch1表达下调[17]。此外,成年小鼠的应激心脏中的Notch活化抑制转化生长因子-β1诱导CMT和MF。为了阐明miR-125a是否调节Notch1和转化生长因-β1/Smad3信号传导参与MF形成[18]。本研究检测了miR-125a抑制剂对人原代心脏成纤维细胞增殖凋亡和活化的影响,结果显示,miR-125a抑制剂具有时间依赖性,抑制人原代心脏成纤维细胞增殖的作用,且可促进凋亡。同时具有阻断转化生长因子-β1激活的心脏成纤维细胞分泌胶原等ECM的作用。因此,miR-125a参与调控人原代心脏成纤维细胞增殖、凋亡及其活化和分泌ECM。
总之,使用MI后MF患者血液和组织及转化生长因子-β1诱导的人原代心脏成纤维细胞激活模型,本研究证明miR-125a通过调控Notch1信号参与心脏成纤维细胞激活和增殖凋亡。miR-125a是否具有调控其他信号蛋白及Notch信号及其下游信号分子如何参与MF仍需要进一步研究。
