3c型糖尿病六例临床分析
2021-02-25曾玲陆泽元庄雄杰柳岚蒋凤秀林新杰刘丹丹
曾玲 陆泽元 庄雄杰 柳岚 蒋凤秀 林新杰 刘丹丹
3c型糖尿病(T3cDM)是指继发于胰腺外分泌功能不全的糖尿病,又称为胰源性糖尿病[1],其病因包括急性或慢性胰腺炎、血色病、胰腺发育不良、胰腺外伤、胰腺切除、胰腺肿瘤、胰腺囊性纤维化和胰腺纤维钙化等。既往研究结果认为T3cDM患病率较低,仅占糖尿病患者的0.50%~1.15%[2]。但随着慢性胰腺炎发病率的上升,T3cDM已成为近几年研究的热点。国外研究资料显示糖尿病人群中T3cDM患病率为5%~10%[3],我国目前仅有个案报道,尚缺乏相关的大规模研究。本研究回顾性分析我院自2012年1月~2019年5月收治的6例T3cDM患者的临床资料,以期提高临床医师对本病的认识。
对象与方法
1.对象:2012年1月~2019年5月在我院诊治的T3cDM患者6例。纳入标准:(1)伴腹泻、营养不良、体重明显下降等胰腺外分泌功能缺陷;(2)胰腺影像学(超声、MRI、CT)检查发现病理表现;(3)1型糖尿病相关自身免疫标志物阴性;(4)胰岛β细胞功能受损;(5)血清脂溶性维生素水平低下。
2.方法
(1)临床资料收集:入院时收集患者的临床资料,包括年龄、性别、发现胰腺病变时间、合并症及合并疾病、糖尿病病史、胰腺炎发作史、既往高血脂及高血压病史、吸烟史及饮酒史、家族史、入院前误诊为2型糖尿病(T2DM)病程、入院前治疗方案、胰腺病变类型、发病特点、伴随症状等。测量患者身高、体重、腰围,计算BMI。
(2)实验室检查:入院时采用强生稳豪血糖仪检测患者随机末梢血糖,采用沃芬GEM3500血气分析仪对患者动脉血进行血气分析。所有患者禁食8 h,于入院次日清晨采集肘静脉血,采用糖化血红蛋白(HbA1c)检测试剂盒(TW041572)检测HbA1c水平;采用血酮检测仪测定血酮水平;采用全自动生化分析仪检测二氧化碳结合力(CO2-CP);采用血脂检测试剂盒(YS-E91882)检测总胆固醇(TC)、甘油三酯(TG)水平;精氨酸刺激试验采用精氨酸检测试剂盒(wu-eb120hu-s96)检测,包括空腹、2分钟、3分钟、4分钟C肽、5分钟C肽,计算胰岛第一时相分泌指数(AIR),AIR(ng/ml)=2~5分钟C肽平均值(ng/ml)-空腹C肽(ng/ml);采用酶联免疫吸附试验(ELISA)检测糖尿病自身免疫抗体,包括胰岛素自身抗体(IAA)、谷氨酸脱羧酶抗体(GAD)。应用多联试纸条进行尿液常规检测,包括尿糖、尿酮;采用尿微量白蛋白分析仪检测尿微量白蛋白及尿肌酐水平,计算尿白蛋白/肌酐比值(UACR)。
(3)影像学检查:腹部超声及腹部CT在我院医学影像科由专科医生检查。
(4)治疗方法:患者住院期间指导其糖尿病饮食,佩戴美敦力胰岛素泵控制血糖。
结 果
1.临床资料:6例患者中男5例,女1例,平均年龄(48.3±4.6)岁。发现胰腺病变平均时间(3.4±1.1)年,其中胰管结石合并纤维化2例,胰胆管狭窄1例,慢性胰腺炎并胰腺钙化2例。长期饮酒者1例,饮酒史15年,因长期酗酒致反复慢性胰腺炎;有吸烟史者5例。尿酮阳性者2例。6例患者均无糖尿病酮症酸中毒发生,其中5例合并糖尿病周围神经病变,2例合并颈部动脉粥样硬化斑块形成,4例合并下肢动脉粥样硬化斑块形成。见表1。
2.临床表现:6例患者除糖尿病的表现外,还包括以下特点:(1)发病年龄为中老年,血糖升高后多伴有糖尿病症状(口干、多饮、多尿、体重下降),均在入院前误诊为T2DM,误诊的平均病程为(5.1±1.8)年;(2)入院体格检查发现6例患者体型消瘦,平均BMI为(17.3±0.4)kg/m2,例1、例2及例5经常伴恶心、腹胀、脂肪泻、体重下降;例3、例4伴腹胀、脂肪泻、体重下降;例6有体重下降等胰腺外分泌功能不全表现;(3)6例患者中入院时有2例为尿酮阳性,1例血酮达1.4 mmol/L,但均无糖尿病酮症酸中毒发生。6例患者住院期使用胰岛素治疗时血糖波动幅度均较大,其中2例患者曾出现低血糖,最低血糖<2.5 mmol/L。见表1。
3.实验室检查结果:6例患者入院时平均随机末梢血糖水平为(22.3±3.7)mmol/L,4例患者血糖水平均>16.7 mmol/L,例4、例5尿酮阳性,例4血酮水平为1.4 mmol/L;血气分析结果显示6例患者均无酸中毒表现;平均HbA1c水平为(11.5±1.9)%;精氨酸刺激试验:平均空腹C肽水平为(0.220±0.034)ng/ml、平均2分钟C肽水平为(0.268±0.044)ng/ml、平均3分钟C肽水平为(0.306±0.057)ng/ml、平均4分钟C肽水平为(0.349±0.055)ng/ml、平均5分钟C肽水平为(0.357±0.053)ng/ml,平均胰岛第一时相分泌指数(AIR)为(0.107±0.027)ng/ml;IAA、GAD检查结果均为阴性;平均TG水平为(4.8±3.4)mmol/L,平均TC水平为(5.7±1.5)mmol/L。见表1。
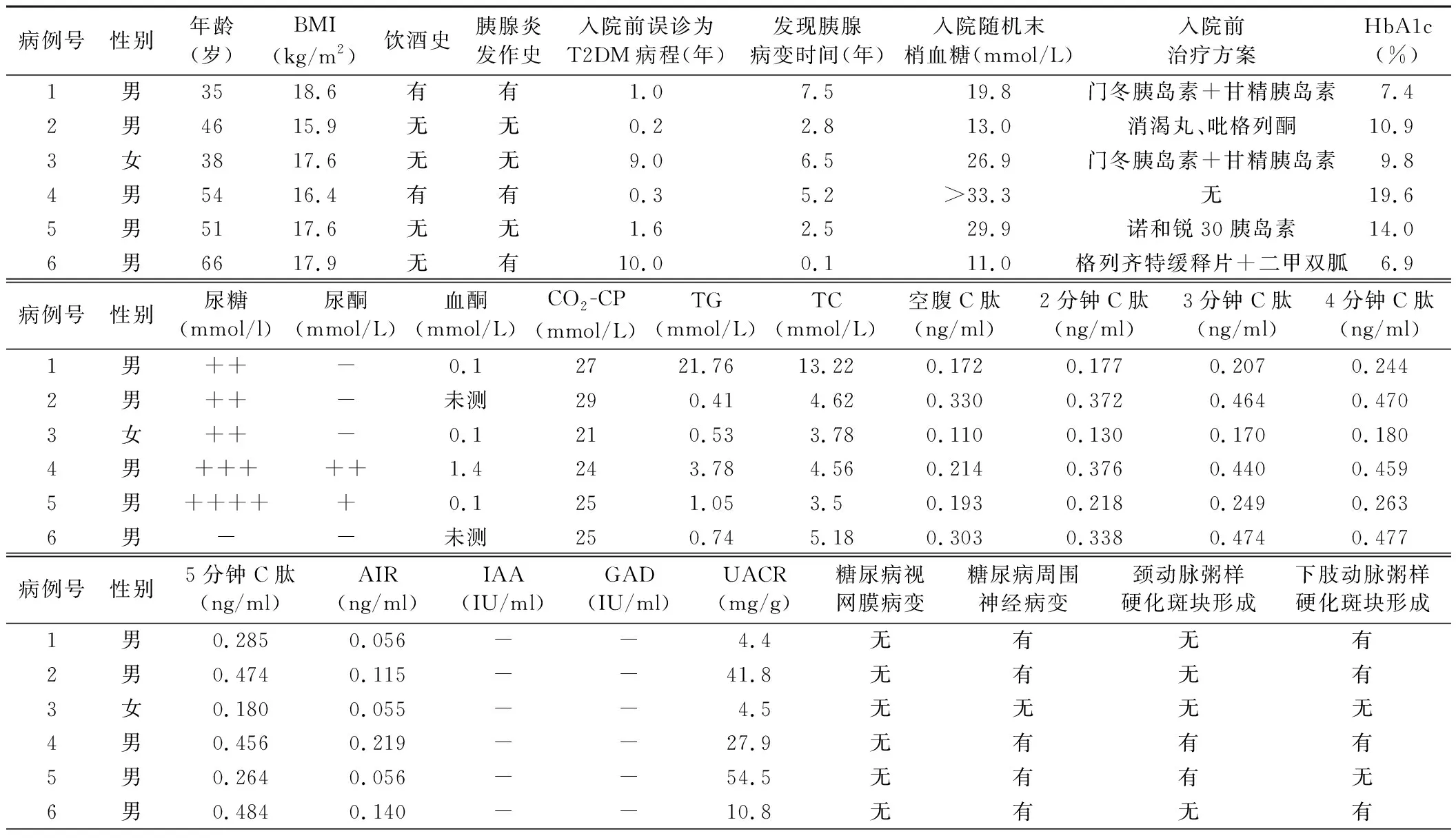
表1 6例T3cDM患者临床资料及实验室检查结果
4.影像学检查结果:6组患者均行胰腺超声和(或)CT检查,结果显示,例1因长期酗酒引起反复酒精性胰腺炎,致胰腺钙化,胰管扩张改变;例2因胰管多发结石引起反复慢性胰腺炎,致胰腺萎缩、纤维钙化;例3因胰管结石致胰腺萎缩,呈慢性胰腺炎改变;例4因胰胆管狭窄引起慢性胰腺炎,致胰腺萎缩,形态不规则;例5因胰腺钙化,胰管扩张呈慢性胰腺炎改变;例6因胰管多发结石引起慢性胰腺炎,致胰腺纤维钙化。见表2。

表2 6例T3cDM患者胰腺超声和CT检查结果
5.治疗过程:6例患者住院期间均使用胰岛素泵调控血糖,在使用胰岛素治疗期间检测血糖波动幅度较大,2例患者出现低血糖,且低血糖与高血糖交替出现。6例患者均严格饮食控制,加强血糖监测以更精细地调整胰岛素用量。例5合并右足感染,胰岛素用量较其他患者多。出院后例1、例2、例3、例4、例5均采用三餐前谷赖胰岛素/门冬胰岛素+睡前甘精胰岛素皮下注射;例3联合口服二甲双胍0.25 g每日3次的治疗方案;例6采用甘精胰岛素联合二甲双胍片0.5 g每日3次的治疗方案,并定期门诊及电话随访。例1、例2、例4在随访过程中监测到血糖波动幅度较大,追问其饮食及用药情况,例1、例4仍间断反复饮酒,未规律使用胰岛素,加上未严格控制饮食,导致血糖波动幅度较大;例2反复腹胀、腹泻、食欲差等胰腺外分泌功能不全的表现严重,饮食无法严格控制,引起血糖波动幅度较大;例3血糖控制较平稳;例5未规律监测血糖,偶有腹胀不适;例6监测血糖水平为4-15mmol/L,波动幅度较大。
讨 论
1999年世界卫生组织(WHO)将糖尿病分为1型糖尿病(T1DM)、T2DM、其他特殊类型糖尿病(3型)和妊娠糖尿病。而继发于胰腺外分泌疾病的糖尿病,称为T3cDM,又称为胰源糖尿病[4]。慢性胰腺炎是T3cDM最主要的病因,约占全部T3cDM的75%,其中酒精性胰腺炎和热带胰腺炎最容易发生糖尿病[5]。由于T3cDM临床症状不典型,既往对其认识不足及胰岛外分泌功能筛查方法不成熟,易被误诊或漏诊。国外回顾性研究结果显示,T3cDM的正确诊断率仅为51.2%,多数被误诊为T2DM[5]。本研究6例患者中误诊为T2DM的平均病程为(5.1±1.8)年,发现胰腺病变的平均时间为(3.4±1.1)年,在明确胰腺病变前均被误诊为T2DM。目前国内外尚缺乏T3cDM公认统一的诊断和鉴别诊断标准。2013年Ewald等[6]首次提出了胰源性糖尿病的诊断标准:主要标准(必须符合):胰腺外分泌功能不全(粪弹性蛋白酶测定或直接胰腺外分泌功能试验阳性);存在胰腺组织的影像学改变(超声内镜、MRI、CT);排除T1DM。次要标准:(1)胰多肽分泌不足;(2)肠促胰岛素分泌受损;(3)胰岛素抵抗;(4)β细胞功能受损;(5)血清脂溶性维生素A、D、E、K降低。而国内王璐等[7]也提出T3cDM诊断应符合以下5项:(1)有相应胰腺疾病或胰腺手术的病史且合并血糖升高;(2)既往无糖尿病病史;(3)胰岛细胞自身免疫抗体阴性;(4)有胰腺外分泌功能缺陷;(5)典型的病理学表现或影像学表现明确胰腺病变。但目前国内外尚无明确诊断胰腺外分泌功能不全的检测方法,国内大部分医院也未常规开展粪弹性蛋白酶测定或直接胰腺外分泌功能试验等相关检测,本院也未开展粪弹性蛋白酶测定等筛查,因而本研究中6例患者无法完全满足Ewald等[6]提出胰腺源性糖尿病的诊断标准,但根据入选6例患者的BMI、C肽功能及胰腺影像学病变均符合T3CDM的临床特点可确诊。本研究中的6例患者均在发现胰腺慢性病变前被误诊为T2DM,数年后因胰腺炎发作行胰腺CT检查才明确胰腺病变。6例患者入院时均体型消瘦,平均BMI为(17.3±0.4)kg/m2,C肽功能反应差,而胰岛细胞抗体为阴性,并伴有程度不等的腹胀、脂肪泻、体重明显下降、营养不良等胰腺外分泌功能不全表现;腹部超声和(或)CT检查结果明确胰腺病变。结合病史、临床特征及相关检查结果,均符合以上T3cDM的诊断标准。
T3cDM被列入“特殊类型糖尿病”,其糖尿病的临床表现往往不典型,且胰岛素分泌和代谢特点独特,使其临床表现、并发症和预后与T1DM、T2DM不同,尤其是发生胰腺癌的风险显著增加。这是由于糖尿病和慢性胰腺炎都是胰腺癌的危险因素,两者的结合可能会进一步增加胰腺癌的进展[1]。本研究中6例患者糖尿病并发症的表现各不相同,对于T3cDM靶器官并发症,由于数据稀少,仅一项前瞻性研究糖尿病视网膜病变的结果发现发生糖尿病视网膜病变风险为37%,发生糖尿病肾病的风险为29%,发生外周动脉疾病的风险为26%,但由于研究数据有限,因此对现有数据的推断不可靠,未来研究应将吸烟、高血压、高血脂、肥胖等影响并发症的因素与T3cDM同时进行研究[8]。
目前的研究认为,由于长期慢性炎症、纤维化及钙化导致胰岛细胞受损,胰岛β细胞数量和分泌功能下降,胰岛素分泌减少,不能满足机体的需要而出现糖耐量减低和糖尿病;PP细胞分泌胰多肽障碍导致胰源性糖尿病患者出现肝脏胰岛素抵抗,而外周胰岛素敏感性增加;胰腺病变或切除导致胰岛α细胞破坏,胰高血糖素分泌减少,致使胰源性糖尿病患者在接受糖尿病治疗时易发生严重而持续的低血糖;同时葡萄糖依赖胰岛素多肽(GIP)和胰高血糖素样肽1(GLP-1)分泌减少,致T3cDM患者易出现腹胀、脂肪泻等消化不良症状[9-11]。本研究中6例患者胰腺影像学检查结果提示胰腺慢性炎症、纤维钙化、胰腺萎缩等慢性病变,其C肽功能较暴发性T1DM患者差,但胰岛细胞抗体阴性,均未以糖尿病酮症酸中毒起病,住院期间使用胰岛素泵调控血糖过程中血糖波动幅度大,表现为脆性糖尿病,考虑可能与胰岛β细胞受损致胰岛素分泌相对不足、残存的胰岛素尚足以预防糖尿病酮症酸中毒的发生有关,这也表明T3cDM的发生与胰岛素绝对缺乏所导致的T1DM不同,其胰岛素水平及储备功能仍有保留,可能与胰腺疾病发生发展的不同时期胰岛细胞功能也具有相应不同的特点有关[12]。
目前尚缺乏T3cDM治疗相关指南,由于除了糖代谢异常,T3cDM患者还存在胰腺外分泌功能异常导致的胃肠道症状和营养不良,因此无法完全参照T1DM和T2DM的指南治疗。2012年Pancreas Fest会议提出T3cDM需制定个体化治疗方案,应根据患者的年龄、身体状况、进食情况、胰岛β细胞功能及肝肾功能等情况确定最佳治疗方案[13]。在本研究的6例患者中,1例胰管结石患者及1例胰胆管狭窄患者行局部手术治疗。综合考虑患者一般情况、肝肾功能及胰岛功能情况,例1~例5患者出院后采用皮下注射长效胰岛素+三餐前短效胰岛素,例3使用胰岛素治疗期间胰岛素抵抗明显,胰岛素用量大,在兼顾胰腺外分泌功能情况下加用小剂量二甲双胍改善胰岛素抵抗,同时降低癌症风险。例6患者采用皮下注射甘精胰岛素联合口服二甲双胍片0.5g每日3次控制血糖,并定期门诊及电话随访。
综上所述,T3cDM是继发于胰腺病变的一种临床并发症,胰岛细胞功能特点可能随着胰腺病变的程度及时期的不同而不同。目前其具体的发病机制尚未明确,临床上仍缺乏有效的诊断方法和预测指标。通过相关病例分析,对于长期饮酒、消瘦、脂肪泻、营养不良伴血糖升高表现的患者应考虑T3cDM可能,及早诊断并给予相应治疗。
