普通烟草NtWRKY53基因克隆、鉴定及表达分析
2021-02-25刘万峰蒲文宣杨爱国高军平孙明铭张新要王国平李晓旭
刘万峰 ,蒲文宣,杨爱国,高军平,王 奇,孙明铭,张新要,孙 楠,陈 凯,王国平,3,李晓旭*,
1.湖南中烟工业有限责任公司技术中心,长沙市劳动中路386号 410007
2.中国农业科学院烟草研究所 烟草行业烟草基因资源利用重点实验室,山东省青岛市崂山区科苑经四路11号 266101
3.玉溪中烟种子有限责任公司,云南省玉溪市南翔路14号 653100
WRKY转录因子家族是一类植物特有的转录因子家族,其家族成员在N端具有1个或者2个高度保守的WRKY结构域(WRKYGQK),其命名也来源于该结构域[1]。WRKY转录因子家族成员在C端有C2H2或者C2HC型的锌指结构[1-2]。据报道WRKY转录因子能够结合W-box(TTGACC/T)顺式元件,进而调控下游基因的表达[3]。WRKY转录因子家族成员在真菌性、细菌性和病毒性病原物引发的植物生物逆境应答中起重要作用[4-5]。在拟南芥中,WRKY转录因子AtWRKY3和AtWRKY4编码基因受灰霉病(Botrytis)和水杨酸(SA)诱导表达,并且与野生型相比wrky3、wrky4单突变体及wrky3/wrky4双突变体接种灰霉病后表型表现更加严重,说明其对灰霉病抗性具有正向调控作用[6-7]。转录因子AtWRKY70编码基因能够被二孢白粉菌(Erysiphe cichoracearum)所诱导,AtWRKY70基因过表达能够增强对二孢白粉菌的抗性[8-9]。此外,丁香假单胞菌(Pseudomonas syringae)侵染拟南芥时,AtWRKY25基因高量表达,而AtWRKY25基因过表达能够增加对丁香假单胞菌的抗性[10]。同时,WRKY转录因子家族成员也参与非生物逆境胁迫响应[11-12]。在拟南芥中,由生物逆境诱导的基因AtWRKY25同样也被干旱胁迫以及热胁迫所诱导,AtWRKY25过表达时能显著提高转基因拟南芥的耐旱能力[13-14]。在水稻中研究发现OsWRKY30基因参与干旱胁迫,该基因过表达可以显著提高耐旱性[15]。另外,WRKY转录因子家族成员也参与植物衰老过程的调控。在拟南芥中,AtWRKY54和AtWRKY70作为负调控因子调控拟南芥的叶片衰老过程[16]。此外,转录因子AtWRKY53编码基因在衰老时期表达量上调,wrky53突变体具有晚衰表型,并且该基因过表达能够促进叶片衰老[17-18]。有研究表明参与叶片衰老调控的AtWRKY53基因,同样能被丁香假单胞菌诱导表达。同时,相对于野生型,wrky53/wrky46双突变体对丁香假单胞菌更为敏感,说明AtWRKY53基因可能同时调控生物逆境应答和叶片衰老。此外,在禾本科植物紫花针茅中,SpWRKY53基因受盐和干旱等非生物胁迫的诱导,并且SpWRKY53基因过表达可以显著促进叶片的衰老[19]。另有研究表明,小麦TaWRKY53b基因在叶片衰老期显著上调,说明该基因可能在调节小麦叶片衰老中起重要作用[20]。在水稻中,OsWRKY53过表达的水稻植株对稻瘟病的抗性明显增强[21]。在玉米中,不同的非生物胁迫如低温、NaCl、H2O2和PEG均能显著诱导ZmWRKY53基因的表达,并且在接种玉米纹枯病的叶片中ZmWRKY53基因的表达量也有显著提高[22]。
烟草是重要的经济作物,在生长发育过程中会受外界逆境胁迫而影响产量和品质[23-25]。同时,烟草收获的对象是落黄成熟的叶片,烟叶成熟落黄对品质特征等起重要作用[26-28]。为此,采用比较基因组学的方法,在普通烟草中鉴定、克隆NtWRKY53基因,并对其保守结构域、进化关系、共线性、亚细胞定位、转录激活以及基因表达模式进行分析,旨在明确烟草逆境胁迫、叶片落黄的调控机制,为烟草育种提供依据。
1 材料与方法
1.1 材料、试剂和仪器
普通烟草K326为主栽品种,用于后续非生物胁迫处理;台烟8号为CMV抗性品种[29],用于CMV接种处理;雪茄烟Beinhart1000-1为黑胫病抗性品种[30],用于黑胫病接种处理。
pCHF3-cGFP、pBridge载体、农杆菌GV3101以及酵母AH109菌株由本实验室保存。pBlunt0载体、大肠杆菌感受态购自北京全式金有限公司。Trizol购自美国Invitrogen公司。PrimeScriptTM反转录试剂盒、SYBR Green Ex TaqTM荧光定量试剂盒、高保真pfu酶、质粒提取试剂盒、胶回收试剂盒购自大连宝生物公司。Infusion连接试剂盒、酵母SD培养基、色氨酸缺失物、X-Gal等购自日本Clonetech公司。限制性内切酶购自美国Thermo Fisher公司。引物合成和载体测序由北京六合华大基因有限公司完成。荧光定量PCR仪为美国ABI公司的ABI 7500型,激光共聚焦显微镜为德国Leica公司的TCS-SP8型。
1.1.1 非生物胁迫处理
试验设置在中国农业科学院烟草研究所烟草行业烟草基因资源利用重点实验室,采用盆栽将普通烟草K326种植于光照培养箱中。光周期设置为16 h光照/8 h黑暗,温度设置为24 ℃。在烟株现蕾期采集茎尖、茎、根尖、根、幼嫩叶片和衰老叶片等,液氮迅速冷冻后放置于-80 ℃冰箱保存备用;普通烟草K326种子由本实验室保存,在MS固体培养基中萌发,待幼苗长至6片真叶时,将其在MS液体培养基中悬浮培养5 d。参考文献[31]进行非生物逆境及激素处理。干旱处理:将悬浮培养5 d的烟草幼苗放于吸水滤纸上模拟干旱处理,以未经处理的烟草幼苗为对照,分别在1 h、6 h、12 h采样,每组采集3株长势相近的整株幼苗;盐处理:将悬浮培养5 d的烟草幼苗转移至含有0.05 mol/L NaCl的MS溶液中进行处理,以未经处理的烟草幼苗为对照,分别在1 h、6 h、12 h采样,每组采集3株长势相近的整株幼苗;冷胁迫、热胁迫处理:将悬浮培养5 d的烟草幼苗转移至新的MS溶液中,随后放入4 ℃、37 ℃培养箱中,以未经处理的烟草幼苗为对照,分别在1 h、6 h、12 h采样,每组采集3株长势相近的整株幼苗;ABA激素处理:将悬浮培养5 d的烟草幼苗转移至含有10-5mol/L ABA的MS溶液中进行处理,以未经处理的烟草幼苗为对照,分别在1 h、6 h、12 h采样,每组采集3株长势相近的整株幼苗。以上所有样品均经液氮冷冻后放置于-80 ℃冰箱保存。
1.1.2 CMV接种
参考文献[29]进行烟草CMV接种,接种毒源为CMV亚组I的Fny株系(CMV-Fny),普通烟草台烟8号种子由本实验室保存,以空白接种液接种的烟草植株为对照。接种方法:待烟苗处于6片真叶期时,在叶片上均匀撒上石英砂,选取最上面2片充分展开的真叶为接种叶,用脱脂棉蘸取接毒液轻轻摩擦2遍,1 h后用清水将叶片表面残留的石英砂冲洗干净。接病后在1、3和5 d时采样,每组采集3株病情相近植株的叶片组织。
1.1.3 黑胫病接种
参考文献[30]进行黑胫病接种,接种毒源为黑胫病菌0号生理小种(由本实验室保存),接种品种为Beinhart1000-1,以未接种的烟草植株为对照。接种方法:在6片真叶期烟苗周围5 cm处,将长柄勺子竖直插入土壤中进行伤根处理,随后取菌谷放入土壤,立刻覆土、灌水保湿。接病后分别在1、3和5 d时采样,每组采集3株病情相近植株的根部组织。
1.2 方法
1.2.1 RNA提取及cDNA的制备
将采集的组织和逆境胁迫处理样品从-80 ℃冰箱取出,在液氮中研磨成粉末。使用Trizol试剂盒提取总RNA并去除基因组DNA,使用PrimeScript反转录试剂盒进行反转录,将反转录的cDNA稀释至25 ng/μL备用。
1.2.2 NtWRKY53基因的克隆
在茄科植物基因组数据库(http://solgenomics.net/)下载普通烟草K326蛋白序列(Nitab-v4.5 proteins),以拟南芥AtWRKY53的蛋白全长序列为query,进行本地BLASTP比对,得到候选基因(Nitab4.5_0000223g0340),基于得到的候选基因序列,设计相应扩增引物。上游引物:5′-ATGGATTGTGGTTTCAATTGG-3′,下游引物:5′-TTATCTGAAAAATTCTGAGTT-3′,使用pfu高保真酶进行目的基因克隆,扩增后完成胶回收。取8 μL WRKY53基因扩增胶回收产物与2 μL pBlunt0平端载体混合,在PCR仪中25 ℃反应20 min完成连接反应,将连接产物全部加入100 μL大肠杆菌感受态细胞中,并完成转化,在含有100 µg/mL卡那霉素(Kan)的LB固体培养基平板上进行抗性筛选,对阳性单克隆使用目的基因扩增引物进行PCR鉴定,将经过鉴定的阳性克隆进行测序。
1.2.3 系统发育分析
普通烟草NtWRKY53基因所编码的转录因子的序列特征通过在线程序ProtParam(https://web.expasy.org/protparam/)进行预测分析,包括其等电点、分子量等理化性质;在拟南芥TAIR数据库(www.arabidopsis.org)和NCBI(http://solgenomics.net/)中下载拟南芥AtWRKY53(ACF20468)、AtWRKY6(AF331713)、AtWRKY31(ACF20468)和其他物种中相关WRKY转录因子的蛋白序列,包括水稻 OsWRKY53(DAA05118)、小麦TaWRKY53(AGF90798)、玉米ZmWRKY53(NP_001147551)、紫花针茅SpWRKY53(AOZ56938)以及 番 茄 SlWRKY53 (XP_004244630)、葡萄VvWRKY53(RVW26716)、苹 果 MdWRKY53(RXH95720)。参照文献[31]使用MAFFT完成多序列比对,利用Texshade将多序列比对结果进行可视化,分析其保守的WRKY结构域。基于多序列比对结果,使用MEGA v6.06构建邻接树(Neighbor-Joining,NJ tree),参数设置:Poisson模型,Pairwise Deletion,Bootstrap Value设置为1 000次;同时在默认参数下,利用MEME(http://meme-suite.org/)在线程序对上述序列进行保守基序(motif)预测分析。
1.2.4 共线性分析
在拟南芥基因组数据库(https://www.arabidopsis.org/)和茄科基因组数据库分别下载拟南芥和普通烟草K326基因组注释信息,参考文献[32]利用McScan X在默认参数下进行拟南芥和普通烟草基因组的共线性分析。
1.2.5 亚细胞定位分析
参考文献[31]对转录因子NtWRKY053进行亚细胞定位分析。以Blunt-NtWRKY53为模板,对不含终止密码子的NtWRKY53基因CDS序列进行PCR扩增,使用Infusion重组酶,将目的片段连接到pCHF3-cGFP亚细胞定位载体上,构建35S ∷NtWRKY53-cGFP融合表达载体,转化大肠杆菌感受态细胞后,进行阳性筛选,将测序正确的重组质粒转化根癌农杆菌GV3101,在含有100 µg/mL壮观霉素(Spec)和50 µg/mL利福平(Rif)的YEP固体平板上进行抗性筛选,通过PCR进行阳性鉴定。参考文献[33]在本氏烟叶片中进行瞬时表达,以含有35∷GFP质粒的农杆菌菌株为对照,将含有重组质粒的农杆菌和对照分别以200 r/min振荡12 h后,5 000 r/min离心3 min集菌,用重悬液重悬后,分别注射到叶片背部,避光12 h。随后取注射叶片材料,在Leica激光共聚焦显微镜TCS-SP8下对荧光信号(DAPI、GFP)进行观察,激发光波长分别选择405 nm和488 nm。
1.2.6 转录激活实验
参考文献[31]对转录因子NtWRKY053进行转录活性分析。以Blunt-NtWRKY53为模板,对NtWRKY53基因全长CDS序列进行扩增,胶回收纯化后,使用Infusion重组酶连接到pBridge载体中,构建NtWRKY53-GAL4BD融合表达载体,在含有氨苄青霉素(Amp)的LB平板上进行抗性筛选后,用PCR鉴定阳性克隆并测序。以pBridge空载体为对照,将测序正确的重组质粒转入酵母AH109感受态细胞中,在-Trp缺陷平板(SD/-Trp)上进行营养缺陷筛选,随后将所筛选的阳性克隆转移至显色培养基(SD/-Trp/X-gal)上进行显色分析。
1.2.7 表达模式分析
根据NtWRKY53基因的CDS序列,利用Primer premier 5设计特异性荧光定量检测引物,上游引物序列:5′-TCAAGAAACAAGCCAACAATCCAAA-3′,下游引物序列:5′-TGACGGCGAATAACCTCC TACCAAA-3′。参考文献[34],采用普通烟草NtEF1α基因(GenBank ID NM001326165)作为管家基因。各个组织及处理独立进行3次生物学重复,每组生物学重复为独立样本并单独提取RNA,同时荧光定量实验设置3次技术性重复。基于2-ΔΔCt法计算NtWRKY53基因的相对表达量。
2 结果与分析
2.1 NtWRKY53基因的克隆及分析
以拟南芥AtWRKY53的蛋白序列进行本地BLASTP比对,鉴定得到NtWRKY53蛋白,其与AtWRKY53具有59%的相似性。基于普通烟草K326数据库比对结果,设计NtWRKY53基因特异性扩增引物进行PCR扩增。以不含cDNA模板的扩增体系作阴性对照,扩增片段大约1 000 bp左右。将扩增片段经过胶回收纯化后,将其连接到pBlunt0平端载体,并对阳性菌落进行测序。结果(图1)表明,NtWRKY53基因的CDS序列全长1 095 bp,由364个氨基酸组成。利用ProtParam在线工具分析NtWRKY53蛋白的理化性质,其相对分子质量为41 189.62 Da,理论等电点为5.60。
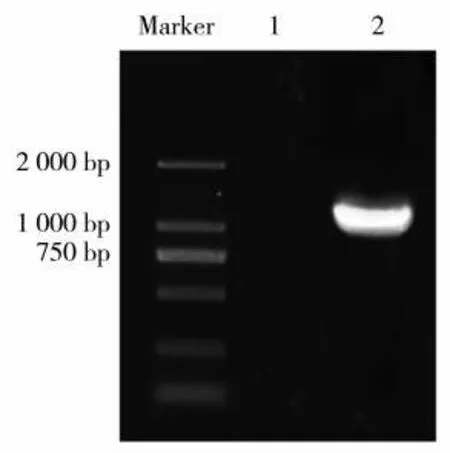
图1 NtWRKY53基因PCR扩增产物电泳图Fig.1 PCR electrophoretogram of NtWRKY53 gene
2.2 NtWRKY53转录因子的结构域分析
根据所鉴定的NtWRKY53蛋白序列,将其与其他物种中的相关WRKY53蛋白进行多序列比对(图2)。完全保守的氨基酸残基用黑色标注,相对保守的氨基酸残基用灰色标注,发现NtWRKY53基因所编码的蛋白具有典型WRKY结构域(WRKYGQK),在其C端具有保守的Cys2HisCys型锌指结构域。

图2 NtWRKY53转录因子WRKY结构域分析Fig.2 WRKY domain analysis of NtWRKY53 transcription factor
2.3 NtWRKY53的进化分析和保守基序分析
以拟南芥、番茄和水稻等物种中已报道的WRKY53转录因子和拟南芥中其他WRKY转录因子为参考,使用MEGA重建邻接树(图3)。参与进化分析的11个WRKY转录因子家族成员被分为2个亚类(Clade)和3个亚家族(Subgroup)。其中,NtWRKY53与文献报道的不同物种WRKY53转录因子均聚在Clade I中,烟草NtWRKY53与番茄StWRKY53、拟南芥AtWRKY53聚在一起,说明其直系同源。其中拟南芥 AtWRKY53、烟草NtWRKY53、番茄SlWRKY53和葡萄VvWRKY53等双子叶植物中的WRKY53聚在亚家族I中,而小麦TaWRKY53、水稻OsWRKY53和玉米ZmWRKY53等单子叶植物中的WRKY53聚在亚家族Ⅱ中,说明单子叶、双子叶植物中的WRKY53可能发生了结构及功能上的分化。
对参与进化分析的WRKY转录因子的保守基序(Motif)进行分析可以看出,同一亚家族内保守基序的种类和数目相似度较高,不同亚家族成员之间保守基序差异较大,也从侧面反映出进化分析的可靠性。值得注意的是,NtWRKY53和AtWRKY53的保守基序的组织形式高度一致,提示两者可能发挥着类似的生物学功能。
2.4 共线性分析
利用McScan X在默认参数下对拟南芥基因组和普通烟草K326基因组进行共线性分析(图4)。At1~At5分别代表拟南芥的5条染色体,Nt01~Nt24代表普通烟草的24条染色体。结果表明,普通烟草NtWRKY53基因与拟南芥AtWRKY53基因在拟南芥和普通烟草基因组的共线性区块中,存在共线性关系,进一步说明所鉴定的普通烟草NtWRKY53基因与拟南芥AtWRKY53基因直系同源。

图3 NtWRKY53转录因子系统进化及保守基序分析Fig.3 Phylogenetic and conserved motifs analyses of NtWRKY53 transcription factor

图4 普通烟草和拟南芥WRKY53基因的共线性分析Fig.4 Collinearity analysis of WRKY53 gene between Nicotiana tabacum and Arabidopsis
2.5 NtWRKY53亚细胞定位分析
构建了35S∷NtWRKY53-GFP融合表达载体,利用农杆菌侵染本氏烟草叶片,瞬时表达NtWRKY53-cGFP蛋白(图5)。BF为明场,细胞核特异性染料DAPI指示细胞核。35S∷GFP为阴性对照,其GFP荧光信号遍布整个细胞。而融合NtWRKY53的GFP蛋白信号只能在细胞核中观察到,并与细胞核染料DAPI的信号重叠,这说明NtWRKY53是一个核定位蛋白,符合其转录因子的特性。
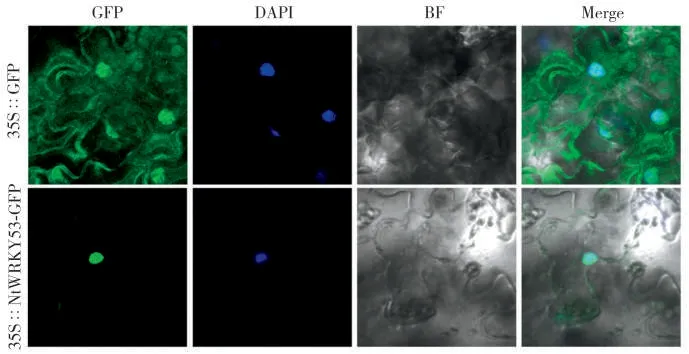
图5 NtWRKY53的亚细胞定位Fig.5 Subcellular localization of NtWRKY53
2.6 NtWRKY53转录因子的转录激活分析
在拟南芥中,AtWRKY53被报道具有转录激活活性,可调控下游基因表达[17-18]。在烟草中,对NtWRKY53转录因子的转录激活分析结果表明,GAL4BD-NtWRKY53(即融合表达NtWRKY53的酵母表达菌株)在显色培养基(X/-Trp)上能够正常生长,并且显示蓝色,表明转录因子NtWRKY53能够激活下游报告基因的表达(图6)。而GAL4BD对照酵母菌株在显色培养基(X/-Trp)上不显示蓝色,说明其不能激活报告基因表达。转录激活分析表明,NtWRKY53在酵母中具有转录激活活性。

图6 NtWRKY53酵母转录激活分析Fig.6 Transactivation assay of NtWRKY53 in yeast
2.7 NtWRKY53基因的表达模式分析
采集普通烟草K326的不同组织进行实时荧光定量PCR分析,以茎组织中目的基因表达量为参考,计算相对表达量。结果表明,NtWRKY53基因在茎(S)、根(R)、根尖(Rt)、幼叶(YL)和衰老叶片(SL)中表达,而在茎尖(St)中没有检测到目的基因表达(图7 A)。值得注意的是,相对于幼叶烟草衰老叶片中NtWRKY53基因表达量显著上调。
对NtWRKY53基因在非生物逆境胁迫条件下的表达分析发现,NtWRKY53基因的表达受多种非生物逆境胁迫的诱导(图7 B)。在0.05 mol/L NaCl盐胁迫下,NtWRKY53基因的表达量在处理6 h时达到对照(MOCK)的12.71倍左右,随后下降。在干旱胁迫下,NtWRKY53基因的表达量也出现先上调,后下降的情况。而在冷胁迫和热胁迫处理下,NtWRKY53基因的表达量逐渐下降。同时,激素脱落酸(ABA)处理下,NtWRKY53基因的表达也被诱导,在处理1 h后,表达量达到对照的6.07倍,随后下降。
对NtWRKY53基因在生物逆境胁迫条件下的表达分析发现,NtWRKY53基因的表达受多种生物胁迫的诱导(图7 C)。在接种CMV(CMV-Fny)后,NtWRKY53基因的表达量显著上调,在接种3 d时达到对照的6.7倍,在接种5 d时其表达量有所下降。在接种黑胫病(Black Shank,BS)1 d时,NtWRKY53基因的表达量为对照的4.2倍,之后表达量下降。
3 讨论
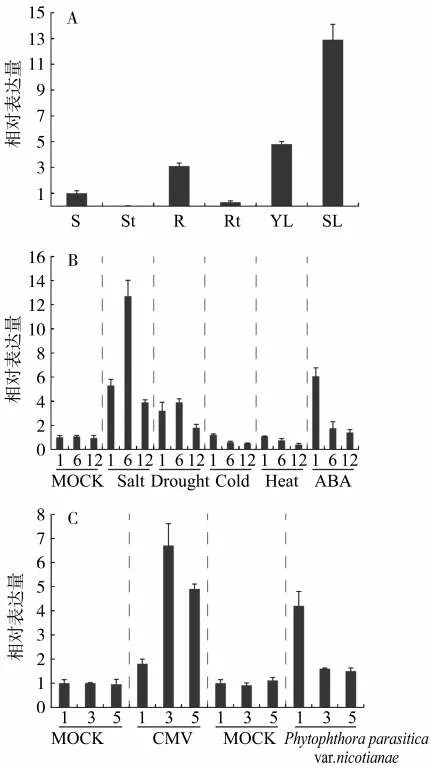
图7 NtWRKY53基因的表达模式分析Fig.7 Expression pattern analysis of NtWRKY53 gene
WRKY转录因子家族是植物特有的一类转录因子家族,在生物、非生物胁迫响应以及植物生长发育和叶片衰老等过程中起重要的调控作用[2]。本研究中鉴定并克隆到烟草中AtWRKY53的同源基因NtWRKY53。多序列比对发现,NtWRKY53蛋白具有典型WRKY结构域和Cys2HisCys型锌指结构域。进化分析和共线性分析发现,NtWRKY53与拟南芥AtWRKY53直系同源。同时,AtWRKY53与NtWRKY53保守基序的类型和组织结构高度类似,暗示其生物学功能可能有较强的一致性。亚细胞定位和转录激活结果表明,NtWRKY53定位在细胞核中并且具有转录激活活性,表明NtWRKY53可能作为转录因子发挥相关生物学功能。
本研究中发现,NtWRKY53同拟南芥AtWRKY53、水稻OsWRKY53、小麦TaWRKY53b和紫花针茅SpWRKY53结构域高度相似且在进化关系上同源,表明这些同源基因编码的转录因子可能承担类似的生物学功能。值得注意的是,AtWRKY53、TaWRKY53b、SpWRKY53基因在衰老叶片中上调表达,而过表达AtWRKY53、SpWRKY53基因能够分别促进拟南芥和紫花针茅的叶片衰老过程[19-20,35]。在烟草中NtWRKY53基因在衰老叶片中表达量较高,暗示其参与烟草叶片衰老、落黄的调控过程。另外,在拟南芥等物种中,AtWRKY53、OsWRKY53基因分别能够被丁香假单胞菌和稻瘟病接种诱导表达,过表达OsWRKY53水稻株系对稻瘟病的抗性明显增强,并且低温和盐胁迫等非生物胁迫以及玉米纹枯病均能显著诱导ZmWRKY53的表达[21-22,35]。本研究中还发现,NtWRKY53基因能够被盐胁迫、干旱胁迫、CMV和黑胫病病原物所诱导,暗示在烟草中NtWRKY53基因很可能参与多种生物、非生物逆境的响应和调控过程。而有关利用过表达、基因编辑等手段揭示NtWRKY53基因功能方面还有待深入研究。
4 结论
通过比较基因组学的方法从普通烟草K326中克隆到NtWRKY53基因。NtWRKY53基因可编码典型WRKY转录因子,并且是拟南芥AtWRKY53的同源基因。而NtWRKY53是核定位的转录因子,具有转录激活活性,NtWRKY53基因的表达具有明显的组织和时间特异性,在衰老、落黄的烟草叶片中表达量较高。NtWRKY53基因受到盐胁迫和干旱胁迫的诱导,参与了干旱和盐胁迫的逆境响应。接种CMV和黑胫病后,NtWRKY53基因表达量显著上调,NtWRKY53基因同样也参与了相应的生物胁迫的逆境响应。
