急性脑梗死患者外周血中性粒细胞/淋巴细胞比值与颈动脉易损斑块的关系
2021-02-24张娟张春梅陈伟男
张娟,张春梅,陈伟男
(哈尔滨医科大学附属第一医院,黑龙江 哈尔滨150001)
急性脑梗死(acute cerebral infarction, ACI)约占脑梗死的87%[1]。动脉粥样硬化是脑梗死发生、发展的重要病因[2]。有研究表明,斑块的性质对脑梗死事件发生的风险比斑块引起的狭窄程度高[3]。炎症反应参与动脉粥样硬化的过程,同时也与不稳定斑块的发生、发展有关[4]。中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)可作为全身系统反应的炎症指标[5]。JIANG 等[6]报道NLR 与颈动脉斑块的发生具有一定的相关性,但关于NLR 与斑块性质的研究较少。本研究旨在探究ACI 患者外周血NLR 与颈动脉易损斑块的相关性,为临床评估ACI颈动脉斑块风险提供较为方便的指标。
1 资料与方法
1.1 一般资料
选取2016年9月—2018年1月于哈尔滨医科大学附属第一医院卒中病房住院的ACI 患者271 例。其中,男性150例,女性121例;平均年龄(64.88±10.21) 岁。纳入标准:①患者首次发病,符合1995年第4 届全国脑血管病学术会议修订的诊断标准[7],并经头颅CT 或MRI 证实发生ACI≤3 d;②入院24 h 内接受颈动脉超声检查。排除标准:①脑出血、脑动脉夹层、颅内静脉窦血栓或烟雾病引起的脑卒中;②其他颅内病变(脑肿瘤、蛛网膜下腔出血);③伴急性冠脉综合征,既往有严重心功能衰竭、心房颤动及显著的瓣膜病;④慢性阻塞性肺病、肝或肾脏功能衰竭、血液系统疾病、恶性肿瘤等;⑤服用抗炎药物、免疫抑制剂及他汀类药物;⑥入院前6 个月内有过手术或者创伤性疾病,发病前1 周内有明确感染病史。本研究纳入患者根据颈动脉超声检查分为无斑块组和有斑块组,分别有84 和187 例,有斑块组依据斑块超声特点分为稳定斑块组和易损斑块组,分别有83例和104例。
1.2 方法
1.2.1 临床资料收集收集患者的年龄、性别、吸烟史、高血压、糖尿病史等。糖尿病诊断标准:空腹血糖≥7.0 mmol/L,或口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L,或已诊断为糖尿病正在进行降糖治疗。高血压诊断标准:连续2 次在静息状态下收缩压≥140 mmHg 和/或舒张压≥90 mmHg,或有明确的高血压病史。
1.2.2 生化指标的测定采集患者入院后抽取空腹12 h以上的静脉血2 ml,使用全自动血常规分析仪分析白细胞计数(WBC)、中性粒细胞计数(N)、淋巴细胞的计数(L),并计算NLR;使用全自动生化分析仪测定总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、空腹血糖(FPG)及纤维蛋白原(Fibrinogen,FBG),并计算患者的BMI。
1.2.3 颈动脉超声的检测采用荷兰Philips 公司的EPIQ5型彩色多普勒超声诊断仪,选择L11-3线阵及C5-1 凸阵探头,对患者进行颈动脉超声检查。沿颈动脉走行自近心端至远心端分别扫查双侧颈总动脉、颈动脉分叉、颈内动脉颅外段及椎动脉,测量颈动脉的内中膜厚度(intima-media thickness,IMT)、内径,观察有无斑块,并记录斑块的大小、表面形态及内部回声。参照欧洲颈动脉斑块研究组制定的标准[8],定义IMT<1.0 mm为正常,IMT≥1.0 mm为增厚,IMT≥1.5 mm或大于周围正常IMT值的50%以上,且凸向管腔的局部结构变化定义为斑块形成。根据斑块的超声图像表现分为低回声斑块、等回声斑块及强回声斑块,其中,同时存在≥2种回声的斑块为混合回声斑块,低回声斑块富含脂质,等回声斑块富含纤维,强回声或后方伴声影斑块为钙化斑[9]。溃疡斑块指斑块表面至少有2 mm长和2 mm深的凹陷,斑块底部有明显的基部[10]。将低回声、混合回声和溃疡斑定义为易损斑块并作为易损斑块组;等回声、强回声斑块定义为稳定性斑块并作为稳定性斑块组。含有≥1 个易损斑块、同时存在稳定斑块和易损斑块的归为易损斑块组。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,计数资料以构成比或率(%)表示,比较用χ2检验,危险因素的分析采用Logistic 回归模型,并绘制ROC 曲线,P<0.05为差异有统计学意义。
2 结果
2.1 斑块组与无斑块组临床资料比较
斑块组与无斑块组吸烟史、NLR、N 及L 比较,差异有统计学意义(P<0.05),斑块组吸烟史、NLR、N高于无斑块组,L低于无斑块组。见表1。
2.2 稳定斑块组与易损斑块组临床资料比较
稳定斑块组与易损斑块组NLR、N、L 及LDL-C比较,差异有统计学意义(P<0.05),易损斑块组NLR、N及LDL-C 高于稳斑块组,而L低于稳定斑块组。见表2。
2.3 颈动脉粥样硬化易损斑块危险因素的Logistic回归分析
以颈动脉粥样硬化斑块的易损性为因变量(有=1,无=0),以N、L、NLR、高血压等相关危险因素为自变量,构建多因素Logistic 回归方程。多因素Logistic 回归分析显示,NLR、LDL-C 是颈动脉不稳定斑块的独立影响因素(P<0.05),NLR值每增加1 个单位,斑块为易损斑块的可能性是原来的1.400 倍(95% CI:1.124,1.744),LDL-C 每增加1 个单位,斑块为易损斑块的可能性是原来的2.867 倍(95%CI:1.238,6.640)。见表3。

表1 斑块组与无斑块组临床资料比较
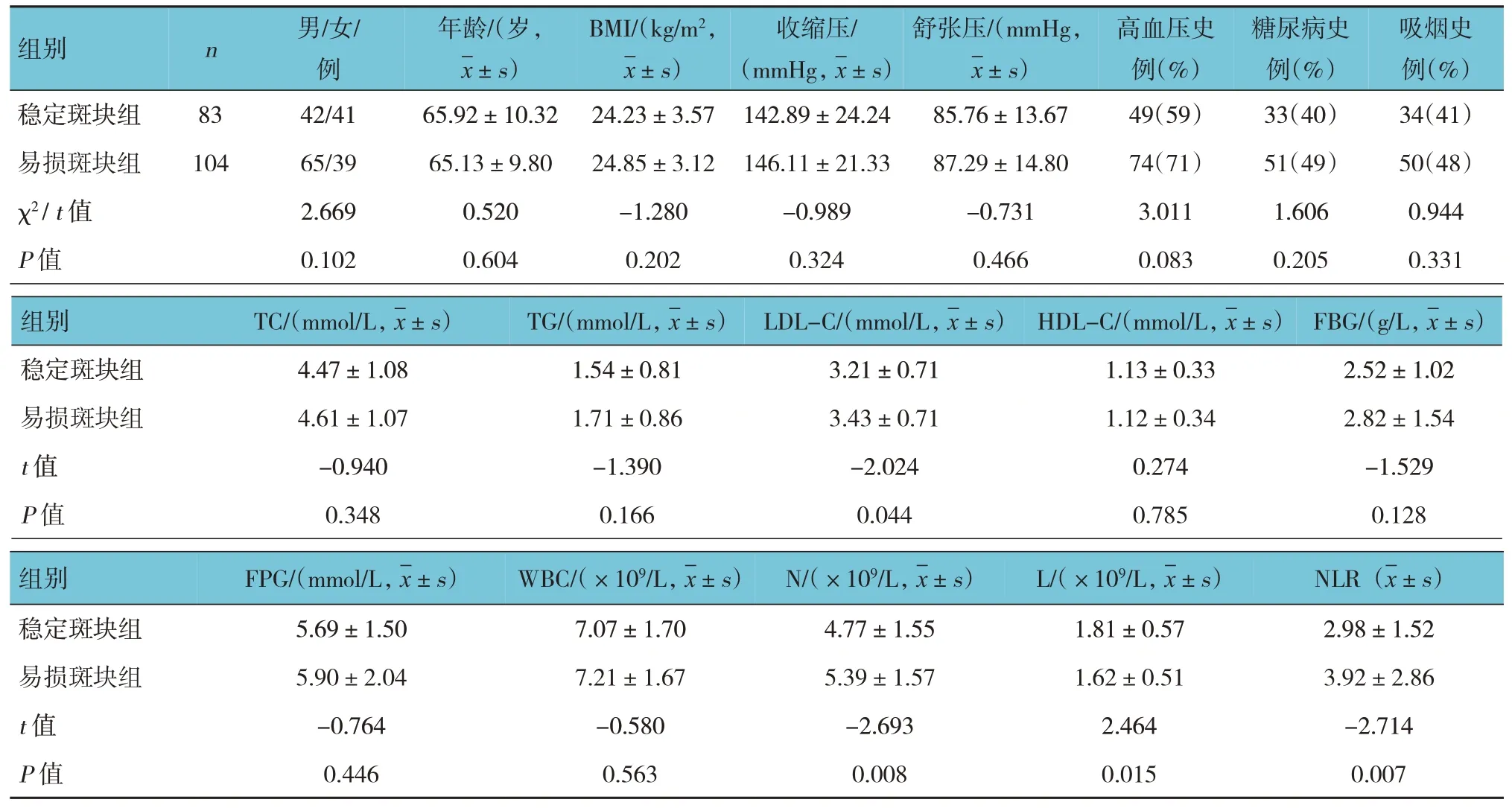
表2 稳定斑块组与易损斑块组临床资料比较
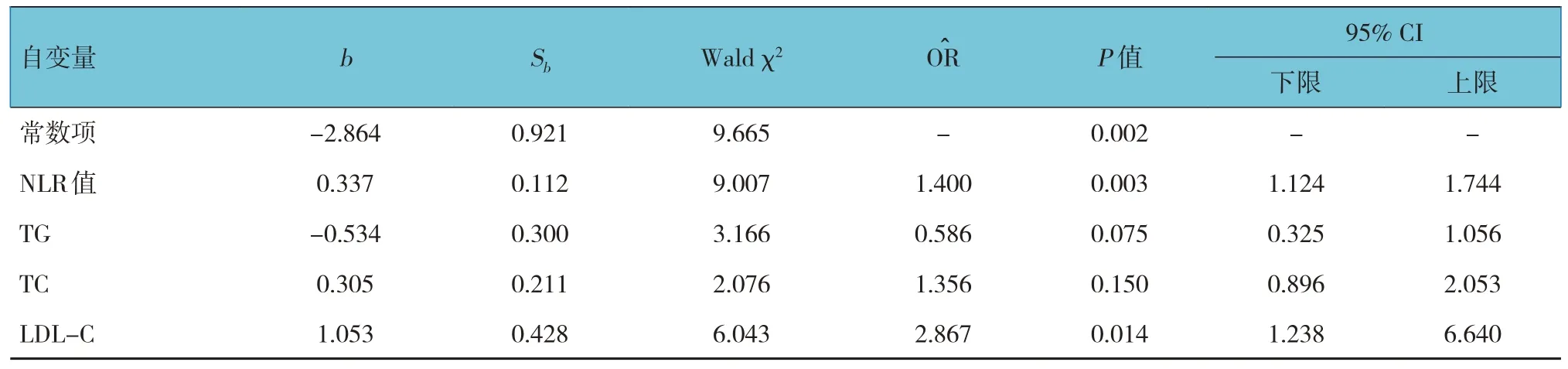
表3 Logistic回归分析参数
2.4 ACI 患者中的NLR 水平对易损斑块的预测价值
NLR 预测ACI 患者颈动脉易损斑块的ROC 曲线下面积为0.65(95%CI:0.567,0.728),最佳截断点为2.79,此时的敏感性为0.69 (95% CI:0.593,0.777),特异性为0.59 (95% CI:0.465,0.684)。见图1。
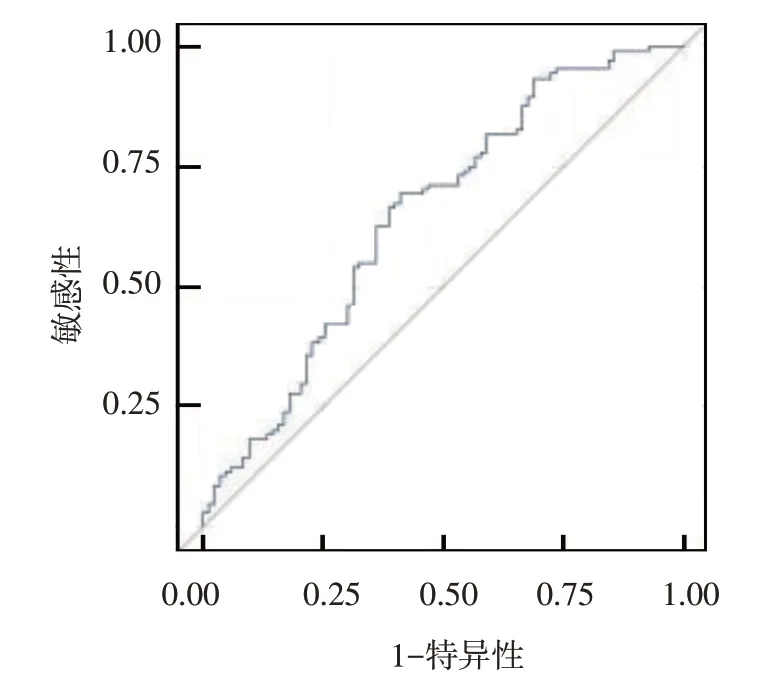
图1 NLR对不稳定斑块预测的ROC曲线
3 讨论
动脉粥样硬化是导致ACI 发病的独立危险因素,当颈动脉斑块生长至一定程度会发生破裂、出血,斑块内部的碎片会随着血流进入脑血管,导致脑组织缺氧从而引起脑梗死[2]。如果能在疾病的早期找到快速、有效的标志物对易损斑块进行预测,对脑梗死预防及控制病情的进展具有重要的意义。
炎症是导致动脉粥样硬化斑块形成、破裂及血栓形成最主要的原因[4]。白细胞是人体中最重要的炎症细胞[4]。HAEUSLER 等[11]研究发现,脑梗死发生后中性粒细胞占梗死脑组织周围浸润的白细胞的大部分,且在发病24 h 左右达峰值;外周血中性粒细胞增高、淋巴细胞降低现象至少持续6天。多项研究发现,中性粒细胞与不稳定斑块相关,其机制可能为活化的中性粒细胞可以释放各种各样的蛋白水解酶,其具有破坏组织的潜力,其中弹性蛋白酶具有介导基底膜成分降解和内皮细胞的损伤作用,从而导致斑块纤维帽变薄,使稳定斑块向不稳定斑块发展[12-13]。另一方面,中性粒细胞含有大量的基质降解蛋白酶,产生大量的氧化物质,迅速发生细胞凋亡,从而促使斑块的破裂及侵蚀[13]。淋巴细胞代表体内的免疫反应,数目减少往往提示体内有炎症反应。有研究表明,淋巴细胞减少与动脉粥样硬化的发生呈反比,其原因可能为在动脉粥样硬化发展的过程中,单核细胞与淋巴细胞渗入到斑块中,从而导致淋巴细胞减少[14]。中性粒细胞与淋巴细胞代表白细胞中最主要的两种亚型,而NLR 综合中性粒细胞对炎症反应及淋巴细胞对免疫应答的作用,客观反映机体炎症免疫的平衡状态,因此NLR 相对单独研究中性粒细胞及淋巴细胞其价值更大[15]。
本实验证明易损斑块组的N、NLR 水平高于稳定斑块组,L 水平低于稳定斑块组,进一步Logistic回归分析提示NLR 为颈动脉易损斑块的独立危险因素,ROC 曲线分析结果表明NLR 可以作为ACI 患者筛查易损斑块的血液学指标之一。本实验同样证明LDL-C 是颈动脉易损斑块的独立影响因素,这与张涛等[16]的研究相似,LDL-C 与颈动脉病变程度密切相关。但是LDL-C 容易受多种因素的影响,比如性别、饮食不当、用药不当等[14],而本研究中并没有排除对LDL-C的影响因素的一些干扰,因此尚需要进一步研究。
本研究表明,ACI患者颈动脉易损斑块与NLR水平关系密切,较早发现并纠正ACI患者中高NLR水平对阻止动脉粥样硬化(尤其是易损斑块)的形成有重要的作用。本研究尚存在一定的局限性。首先,本研究的样本量较少,且属于单中心分析,且没有比较NLR与其他炎症标志物的相关性,具有一定的局限性;另外,超声对斑块稳定性的评价主要依靠操作者人为判定,缺乏量化标准,其客观性和准确性有待提高。因此,还尚需要大样本、多中心的研究来证实。
