基于T2WI 3D纹理分析评估宫颈癌组织学分级
2021-02-24尹进学卢斌贵杨佩瑜陈志军洪璇阳李颖慧孙紫情李建生
尹进学,卢斌贵,杨佩瑜,钟 熹,陈志军,桂 思,洪璇阳,李颖慧,孙紫情,李建生
(广州医科大学附属肿瘤医院放射科,广东 广州 510095)
宫颈癌是女性最常见恶性肿瘤之一,近年来发病率、死亡率均呈上升趋势[1]。肿瘤组织学分级是选择宫颈癌治疗方案及评价预后的重要影响因素[2]。常规MR检查是目前宫颈癌术前诊断及分期的主要手段,但不能评价肿瘤组织学分级及微观层面异质性表现。纹理分析能量化评价肉眼无法识别的肿瘤异质性,并无创反映组织潜在病理学改变[3]。近年来,纹理分析图像后处理技术已从2D计算扩展到3D计算,并广泛用于肿瘤病理分级[4-5]。既往研究[6]显示,2D纹理分析方法用于分析肿瘤特异性有所不足,3D纹理特征具有更高诊断效能。本研究探讨基于T2WI的3D纹理特征模型预测宫颈癌组织学分级的价值。
1 资料与方法
1.1 一般资料 回顾性分析2016年1月—2019年5月175例于广州医科大学附属肿瘤医院确诊的宫颈癌患者,年龄25~79岁,平均(52.2±9.3)岁;根据国际妇产科联盟2009年标准,临床分期IB期90例,IIA期41例,IIB期29例,III期15例;病理分型鳞癌145例、腺癌22例、腺鳞癌8例;高分化41例(高分化组),中分化76例(中分化组),低分化58例(低分化组)。纳入标准:①经手术病理明确诊断并分期;②于术前2周内接受盆腔常规MR检查;③初诊患者,未经任何治疗。排除标准:①合并其他恶性肿瘤;②因各种伪影导致图像质量不佳;③癌灶最大径<1 cm,无法准确勾画病灶。
1.2 仪器与方法 采用Philips Achieve 1.5T MR仪,SENSE-body体线圈。患者取仰卧位,扫描范围包含整个盆腔。扫描序列及参数:轴位T1W,TR 496 ms,TE 10 ms;轴位T2W,TR 2 528 ms,TE 100 ms;冠状位脂肪抑制T2W,TR 2 402 ms,TE 80 ms;矩阵均为244×333,NSA 2,FOV 380 mm×380 mm,层厚5 mm,层间距1 mm。增强扫描采用Gd-DTPA为对比剂,经肘静脉以2.5 ml/s流率团注0.2 ml/kg体质量后行T1W扫描。
1.3 图像分析 以DICOM格式将轴位T2WI导入ITK-SNAP软件(www.itksnap.org),由2名具有妇科肿瘤MRI诊断经验的副主任医师分析图像,意见不一致时经协商达成共识,避开肿瘤坏死、囊变区及肿瘤最上、最下层面手动逐层勾画病灶,获取3D 感兴趣体积(volume of interest,VOI)(图1)。将轴位T2WI和3D VOI图像导入影像组学特征计算软件LIFEx 4.0(www.lifexsoft.org)进行配准,共41个最终获得6类纹理特征参数,包括4个形态(Shape)参数、5个直方图(Histogram)、7个灰度共生矩阵(grey level co-occurrence matrix,GLCM)、3个邻域灰度差分矩阵(neighborhood grey-level different matrix, NGLDM)、11个灰度游程矩阵(grey-level run length matrix,GLRLM)和11个灰度区长度矩阵(grey-level zone length matrix,GLZLM)参数。采用LIFEx软件对ROI进行空间重采样,将体素强度离散到128个灰度级别,对ROI内信号强度在平均值±3×标准差之间进行标准化。
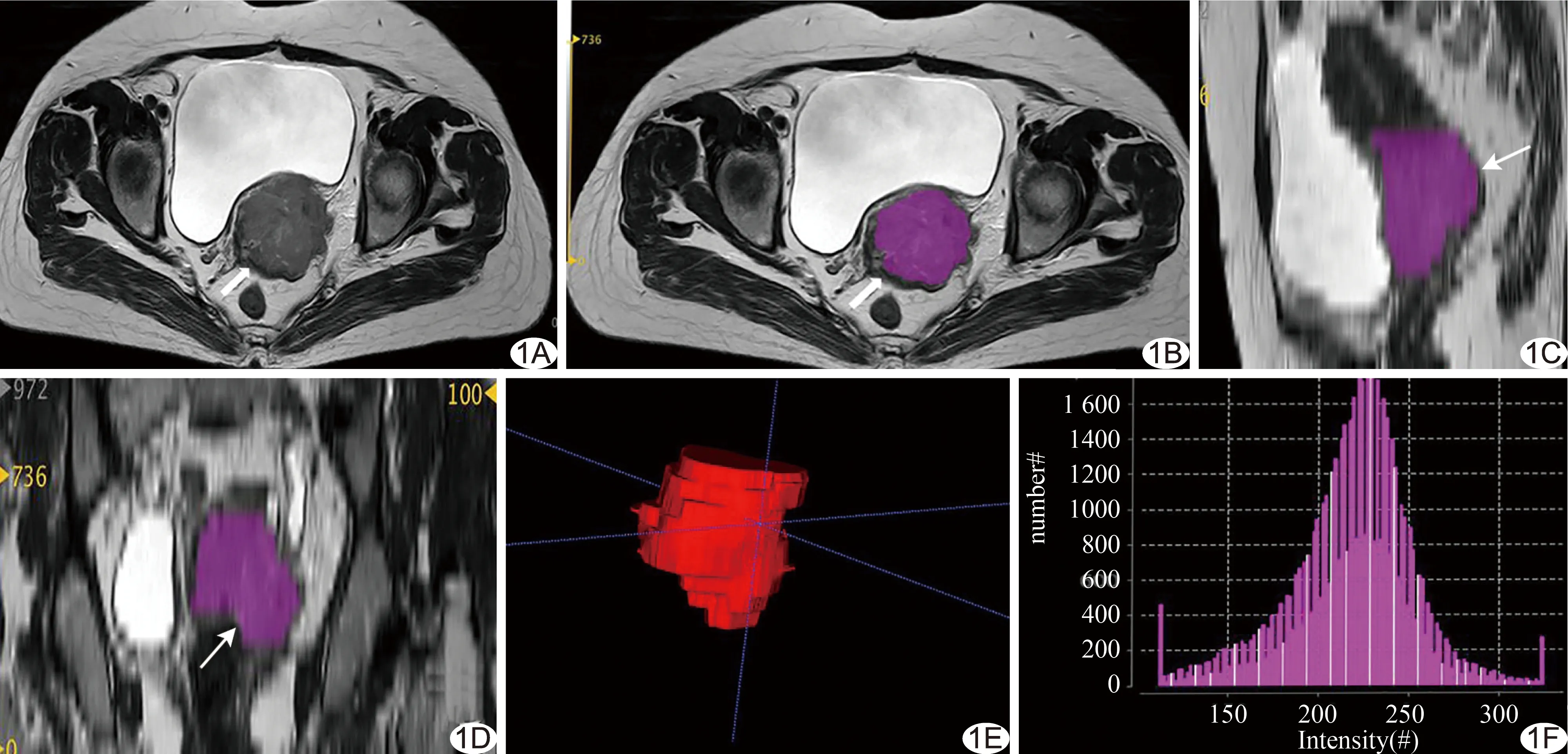
图1 患者女,56岁,低分化宫颈鳞癌,勾画病灶ROI示意图 A.轴位T2WI; B~D.分别为轴位、矢状位、冠状位ROI,箭示病灶; E.3D ROI体积; F.直方图
1.4 统计学分析 采用SPSS 22.0和SAS 9.3统计分析软件。对计量资料先行正态性检验及方差齐性检验。对于不同组织学分级组间纹理参数,方差齐者以±s表示,组间比较采用单因素方差分析,否则以中位数(上下四分位数)表示,采用Kruskal-Wallis秩和检验;组间两两比较采用LSD-t检验或Mann-WhitneyU检验。将组间差异有统计学意义的参数与宫颈癌组织学分级进行Spearman相关性分析。对组间差异有统计学意义的纹理参数采用多因素Logistic回归构建模型。以ROC曲线分析纹理参数及回归构模型的诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 低、中、高分化组间基于T2WI的3D纹理特征参数比较 低、中、高分化组间区域灰度不均匀度(GLNUz)、区长度不均匀度(ZLNU)、能量(GLCM-Energy)、强度(Busyness)、游程灰度级不均匀度(GLNUr)、游程长度不均匀度(RLNU)、体积(Volume-vx)及容积(Volume-ml)8个参数差异有统计学意义(P均<0.05)。低分化组与高分化组间8个纹理参数差异均有统计学意义(P均<0.05),中分化与高分化组间Energy、GLNUz、ZLNU差异有统计学意义(P均<0.05);低分化与中分化组间纹理参数差异均无统计学意义(P均>0.05),见表1。
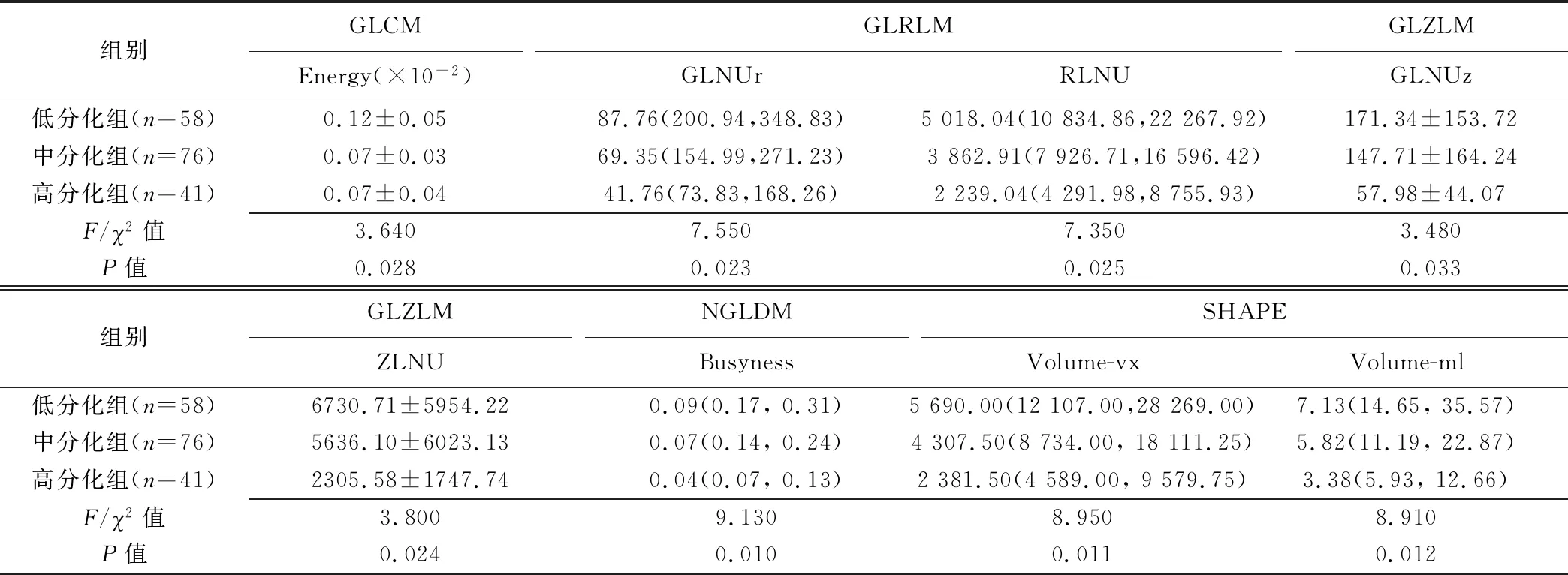
表1 不同分化程度宫颈癌基于T2WI 3D纹理特征参数比较
2.2 相关性 低、中、高分化组间差异有统计学意义的8个纹理参数均与组织学分级相关(|r|=0.491~0.567),与Energy呈正相关,与其他参数均呈负相关,见表2。

表2 不同分化程度宫颈癌之间差异有统计学意义的纹理参数及与组织学分级的相关性
2.3 诊断效能 低分化与高分化组间8个差异有统计学意义的纹理参数鉴别二者的AUC为0.711~0.774,以此构建的Logistic回归模型的AUC为0.875,敏感度87.50%,特异度77.78%;中分化与高分化组间3个差异有统计学意义的纹理参数的AUC为0.685~0.717,以此构建的Logistic回归模型的AUC为0.753,敏感度78.75%,特异度72.92%,见表3、4及图2。
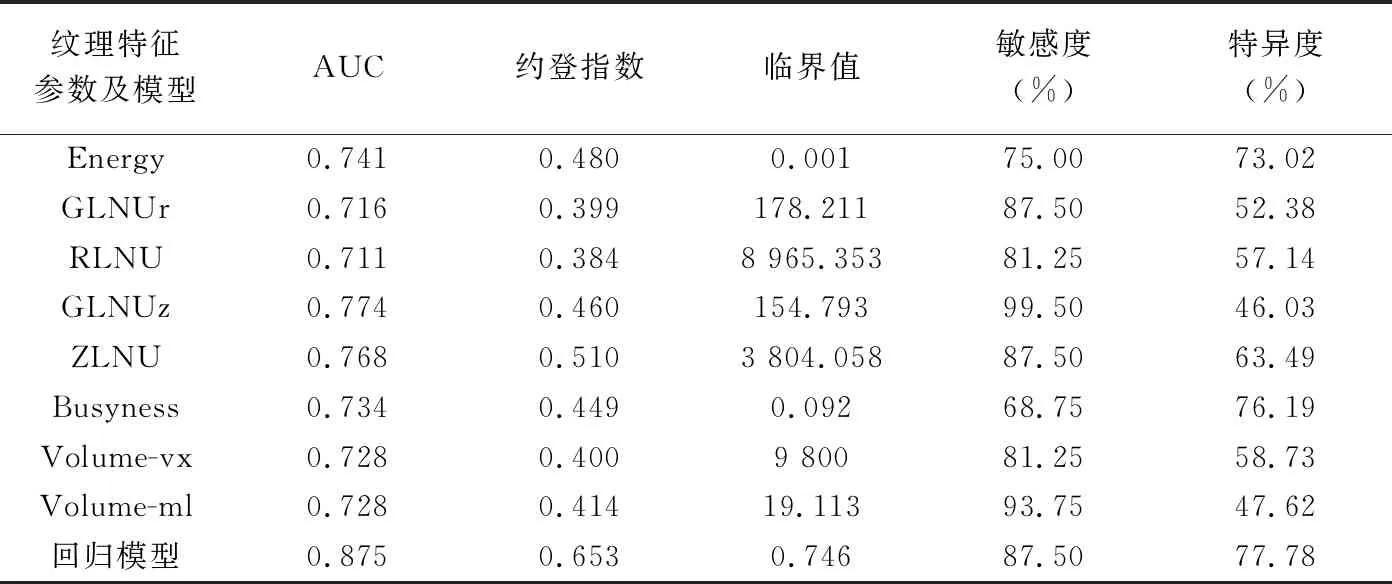
表3 纹理特征参数及其模型鉴别低分化与高分化宫颈癌的诊断效能

表4 纹理特征参数及其模型鉴别中分化与高分化宫颈癌的诊断效能
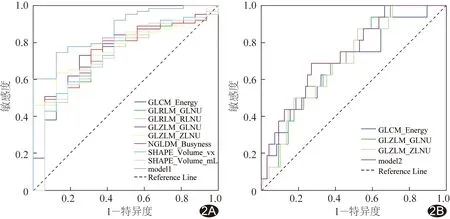
图2 纹理参数及回归模型鉴别宫颈癌组织学分级的ROC曲线 A.低分化与高分化; B.中分化与高分化
3 讨论
组织病理学分析是确定肿瘤异质性的金标准。肿瘤纹理特征与病理分级具有相关性[7],肿瘤分化程度越低,组织内部成分越复杂,异质性越高。纹理分析可从影像学图像中提取用于量化像素或体素的参数来反映肿瘤的微观特征,不同纹理参数代表肿瘤不同异质特征。2D纹理分析基于分割肿瘤体积单个层面创建2D二进制掩码,通过计算分析ROI的异质性。3D纹理分析则针对整个肿瘤ROI体积,分析计算每个体素的灰度值分布[5],可更大程度捕获肿瘤异质性,优化提取纹理参数的准确性,反映肿瘤病理生理变化的效能较2D纹理分析更高[8-9]。
本研究采用基于T2WI的3D纹理分析术前评估宫颈癌组织学分级,结果显示8个纹理参数与宫颈癌组织学分级相关,虽然各自反映肿瘤不同特征,但均提示肿瘤分化程度与内部异质性具有一定共线性,与既往研究[10]结果相符。
纹理参数本身存在某些共性,可在一定程度上代表某种共同生理或病理机制[11];纹理参数组合可以互补,并提供更多数据维度,有助于弥补单一参数不足以全面反映细微结构特征信息的不足。联合应用多种纹理参数可显著提高脑膜瘤分级效能[12]。谭红娜等[13]分析乳腺癌X线图像纹理特征,以预测腋窝淋巴结转移,发现联合构建模型的诊断效能优于单一参数。本研究低分化与中分化组间纹理参数差异均无统计学意义,可能与中、低分化宫颈癌的癌灶存在较明显核分裂象,且细胞密集,易发生坏死、囊变,导致T2WI所示体素内异质性不明显有关;8个纹理参数在低分化与高分化组间差异均有统计学意义,表明低分化较高分化肿瘤内部异质性更为显著;ROC曲线分析显示8个参数联合构建回归模型的AUC为0.875,高于单一参数的诊断效能。采用中分化与高分化组间差异有统计学意义的3个纹理参数联合构建回归模型的AUC为0.753,同样显示联合模型的诊断效能优于单参数。此外,纹理特征GLZLM中的GLNUz用于鉴别低分化与高分化、中分化与高分化宫颈癌的敏感度均较高,但特异度较低,原因可能在于GLNUz主要代表图像中每个灰度级均匀区域的大小,反映T2WI中VOI内像素之间灰度值的分布,但并不能完全显示整个肿瘤的异质性特征。
本研究的局限性:①单中心样本,存在选择偏倚;②手动勾画VOI,界定体积受评估者经验影响;③未验证病灶纹理参数测量的可重复性。
综上所述,基于T2WI的3D纹理参数可评价肿瘤异质性,用于术前预测宫颈癌病理组织学分级有一定价值;由各参数联合构建的回归模型可提高诊断效能,有利于术前临床决策。
