载硫化铋及阿霉素靶向相变型纳米粒多模态显像及联合治疗卵巢癌体外实验
2021-02-24赵佳雯王志刚杨心怡
赵佳雯,张 亮,周 頔, 王志刚,杨心怡,文 明*
(1.重庆医科大学附属第一医院放射科,重庆 400016;2.重庆医科大学附属第二医院超声科,重庆 400010)
卵巢癌是女性死于生殖系统恶性肿瘤的主要病因[1],化学治疗(简称化疗)仍为临床常用,但存在严重药物毒副作用[2],药物对肿瘤的低选择性及肿瘤耐药性是主要因素[3]。光热治疗(photothermal therapy, PTT)可利用近红外激光照射产生热量杀灭肿瘤细胞,提高药物对肿瘤组织细胞的渗透性,增强肿瘤细胞对化疗药物的敏感性[4];但其产热分布不均可致肿瘤消融不彻底,引起复发和转移[5]。本研究拟制备聚乳酸羟基乙酸共聚物聚乙二醇叶酸[poly(lactic co glycolic acid)-poly(ethylene glycol) -folic acid, PLGA-PEG-FA]包裹硫化铋(bismuth sulfide, Bi2S3)、阿霉素(doxorubicin hydrochloride, DOX)及全氟己烷(perfluoropentance, PFP)的叶酸靶向相变型纳米粒(FBS-PFP-PLGA@DOX),用于CT/超声/光声多模态显像及可视化引导下光热联合体外治疗卵巢癌。
1 材料与方法
1.1 材料 DOX(美仑生物技术有限公司),Bi2S3、PLGA-PEG-FA(西安瑞禧生物科技有限公司),全氟己烷PFP(Strem Chemicals),二氯甲烷(CH2Cl2),异丙醇,聚乙烯醇(PVA,美国Sigma公司),二甲基亚砜(DMSO,上海Sigma-Vetec公司)。
1.2 仪器 声振仪(XL2020,美国Heat System),磁力搅拌器(GL-3250C,海门市其林贝尔仪器制造有限公司),电子分析天平(XS104,上海精密科学仪器有限公司),低温离心机(Centrifuge 5804 R,德国Eppendorf),倒置荧光显微镜(IX53,日本Olympus),激光粒径及电位测量仪(Zetasizer Nano ZS90,美国Malvern),紫外分光光度计(UV2600,日本Shimadzu),电感耦合等离子质谱(inductively coupled plasma massspectrometry, ICP-MS),透射电镜(H7500,日本Hitachi),激光共聚焦显微镜(德国Leica),酶标仪(ELX800,美国伯腾),808 nm激光仪(西安中川光电科技有限公司),光声成像仪(Vevo© LAZR,加拿大Visual Sonics公司);Esaote MyLab 90超声成像仪,GE 64排螺旋CT。
1.3 制备FBS-PFP-PLGA@DOX纳米粒 采用双乳化法[6],称取50 mg PLGA-PEG-FA溶于3 ml CH2Cl2,再加入200 μl Bi2S3及400 μl PFP溶液,充分混匀后加入含10 mg DOX的水溶液200 μl,冰浴避光条件下声振3 min后加入4% PVA溶液8 ml进行二次声振,再加入2%异丙醇溶液10 ml,以磁力搅拌2 h至有机溶剂完全挥发,以双蒸水洗涤离心2次(10 000 r/min,4℃,5 min),获得FBS-PFP-PLGA@DOX。同法分别制备FA-PFP-PLGA及BS-PFP-PLGA@DOX,4℃保存。
1.4 观察FBS-PFP-PLGA@DOX基本特征 以光镜及透射电镜观察FBS-PFP-PLGA@DOX形态,以激光仪测量其粒径及平均电位,紫外分光光度计和电感耦合等离子质谱分别测量DOX和Bi2S3包封率和载药量。
1.5 细胞寻靶实验 选择对数期生长的卵巢癌SKOV-3细胞,以1×105个/孔密度接种于共聚焦皿中,孵育24 h。实验分为靶向组及非靶向组,分别加入100 μl红色荧光染料DiI标记的FBS-PFP-PLGA@DOX及BS-PFP-PLGA@DOX。继续孵育3 h后加入10 μl蓝色荧光染料DAPI染色15 min,再以磷酸盐缓冲液(phosphate buffer solution, PBS)洗涤。将共聚焦皿置于激光共聚焦显微镜下观察并采集图像。
1.6 体外多模态显像
1.6.1 CT 配置不同浓度(0、1、2、3、4、5 mg/ml)FBS-PFP-PLGA@DOX溶液进行CT扫描。扫描参数:管电压80 kV,管电流170 mA,层厚0.625 mm。采用Horos软件测量各EP管中溶液CT值。
1.6.2 光声显像 将不同浓度(0、1、2、3、4、5 mg/ml)FBS-PFP-PLGA@DOX溶液加入凝胶模型中,置于光声成像仪上,以一定波长激光辐照各组样品,采集各组样品的光声图,并利用仪器自带软件测量光声信号强度。
1.6.3 超声 将FBS-PFP-PLGA@DOX配置为不同浓度(0、1、2、3、4、5 mg/ml),加入1 ml凝胶模型中,以808 nm近红外激光(1 W/cm2)辐照5 min后用进行超声扫查,采集FBS-PFP-PLGA@DOX相变前后二维声像图及造影模式图像,以DFY定量分析软件测量回声强度变化。
1.7 光热成像及光致相变实验 ①将FBS-PFP-PLGA@DOX稀释为不同浓度(0、2、4、6、8、10 mg/ml)加于96孔板内,用808 nm近红外激光(1 W/cm2)辐照5 min并记录其温度变化。②光热稳定性实验,将100 μl的10 mg/ml FBS-PFP-PLGA@DOX加入96孔板,以808 nm近红外激光辐照5 min后关闭激光,待温度降至室温后再度开启激光,进行5个循环,全程记录温度变化。③FBS-PFP-PLGA@DOX光致相变实验,将FBS-PFP-PLGA@DOX稀释后滴加于载玻片上,放于倒置荧光显微镜,开启激光辐照,记录其辐照前后变化情况。
1.8 细胞毒性实验 选择处于对数生长期的SKOV-3细胞,以1×104个/孔密度接种于96孔板内,孵育24 h。实验分为7组:①对照组;②激光辐照组;③FA-PFP-PLGA(100 μl,1 mg/ml)+激光辐照组(808 nm,5 min);④BS-PFP-PLGA@DOX组(100 μl,1 mg/ml);⑤BS-PFP-PLGA@DOX(100 μl,1 mg/ml)+激光辐照组(808 nm,5 min);⑥FBS-PFP-PLGA@DOX(100 μl,1 mg/ml);⑦FBS-PFP-PLGA@DOX(100 μl,1 mg/ml)+激光辐照组(808 nm,5 min)。每组设3个复孔,加入100 μl细胞计数试剂盒(Cell Counting Kit-8, CCK-8)溶液后继续孵育1 h,以酶标仪测量各孔在450 nm波长处的吸光度。
1.9 统计学分析 采用SPSS 18.0统计分析软件。计量资料以±s表示,两两比较采用t检验;生存率两两比较采用t检验,两变量之间关系采用线性相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 FBS-PFP-PLGA@DOX基本性能 制备的FBS-PFP-PLGA@DOX呈球形,透射电镜可见其具有壳核结构(图1A),Bi2S3分布于PLGA外壳上(图1B);经Malvern激光粒径仪检测,平均粒径为(255.00±90.82)nm(图1C),Zeta电位为(-7.07±4.33)mV(图1D);紫外分光光度计测得DOX标曲(R2=0.994),DOX的包封率为(26.77±0.46)%,载药量为(2.34±0.04)%;ICP-MS测得Bi2S3的包封率为(87.57±0.12)%,载药量为(3.38±0.01)%。

图1 FBS-PFP-PLGA@DOX表征 A、B.透射电镜图; C.粒径分布图; D.Zeta电位图
2.2 细胞寻靶实验 激光共聚焦显微镜见DiI标记的纳米粒呈红色,DAPI标记的SKOV-3细胞核呈蓝色。靶向组中红染FBS-PFP-PLGA@DOX特异性结合于蓝染SKOV-3细胞周围;非靶向组未见二者明显结合(图2)。
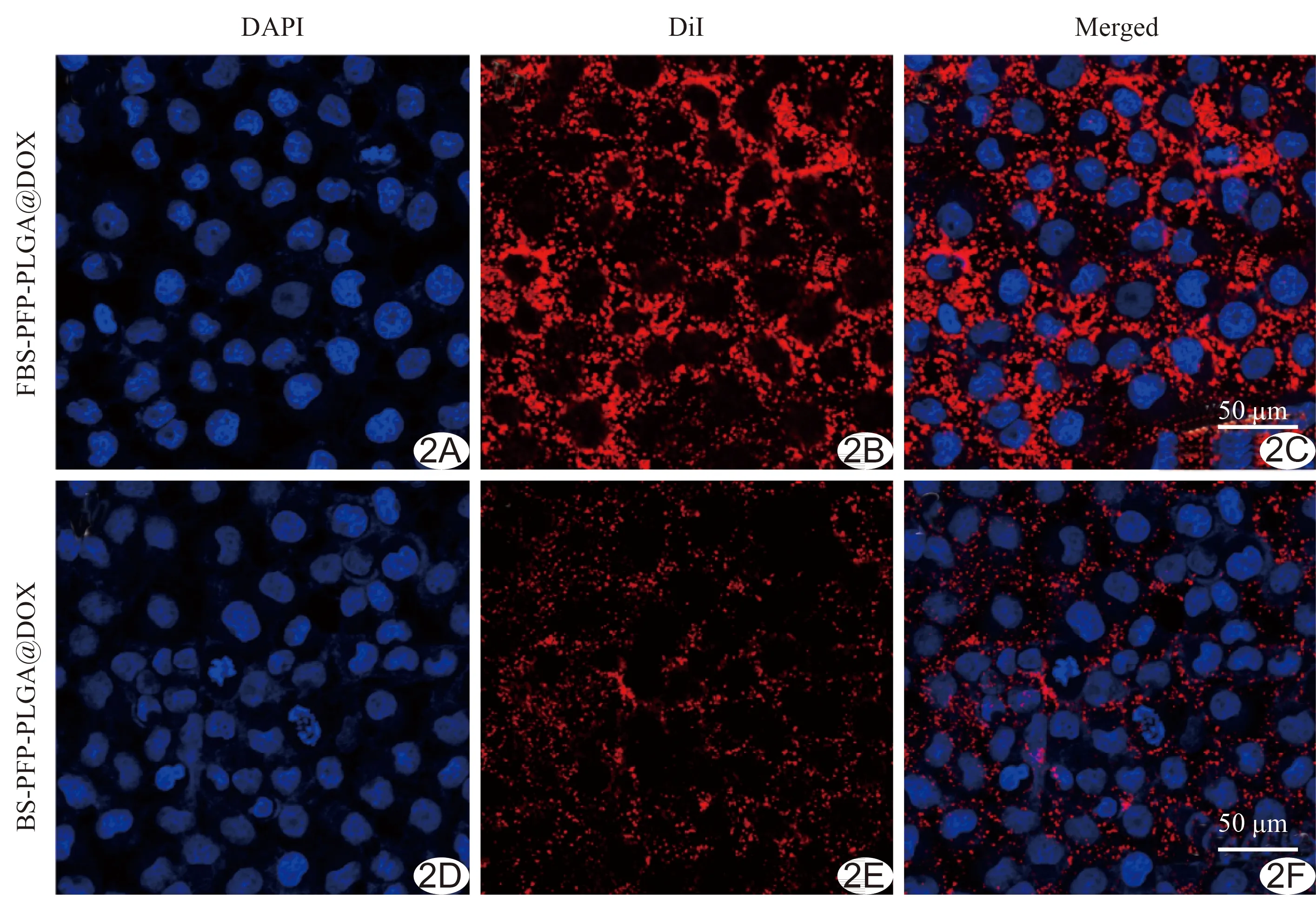
图2 激光共聚焦显微镜观察靶向纳米粒寻靶能力 A.蓝色荧光染料DAPI标记的SKOV-3细胞; B.红色荧光染料DiI标记的FBS-PFP-PLGA@DOX; C.靶向组纳米粒寻靶情况; D.蓝色荧光染料DAPI标记SKOV-3细胞; E.红色荧光染料DiI标记的BS-PFP-PLGA@DOX; F.非靶向组纳米粒寻靶情况
2.3 体外多模态显像
2.3.1 CT FBS-PFP-PLGA@DOX的CT图像对比度明显高于对照组,随Bi2S3浓度增加,FBS-PFP-PLGA@DOX CT图像对比度逐渐增高,对应CT值呈上升趋势(图3A、3E)。

图3 FBS-PFP-PLGA@DOX联合显像 A.不同浓度FBS-PFP-PLGA@DOX的CT图(从左到右浓度依次为0、1、2、3、4、5 mg/ml); B.不同浓度FBS-PFP-PLGA@DOX的光声图(从左到右浓度依次为0、1、2、3、4、5 mg/ml); C.不同浓度FBS-PFP-PLGA@DOX的B-mode超声声像图(从左到右浓度依次为0、1、2、3、4、5 mg/ml); D.不同浓度FBS-PFP-PLGA@DOX超声造影图像(从左到右浓度依次为0、1、2、3、4、5 mg/ml ); E.不同浓度FBS-PFP-PLGA@DOX的CT值; F.不同浓度FBS -PFP-PLGA@DOX的光声值; G.不同浓度FBS-PFP-PLGA@DOX的B-mode模式超声回声强度值; H.不同浓度FBS-PFP-PLGA@DOX超声造影模式回声强度值
2.3.2 光声显像 FBS-PFP-PLGA@DOX光声信号强度高于对照组,随Bi2S3浓度增加,FBS-PFP-PLGA@DOX光声信号逐渐增强,对应光声值也呈上升趋势(图3B、3F)。
2.3.3 超声 激光辐照后,随FBS-PFP-PLGA@DOX纳米粒浓度增加, B-mode与造影模式下回声强度均逐渐增加(图3C、3D、3G、3H)。FBS-PFP-PLGA@DOX超声回声强度随纳米粒浓度增高而增加。
2.4 光热成像及光致相 变 激光照射后,不同浓度FBS-PFP-PLGA@DOX快速升温,150 s后逐渐趋于稳定,且上升速度与纳米粒浓度呈正相关;对照组照射5 min始终未见温度上升(图4A)。激光开-关循环中,FBS-PFP-PLGA@DOX最高温度未见明显下降(图4B)。
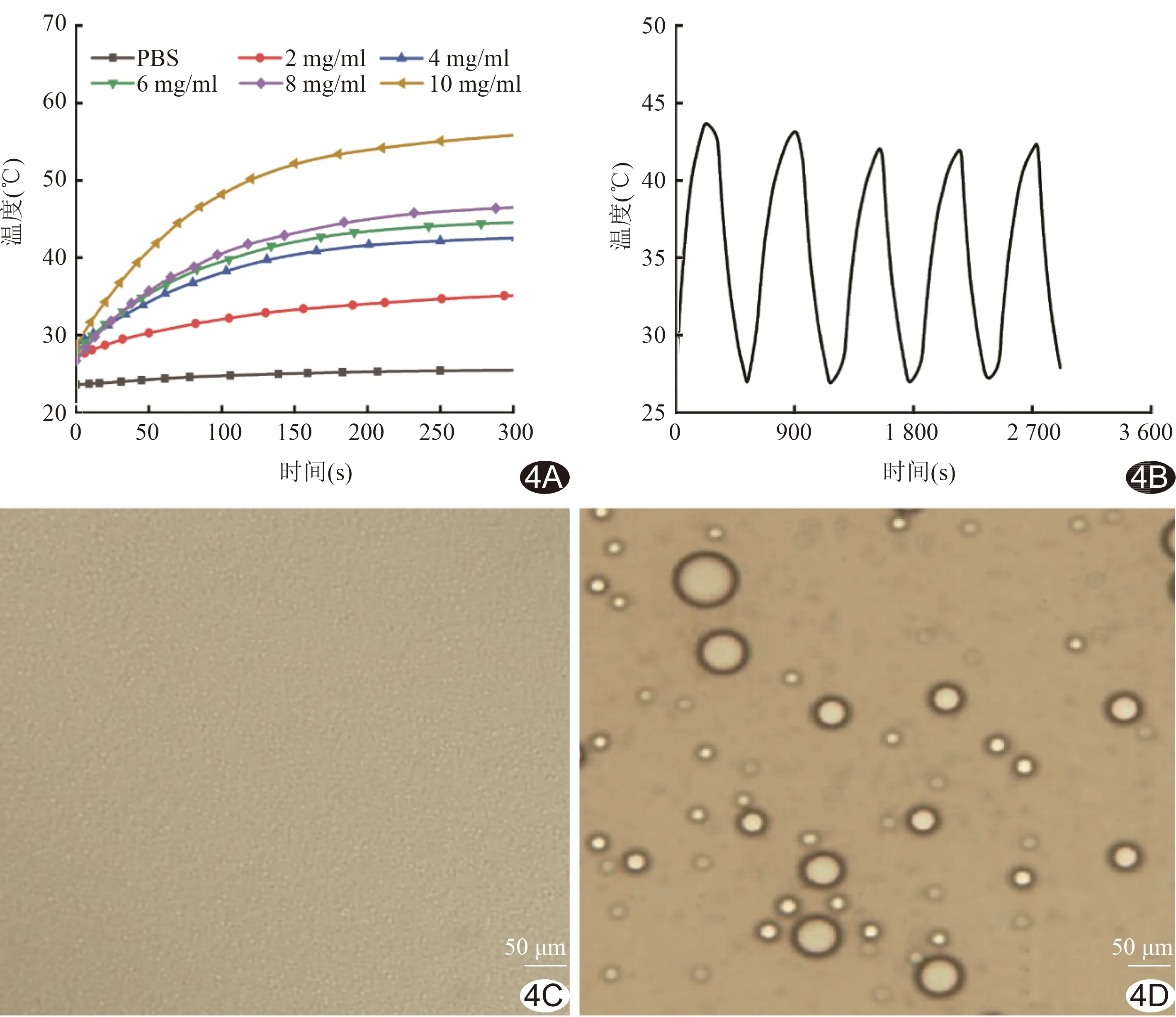
图4 FBS-PFP-PLGA@DOX光热成像及光致相变实验 A.不同浓度FBS-PFP-PLGA@DOX激光辐照升温图; B.FBS-PFP-PLGA@DOX激光开/关5个周期温度曲线; C.FBS-PFP-PLGA@DOX激光照射前光镜图; D.FBS-PFP-PLGA@DOX激光照射后光镜图
光致相变实验中,激光照射前,显微镜下FBS-PFP-PLGA@DOX未见明显变化(图4C);激光照射后,FBS-PFP-PLGA@DOX发生液-气相变,体积明显增大(图4D)。
2.5 细胞毒性实验 FBS-PFP-PLGA@DOX+激光组SKOV-3细胞生存率最低(12.17%),FBS-PFP-PLGA@DOX组细胞生存率(31.57%)较之稍高(t=24.27,P<0.01);FBS-PFP-PLGA@DOX组细胞生存率(31.57%)较BS-PFP-PLGA@DOX组(86.03%)低(t=96.04,P<0.01);FA-PFP-PLGA+激光组与单纯激光组细胞生存率差异无统计学意义(t=1.71,P>0.05)。
3 讨论
PLGA可通过水解作用分解为可代谢成分并通过柠檬酸循环从体内清除[7],生物安全性较好[8]。本研究以PLGA为载体制备的纳米粒平均粒径为(255.00±90.82)nm,可利用肿瘤渗透和滞留效应穿过血管内皮间隙而实现肿瘤显像[9]。
将Bi2S3包裹于纳米粒中,可用于多模态显像。铋元素具有较强吸收X线能力,可明显提高CT对比度,同时具有低毒性、粒径小、循环时间长及表面可修饰等优点[10]。光声效应主要基于光吸收质将光能转化为热能。Bi2S3具有强光吸收属性及高光热转化效率,可吸收近红外波段激光能量,对靶区组织进行光声显像,是良好的光声显像剂[11]。FBS-PFP-PLGA@DOX包裹Bi2S3后,与周围组织声阻抗差异增大,在超声波作用下发生振动,产生强烈的背向散射信号,可增强超声显像效果。激光辐照后,FBS-PFP-PLGA@DOX包裹的PFP升温至沸点以上,可发生液气相变而变为微气泡,改变周围组织声环境而增强超声对比。
随着联合疗法问世,光热联合治疗肿瘤成为研究热点[12]。文献[13]报道,41~45℃的高温疗法可与化疗等传统疗法协同治疗肿瘤。本研究发现,浓度为8 mg/ml及10 mg/ml的FBS-PFP-PLGA@DOX在短时间激光照射后迅速升温至42℃以上并趋于稳定;对FBS-PFP-PLGA@DOX进行5次重复激光照射,最高温度未见明显下降,表明FBS-PFP-PLGA@DOX有良好的光热稳定性,可在体内循环利用。DOX是常用的抗肿瘤药物,但其弥散性会对肿瘤细胞与正常细胞同时造成伤害。上皮来源肿瘤细胞可高表达叶酸受体,而正常组织几乎不表达,故叶酸可作为特异靶向肿瘤组织的靶点。叶酸与肿瘤细胞上叶酸受体特异性结合,使包裹抗癌药物的纳米粒精准地大量到达肿瘤组织,增强抗肿瘤效果[14]。本研究制备的FBS-PFP-PLGA@DOX可通过叶酸-叶酸受体靶向机制,主动靶向高表达叶酸受体的SKOV-3细胞;与非靶向组比较,FBS-PFP-PLGA@DOX能更多聚集于肿瘤组织,为多模态显像和光热联合化学治疗卵巢癌提供保障。FBS-PFP-PLGA@DOX+激光组SKOV-3细胞存活率远低于无激光组及非靶向组,说明叶酸能特异性与肿瘤细胞结合,且光热联合化学治疗能更大程度地杀伤肿瘤细胞;而FA-PFP-PLGA+激光组、单纯激光组对肿瘤细胞杀伤能力较弱,提示叶酸靶具备良好生物安全性。
综上,本研究成功制备了FBS-PFP-PLGA@DOX,能主动靶向高表达叶酸受体的卵巢癌SKOV-3细胞,具备良好的体外多模态显像能力,并有望实现多种方法协同增效治疗卵巢癌,应用前景广阔。目前对于纳米粒在细胞内的作用机制尚不清楚,有待进一步探讨。
