构建肿瘤免疫治疗PD-L1靶向PET分子探针68Ga-NOTA-WL12及生物学观察
2021-02-24蒋金泉刘特立徐晓霞郭晓轶
蒋金泉,李 丹,刘特立,夏 雷,徐晓霞,郭晓轶,朱 华*,杨 志
(1.德阳市人民医院放射科,四川 德阳 618000;2.北京大学肿瘤医院暨北京市肿瘤防治研究所核医学科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
抗程序性细胞死亡受体1(programmed death 1, PD-1)及其配体(programmed death ligand 1, PD-L1)信号通路的免疫阻断治疗可明显提高部分黑色素瘤、非小细胞肺癌、肾癌等多种实体肿瘤的客观缓解率[1-9]。肿瘤细胞表面PD-L1表达量与患者能否从抗PD-1/PD-L1信号通路治疗中获益存在一定相关性[10-12],故准确评估肿瘤患者体内PD-L1表达具有重要意义。目前临床主要通过免疫组织化学[13]方法检测肿瘤患者PD-L1表达情况并筛选适应证,但受限于PD-L1在肿瘤组织内表达的异质性及动态变化性[14-15]等因素,仅约30%经此法筛选出的PD-L1表达阳性肿瘤患者获益[16]。本研究以双功能螯合剂NOTA(2-[4,7-bis-(carboxymethyl)-[1,4,7]triazonan-1-yl]acetic acid)对WL12进行耦联,以68Ga标记,获得分子探针68Ga-NOTA-WL12,观察生物分布,评价其检测肿瘤PD-L1能力。
1 材料与方法
1.1 主要试剂 NOTA-WL12(上海强耀生物科技有限公司),醋酸钠、三氟乙酸(中国国药集团有限公司),乙腈(Merck),生理盐水(北京原子高科股份有限公司),浓盐酸、乙醇、正辛醇(北京化学试剂有限公司),异氟烷(河北一品制药股份有限公司),质量分数20%人血清白蛋白(HSA,成都蓉生药业有限责任公司),均为分析纯。
1.2 主要仪器 锗镓发生器(Isotope Technologies Garching),Hypersil BDS C-18反向色谱柱5 μm,250.0 mm×4.6 mm(YMC),C-18柱(Waters公司),放射性薄层色谱扫描仪(默克Radio-TLC),高效液相色谱仪(安捷伦),放射性测量活度计(Capintec),多探头全自动伽玛计数仪(Wiz-ard2),MatrxVIP 3000小动物麻醉系统(Mismark),小动物PET/CT(平生医疗科技有限公司)。
1.3 实验动物 正常雌性昆明鼠、非肥胖型糖尿病/严重联合免疫缺陷鼠(NOD/SCID)及BALB/c裸鼠均购自北京维通利华生物科技股份有限公司,6~8周龄,体质量18~20 g。遵照北京肿瘤医院实验动物操作规范完成实验,伦理批准号:2019KT62。中国仓鼠卵巢细胞(CHO)、人乳腺癌细胞(MDA-MB-231)均来自美国模式培养物集存库(ATCC)。稳定高表达人PD-L1的中国仓鼠卵巢细胞(CHO-hPD-L1)及小鼠模型来源于本实验室。
1.468Ga-NOTA-WL12制备及纯化 将4 ml 0.05 mol/L HCl缓慢推注至锗镓发生器,量取 3 000 μl68Ga淋洗液至EP管中,以1.0 mol/L NaAc将pH调至4.5,随后加入10 μl浓度为2 mg/ml的NOTA-WL12于上述EP管中,将反应体系置于孵育器60℃条件下反应15 min。待体系温度降至室温后,以2 ml注射器取出反应体系,加至已活化的C-18柱,用3 ml超纯水淋洗柱子,最后用0.7 ml 80%乙醇淋洗C-18柱,获得纯化后的标记产物68Ga-NOTA-WL12。
1.568Ga-NOTA-WL12质控 将反应后产物及纯化后产物各2 μl滴至TLC-SG试纸(宽度为1)下端1 cm处,并将试纸置于展开体系[1 ml生理盐水加20 μl饱和乙二胺四乙酸(EDTA)]中,待体系展开至距下端10 cm处时将其取出并晾干,行Radio-TLC扫描分析,并计算保留值。
采用高效液相色谱法(high performance liquid chromatography,HPLC),Hypersil BDS C-18反向色谱柱(5 μm,250.0 mm×4.6 mm),温度25℃,以体积分数0.1%的三氟乙酸水溶液为A相,体积分数0.1%的三氟乙酸乙腈溶液为B相,针对梯度流动相进行分析,使10~15 min B相由5%增加至80%、流速1.0 ml/min,观察放射性峰保留时间。
1.6 体外稳定性实验 取3.7 MBq68Ga-NOTA-WL12分子探针溶液,分别加至1 ml生理盐水和5% HSA溶液中,置于37℃条件下孵育,分别于10、30、60、120及240 min 后取200 μl标记产物,行Radio-HPLC分析。
1.7 脂水分布 取50 ml 0.01 mol/L磷酸缓冲盐溶液和50 ml正辛醇,混合均匀后静置24 h;以5个2.5 ml EP管分别取1.0 ml饱和后上层正辛醇和0.9 ml下层磷酸缓冲盐溶液,再加入0.1 ml含0.74 MBq68Ga-NOTA-WL12 的0.01 mol/L磷酸缓冲盐溶液,振荡混匀后3 000 r/min离心5 min,最后分别取100 μl上层正辛醇和下层磷酸缓冲盐溶液进行计数,以logP±SD表示脂水分布值。
1.8 生物分布 将15只体质量18~20 g雌性昆明小鼠随机分为5组,经尾静脉注射1.85 MBq68Ga-NOTA-WL12,分别于注射后15、30、60、120、240 min处死,解剖获得小鼠血、肺、心脏、肝脏、肾脏、脾脏、肌肉、股骨及脑组织,分别称重并进行γ计数。以注射剂量的1%为标准样本,同时计数,通过Excel和Prism8.0软件计算各脏器每克组织百分注射剂量率(%ID/g)。
1.9 小动物PET/CT显像 对PD-L1表达阳性的CHO-hPD-L1小鼠模型及阴性对照组人乳腺癌MDA-MB-231小鼠动物模型各3只(瘤体直径约1.0 cm)行PET/CT显像。经尾静脉注射约7.4 MBq68Ga-NOTA-WL12,分别于30、60、120 min进行PET显像,显像时间为15 min。行阻断实验以验证所得分子探针检测肿瘤PD-L1的特异性,对CHO-hPD-L1小鼠经尾静脉同时注射7.4 MBq68Ga-NOTA-WL12和50 μg未标记的WL12,分别于60、120 min进行显像,观察分子探针在肿瘤病灶内的摄取情况,测定并比较各时间点肿瘤病灶及肌肉标准摄取值(standardized uptake value, SUV)。
2 结果
2.168Ga-NOTA-WL12标记率及放射化学纯度 整个标记及纯化过程可于30 min内完成。对纯化前反应体系行Radio-TLC分析,得到68Ga对NOTA-WL12放射标记率为(98.68±0.06)%(n=3);对纯化后产物68Ga-NOTA-WL12分别行Radio-TLC和Radio-HPLC分析,结果显示纯化后标记化合物68Ga-NOTA-WL12放射化学纯度>99%,见图1。68Ga-NOTA-WL12终产物为无色透明溶液,pH 4.0~4.5。Radio-HPLC分析显示目标化合物68Ga-NOTA-WL12的保留时间为10.38 min。

图1 68Ga-NOTA-WL12 Radio-TLC及Radio-HPLC分析 A.纯化前产物的Radio-TLC结果; B.纯化后产物的Radio-TLC结果; C.纯化后产物的Radio-HPLC结果
2.268Ga-NOTA-WL12的体外稳定性 标记物68Ga-NOTA-WL12稳定性良好,在生理盐水体系中放置240 min,放射化学纯度仍高达99%;5% HSA体系中放置240 min 后放射化学纯为97%,见图2。脂水分布值为-0.191±0.046,表明该分子具有相对良好的水溶性。
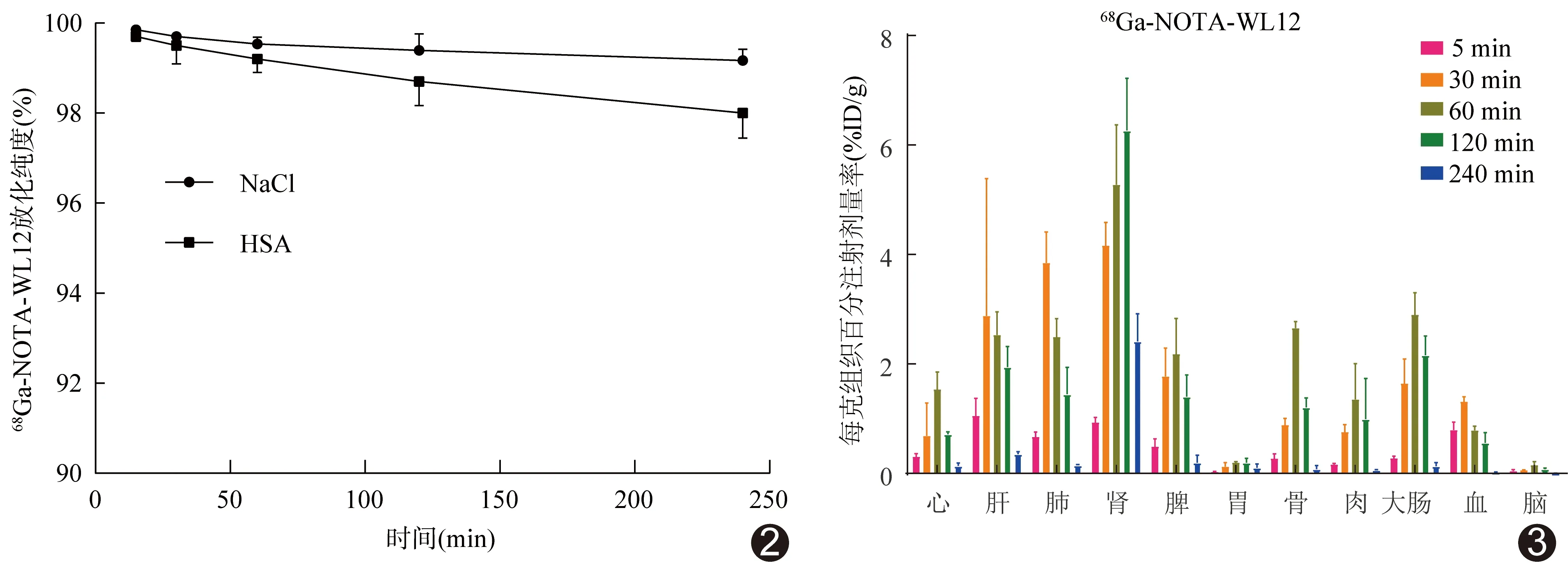
图2 68Ga-NOTA-WL12体外稳定性分析结果 图3 68Ga-NOTA-WL12在正常昆明小鼠体内生物分布情况
2.368Ga-NOTA-WL12体内分布 经尾静脉对正常昆明小鼠注射1.85 MBq68Ga-NOTA-WL12后不同时间点各脏器生物分布见图3,肝肾摄取水平较高。
2.4 PET/CT显像68Ga-NOTA-WL12主要分布于肝脏、肾脏及膀胱,且在PD-L1表达阳性肿瘤病灶中浓聚;阻断实验小鼠肿瘤病灶对分子探针摄取明显降低,对照小鼠各时间点内肿瘤病灶内未见明显分子探针摄取,肿瘤病灶与肌肉SUV比值均小于1.5。
3 讨论
多项研究[17-20]表明,以放射性核素标记对PD-1/PD-L1信号通路有特异靶向性的单克隆抗体、纳米、多肽分子作为分子探针并进行PET显像,有望实时、动态、准确评估肿瘤患者体内PD-L1表达及变化情况,并用以筛选可自治疗中获益的肿瘤患者。WL12是对PD-L1具有特异靶向性的环状多肽[21]。本研究制备分子探针68Ga-NOTA-WL12,并观察其生物学特性。
本研究利用双功能螯合剂NOTA对PD-L1特异靶向的环状多肽分子进行耦联和68Ga标记,成功获得了分子探针68Ga-NOTA-WL12。通过NOTA分子耦联,在60℃、pH 4.5条件下,68Ga对NOTA-WL12可于15 min内获得98%标记率;体外稳定性实验结果显示该分子探针4 h内在生理盐水及HSA中均有良好稳定性,为进一步体内动物实验提供了基础;脂水分布值为-0.191±0.046,表明该分子具有相对良好的水溶性,这可能是生物分布和小动物PET显像中肝脏较高摄取的原因。注射后4 h内该分子探针在小鼠体内各脏器中呈现逐渐上升、之后降低趋势,2 h后主要分布于肝、肾及肠道中,与小动物PET显像结果基本相符。肝脏高摄取可能与该分子探针的脂溶性及代谢相关,肾脏高摄取可能与其代谢相关。2 h内肿瘤内分子探针逐渐浓聚,通过共注射方式可明显阻断肿瘤病灶摄取分子探针,而肝肾等摄取未见明显降低;该分子探针在PD-L1表达阴性肿瘤病灶中未见明显摄取,证实其可用于特异性检测肿瘤病灶内PD-L1表达。
本研究所制备的68Ga-NOTA-WL12为标记率高、稳定性良好且对肿瘤内PD-L1具有特异靶向性的分子探针,但在肝肾内的非特异性浓聚较高,需要进一步改进。

图4 小动物PET/CT显像 A.CHO-hPD-L1小鼠模型各时间点PET/CT显像及其阻断实验显像; B.CHO-hPD-L1小鼠模型各时间点肿瘤病灶与肌肉SUV比值(*:P<0.001); C.阴性对照MDA-MB-231小鼠模型各时间点PET/CT显像; D.阴性对照组MDA-MB-231小鼠模型各时间点肿瘤病灶与肌肉SUV比值
