萱草属植物小孢子发育与花蕾长度相关性及花药培养初探
2021-02-24程宵婧王荣梅翟毕娇公菲菲侯非凡王金耀邢国明亢秀萍
程宵婧,王荣梅,翟毕娇,公菲菲,侯非凡,王金耀,武 江,邢国明,亢秀萍,李 森
(1.山西农业大学园艺学院,山西省设施蔬菜提质增效协同创新中心,山西太谷 030801;2.大同黄花产业发展研究院,山西大同 037004)
萱草属(Hemerocallis)植物是多年生草本植物,多为二倍体材料[1],该属植物遗传周期长达3~4 a,且遗传背景复杂,杂合度较高,种间和种内生殖隔离严重,创制优良种质进程缓慢,开展基因组学研究较为困难。
利用花药培养单倍体是一种在遗传改良、简化遗传背景上具有极大优越性的育种方式,是一种可在短暂时间内快速获得由隐性性状得到充分体现的双单倍体,缩短了选育时间。此外,利用纯合体进行基因选择的误选频率较低,选择效果较高[2]。世界上第1 株单倍体植株是曼陀罗花药培育得到的[3],而后花药培养被运用到烟草上,并且受到了广泛的关注。我国于1972 年开始对花药培养进行研究,目前已经在番石榴、柑橘、小麦等多种植物成功诱导并得到单倍体植株[4-6],但是萱草属植物培育单倍体植株未见成功。萱草属植物花蕾内含有6 个花药,每个花药内含有由小孢子发育而来的花粉粒。单倍体培养技术对于创制具有优良性状的萱草属植物纯合种质、加速萱草属植物育种进程具有深远研究意义。
开展小孢子发育过程细胞学观察是明确花药培养时期的关键前期基础,是花药培养获得单倍体植株的关键步骤[7]。植物材料的基因型、培养基蔗糖含量和激素配比是影响花药培养的重要因素[8]。DIAS[9]对10 个青花菜基因型小孢子进行培养,仅7 个基因型能够在大量元素较少的培养基中获得高的胚诱导率。马菊兰等[10]对苜蓿的研究表明,2.0 mg/L 2,4-D、0.5 mg/L 6-BA 和6%~9%蔗糖可以提高花药愈伤组织的诱导率。
本试验对山西农业大学萱草属植物种质资源圃中28 份种质材料进行小孢子发育时期细胞学观察,并对花蕾大小与小孢子发育时期的关系进行分析,对萱草属植物花药离体培养条件进行探索,旨在为下一步研究萱草属植物单倍体育种技术奠定基础。
1 材料和方法
1.1 试验材料
试验材料为28 份萱草属种质材料(表1),取自山西农业大学园艺站萱草属植物种质资源圃。

表1 供试材料情况
1.2 花粉小孢子细胞学观察及花蕾长度测量
在各萱草属种质材料开花前取不同时期的花蕾,用数显游标卡尺测量花蕾长度,重复6 次。将洗净后的花蕾固定于卡诺氏固定液中,置于4 ℃冰箱中固定12 h 后,采用95%无水乙醇清洗后置于1 mol/L 盐酸中60 ℃水浴3 min,再取出花蕾中的花药使小孢子散出,用卡宝品红染色后制片,在显微镜下观察不同时期花药内部小孢子的细胞形态特征并拍照。
1.3 花药预处理
取28 份萱草属种质处于单核靠边期的花蕾,置于4 ℃冰箱低温预处理24 h 后,流水冲洗5 min放在超净工作台上备用,用75%的酒精处理30 s,灭菌双蒸水清洗1~2 次,用0.1%升汞处理6 min,灭菌双蒸水清洗2~3 次,将花蕾解离,取出花药备用。
1.4 花药离体培养基因型、蔗糖浓度和激素浓度比例的筛选
以MS 培养基为基本培养基,添加4 mg/L 维生素B1促进愈伤组织的生成,花药离体培养的基因型筛选采用培养基Y1、Y2,蔗糖浓度筛选采用培养基T1~T3,激素浓度筛选采用培养基H1~H28,各培养基配方如表2 所示。每个处理30 瓶,每瓶接种6 个花药,重复3 次。培养室温度(25±2)℃、遮光布遮盖进行暗培养。每天记录不同处理花药离体培养效果,45 d 后统计愈伤率。
1.5 数据统计与分析
使用Excel 2019 和SAS 9.2 分别进行试验数据统计和方差分析。


表2 培养基配方
2 结果与分析
2.1 小孢子发育时期的细胞学观察
对28 份萱草属植物连续动态的花药小孢子发育时期进行细胞学观察,获得萱草属植物小孢子各发育时期的特征,如图1 所示。通过观察可将小孢子发育过程分为6 个时期,即小孢子母细胞时期、减数分裂期、单核前期、单核靠边期、二核三核期、成熟花粉粒时期。单核靠边期时细胞体积增大达到正常大小,细胞核变小,液泡将细胞核挤向细胞壁较厚的一侧。

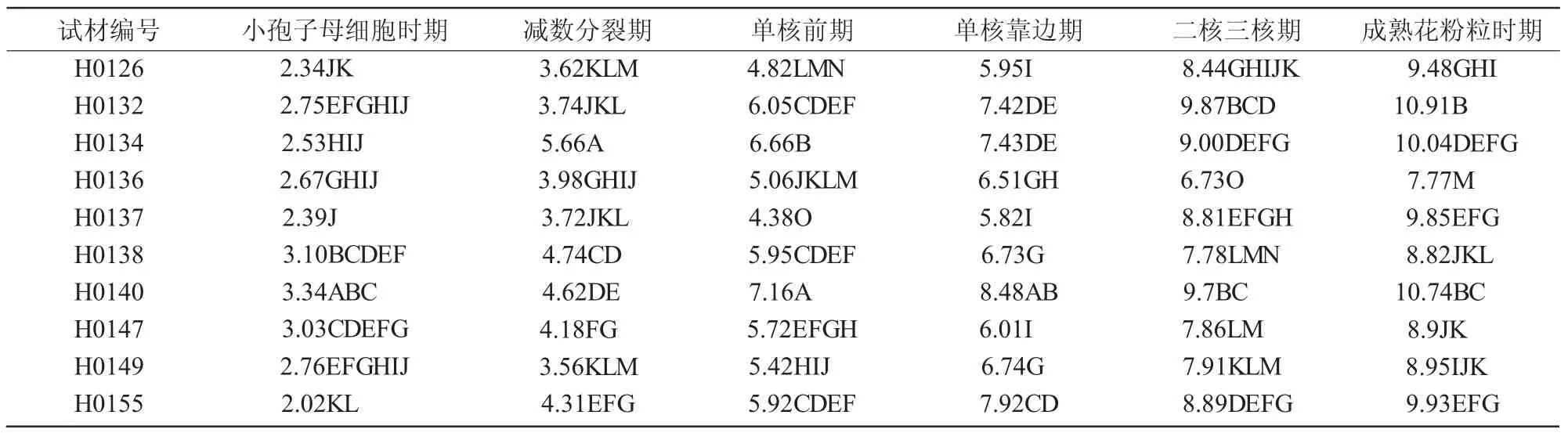
2.2 28份萱草属植物花蕾长度与小孢子发育时期的关系分析

表3 萱草属植物小孢子各发育时期花蕾长度比较 mm
续表3
不同萱草属植物小孢子发育时期对应花蕾长度不同。由表3 可知,各萱草属植物随着小孢子发育成熟,花蕾长度也随之增加。小孢子母细胞时期、减数分裂期、单核前期、单核靠边期、二核三核期、成熟花粉粒时期的花蕾长度分别为1.87~3.50、3.28~5.66、4.38~7.16、5.82~8.74、6.73~11.52、7.77~12.56 mm。
2.3 萱草属植物花药离体培养条件分析
2.3.1 基因型对萱草属植物花药离体培养效果的影响
由表4 可知,在28 个萱草属种质资源中,仅4 个基因型诱导出愈伤组织。H0003 在Y1 培养基中可以诱导出绿色致密愈伤组织,愈伤率最高,可达90%,在Y2 培养基中未诱导出愈伤组织;H0006、H0021均能产生愈伤组织,但颜色稍有差异;H0095 诱导愈伤效果较差,产生黄白色愈伤组织,后期褐化。
2.3.2 蔗糖浓度对萱草属植物花药离体培养效果的影响 由表5 可知,在蔗糖质量浓度为30 g/L 时,H0006 和H0095 均在花药膨大后发生褐化。随着蔗糖质量浓度升高,花药培养效果显著改善,且H0006 愈伤率始终高于H0095。
2.3.3 激素配比对萱草属植物花药离体培养效果的影响 28 份萱草属植物在H1~H10 培养基培养效果较好,在其余培养基培养最终导致花药褐化失活。由表6 可知,与H1(0 mg/L 2,4-D+0 mg/L KT)培养基相比,添加不同浓度的2,4-D、KT 的培养基中均能诱导出愈伤组织,但愈伤组织质量存在差异,H0003 于H3 培养基中培养效果较好,产生绿色致密愈伤组织,适于分化培养。H0006 于H3 和H7培养基中培养效果较佳,愈伤率可达90%。

表4 基因型对萱草属植物花药离体培养效果的影响

表5 蔗糖浓度对萱草属植物花药离体培养的影响

表6 激素浓度配比对花药离体培养的影响
3 结论与讨论
植物雄核的离体培养主要包括小孢子培养和花药培养,少数植物可以通过离体花蕾培养获得单倍体[8]。雄核发育的多样性一般与小孢子发育时期、基因型和培养条件等因素有关[8]。小孢子发育时期是影响花药培养的关键因素,植物花粉小孢子发育是一个动态过程,可分为6 个时期:小孢子母细胞时期、减数分裂期、单核前期、单核靠边期、二核三核期以及成熟花粉粒时期。花药在不同发育阶段诱导愈伤组织的能力明显不同。成熟花药不能诱导产生胚状体,通常处于单核前期,单核靠边期的花药诱导效果最好[11]。本研究中使用了单核靠边期的花药进行组织培养,这与丹参[12]、番茄[13]进行花药培养所选外植体时期一致。
基因型在植物花药离体培养过程中影响效果显著。甘泉等[14]通过对16 个不同基因型的粳稻进行花药离体培养,结果表明,不同基因型粳稻的愈伤诱导能力不同且分化效果差异显著。本试验中28 种不同基因型材料花药离体培养效果差异显著,仅4 个基因型能诱导出愈伤组织,在相同培养条件下H0003 生长状态最好,H0006、H0021 次之,H0095 培育效果较差,这与前人研究结果一致。
在植物花药离体培养中,培养条件对花药培养效果也具有一定影响。不同蔗糖浓度条件下,离体雄核诱导发育效果不同。李冰冰[15]在培养基中添加20 g/L 蔗糖培养韭菜花药,成功诱导出组培苗。在本试验中,H0006 的花药接种于含有30 g/L 蔗糖的培养基中外植体先膨大后逐渐褐化,生长状况差,随着蔗糖浓度的升高,褐化现象减弱,愈伤组织颜色由黄绿色到绿色,花药培养效果显著提高;H0095在90 g/L 蔗糖的培养基中才能诱导出黄绿色愈伤组织,在蔗糖浓度低的情况下,花药均褐化,说明H0095 适合在蔗糖浓度高的培养基中产生愈伤。
2,4-D、BA、KT、ZT 等激素对花药离体培养效果影响显著。甜菊花药在1.5 mg/L 6-BA+0.5 mg/L NAA 的培养基中极易诱导愈伤;草莓花药在1.0 mg/L 6-BA+2.0 mg/L 2,4-D 的培养基上最易诱导且促进花药愈伤组织形成;仙客来花药在0.1 mg/L NAA+1.0 mg/L 6-BA 的培养基中诱导愈伤[16-18]。在本试验中,设置2,4-D 和KT、6-BA 的不同浓度梯度组合,2,4-D 和KT 较适合于萱草属植物花药离体培养,不同基因型材料之间培养效果差异显著。
本试验对萱草属植物花药进行离体培养研究获得了阶段性研究成果,为选择小孢子的适宜选材时期和最佳培养基提供了直接证据,为小孢子培养单倍体植株奠定了前期基础。
