红花香椿组培及植株再生技术研究
2021-02-24郑雪燕郑天汉彭王勋
郑雪燕,李 勇,郑天汉,彭王勋,郑 宏
(1.福建省洋口国有林场,福建顺昌 353200;2.福建省林业局,福建福州 353000)
红花香椿(Toona rubriflora Tseng),楝科香椿属落叶大乔木,高约18 m,胸径可达60 cm以上,树皮灰色,有纵向裂缝,小枝圆柱形。叶为偶数或奇数羽状复叶,小叶互生或近对生,纸质,卵状长圆形至卵状披针形,长4.5~13.0 cm,宽2~4 cm,花小,5月开花,紫红色,树冠伞形、圆锥形,树姿婆娑优美,树体通直,为速生优良的造林绿化树种。心材红色,具有较强的木材利用价值。随着人们对美好生活环境的要求不断提高,对新型木材的追求越来越高,对具有美化环境作用的观叶树种的要求也在不断提升,红花香椿正成为百姓喜欢的观叶树种和用材树种,规模化培育红花香椿苗木成为必然。
红花香椿主要靠种子繁殖苗木,育苗时发芽率低,出苗迟缓,苗木大小参差不齐,出圃率低。现阶段主要采用营养杯育苗方式培育苗木,该研究采用组织培养的方式进行无性繁殖育苗,既能保持母本的优良遗传特性,又能在短期内生产出一定数量的无性系苗木,探索出一套红花香椿无性快繁技术方法,为红花香椿品种改良和利用打下基础[1]。
1 材料与方法
1.1 材料
1.1.1 植物材料。在福建省顺昌县省洋口国有林场红花香椿子代测定林里筛选出1个优良红花香椿家系11号作为组培材料。
1.1.2 培养基及培养条件。以M S、3/4M S、1/2M S为基本培养基。分别附加6-BA 0.1、0.2、0.3 mg/L 3个浓度水平与NAA 0、0.05、0.1 mg/L 3个浓度水平,采用L9(34)正交试验设计诱导培养基,每个处理接种50个无菌茎段材料,培养30 d统计发芽率及出芽指数。培养基中蔗糖浓度为30 g/L,琼脂为6.5 g/L,p H 5.8~6.0,培养温度为(26±2)℃,光照14 h/d,光照强度2 000~3 000 l x。
1.2 方法
1.2.1 外植体的诱导及培养。观察红花香椿萌芽条生长情况,以当年细嫩芽条且半木质化穗条为试验材料,剪下侧芽饱满的穗条,用自来水冲洗干净,剪成4~5 cm长的茎段,先用75%酒精浸泡40 s,再用0.1%Hg C l2溶液中振荡消毒10 min。最后用经高压灭菌的蒸馏水冲洗8~10次,然后用滤纸吸干外植体表面水分,将叶片切除,并将带有单芽的茎段切成长0.5~0.8 cm,接种在诱导培养基上[2]。
1.2.2 丛生芽培养。参考诱导培养基中丛生芽发生及分化结果,以DCR、1/2DCR、3/4DCR为培养基,附加6-BA 0.1、0.2、0.3 mg/L与NAA 0、0.02、0.04 mg/L形成9种激素浓度梯度的增殖培养基。每个培养基分别接入20丛诱导出的新芽,观察分析每个培养基丛生芽分化情况及有效芽苗率,最终确定最适宜的继代培养基。
1.2.3 生根培养。以改良M S为生根培养基,添加IBA、NAA等9种不同生长素浓度梯度的组合,接入3 cm长的有效芽苗,观察不同浓度生长对芽苗生根的影响,最终选出生根率最高、最快的生根培养基。
1.2.4 指标测定。根据不同培养基及激素配比对照,分别观察和统计红花香椿诱导出芽率、出芽个数、增殖倍数、有效芽数、生根率、平均根数等指标,利用S P SS 13.0对数据进行双因子方差分析,分析出一组最适红花香椿离体培养的组培配方。
1.2.5 移栽管理。当芽苗的根长至3~4 cm时,侧根有1~2条,即可将组培生根苗移栽至温室大棚内进行炼苗试验,经1周炼苗后,将生根苗用镊子轻轻取出、洗净培养基。移栽至轻基质营养袋中进行培育,移栽后做好水肥、温度、湿度、光照、通风等育苗措施的管理。
2 结果与分析
2.1 芽器官诱导
采集的穗条木质化程度适中、灭菌时间适中、材料完整无损伤。接入不同培养基20 d后,观察结果(表1),部分茎段外植体培养20 d后,腋芽开始膨大,30 d后,小芽长至0.5~1.2 cm,且部分出现丛生芽。
从表1可以看出,3/4M S培养基更适合红花香椿茎段的诱导,3/4M S+6-BA 0.1-0.3 mg/L+NAA 0-0.1 mg/L均可诱导出小芽,出芽率随6-BA浓度增加而增加,当6-BA 0.2 mg/L、NAA 0.1 mg/L时,出新芽的比例较高。是较适宜的诱导培养基。
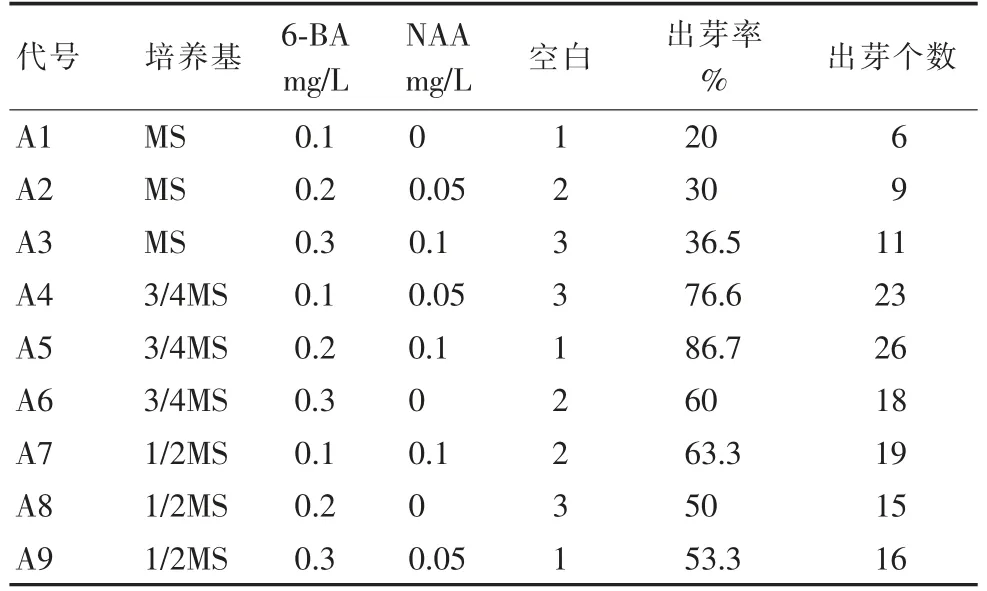
表1 培养基对诱导培养的影响
2.2 丛芽继代培养
当红花香椿芽苗诱导培养30 d后,小芽长到0.5~1.2 cm长时,即可转入配制好的继代培养基中(表2)。

表2 不同激素培养基对丛生芽继代培养的影响
据观察,丛生芽发生有2种类型,A型是腋芽发生型,是由新芽腋芽处生出多个不定芽而形成的丛生芽。这种类型的丛生芽的特点是月增殖倍数为3~4倍,小芽容易抽茎展叶,小苗表现为粗壮、直立,叶子大小正常,叶色深绿,可以得到较多有效苗。B型是愈伤发生型,是由愈伤团发生的不定芽,这种类型的愈伤团较难形成,小苗发生畸形率高。丛生芽继代试验结果表明,在基本培养基1/2DCR上进行试验,1/2DCR+6-BA 0.2 mg/L'+NAA 0.04 mg/L使丛生芽的增殖倍数最高。
2.3 生根苗的诱导
在经过数次继代后可获得大量的无根有效苗,切取长度2~3 cm的有效芽苗接到生根培养基中进行生根培养试验.根据不同培养基及不同生长素组合对生根的影响,选出最佳的生根培养基(表3)。

表3 培养基对生根苗培养的影响
试验结果表明:不同的基本培养基及不同激素组合对生根的影响十分显著,生根培养基采用改良M S+IBA 1.0 mg/L+NAA 0.05 mg/L生根率最为理想,但IBA达到1.5 mg/L以上时生根率明显降低。培养20 d后,芽苗生长正常,根系正常,有1~2条白色根。培养30 d后,至小苗健壮、木质化程度较高时,可移栽及炼苗。
2.4 红花香椿组培苗的移栽
温室大棚内组培苗移栽试验结果:生根苗未在温室中炼苗1周后,移栽至黄红壤中,2019年2月10日移栽合格瓶苗2 000株,成活1 308株,成活率65.4%,2019年3月16日移栽合格瓶苗3 000株,成活1 729株,成活率57.63%,平均成活率为61.51%。
温室大棚内组培苗移栽试验结果:生根苗在温室中炼苗1周后,移栽至黄红壤中,2019年2月10日移栽合格瓶苗2 000株,成活1 905株,成活率95.25%,2019年3月16日移栽合格瓶苗3 000株,成活2 740株,成活率91.33%,平均成活率为93.29%。结果表明:生根苗炼苗与未炼苗的组培苗移栽成活率明显不同,采用在温室中炼苗1周后的组培苗移栽成活率明显增高。不同时间移栽的组培苗成活率也明显不同。
3 结论与讨论
3.1 细胞分裂素浓度对不定芽发生的影响
组织培养过程中芽条的生长是在低细胞分裂素或无细胞分裂素的培养基上培养[3]。诱导培养基上不定芽的诱导频率,不定芽数及不定芽的发生能力随着附加细胞分裂素使用浓度的升高而提高。6-BA浓度为0.2 mg/L时,不定芽的诱导频率、不定芽数及不定芽的形成能力最高,但当6-BA和NAA的浓度过高时,不定芽的伸长生长受到明显抑制,诱导出的不定芽出现玻璃化现象。这是由于丛生芽在培养基上培养时,累积了较高的细胞分裂素的原因[4]。
3.2 组培发生体系的研究
该研究建立了红花香椿茎段诱导及植株再生体系,现器官组织培养研究主要有2种方法,一种主要采取愈伤组织诱导不定芽途径,据报道,该途径的组培苗产生的变异较大[5]。目前多数采用不定芽诱导及丛生芽培养而获得相应的快速繁殖体系,其遗传稳定性相对较好,并在生产中取得较大成功。
