淹水胁迫对4种暖季型草坪草光合特性的影响
2021-02-22宗俊勤高艳芝陈静波李丹丹李建建李玲刘建秀
宗俊勤 高艳芝 陈静波 李丹丹 李建建 李玲 刘建秀

摘 要:为了筛选耐淹护坡植物,本研究以双穗雀稗(Paspalum paspaloides)、伪针茅(Pseudoraphis spinescens)、海滨雀稗(P. vaginatum)和假俭草(Eremochloa ophiuroides)4种暖季型草坪草为材料,研究不同淹水时间(0、6、12、18、24、30 d)处理对上述材料生长、叶绿素含量和叶片光合参数的影响。结果表明:淹水胁迫对双穗雀稗和伪针茅地上与根系生长未产生显著影响,但显著抑制了海滨雀稗和假俭草地上和根系生长;假俭草和海滨雀稗的光合色素含量呈明显的下降趋势,而双穗雀稗和伪针茅的光合色素含量保持相对稳定,到淹水后期其含量反而有所升高。此外,海滨雀稗和假俭草的净光合速率(Pn)随淹水时间的延长显著下降,而双穗雀稗和伪针茅的光合作用保持相对稳定,在淹水胁迫30 d时反而有所提高;淹水胁迫对伪针茅和双穗雀稗的气孔导度(Gs)、蒸腾速率(Tr)没有显著影响,而在淹水胁迫30 d时,海滨雀稗和假俭草的Gs分别较对照降低了25.7%和37.7%。结果表明,双穗雀稗和伪针茅在淹水胁迫下能够保持稳定的光合作用,生长未受到明显的影响,具有很强的耐淹性,是河湖库区优良的固土护坡植物。
关键词:暖季型草坪草;生物量;淹水胁迫;光合特性
中图分类号:S688.4 文献标识码:A
Abstract: In order to screen slope protection plants, four warm-season turfgrasses, including knotgrass (Paspalum paspaloides), spiny mudgrass (Pseudoraphis spinescens), seashore paspalum (P. vaginatum), and centipedegrass (Eremochloa ophiuroides) were waterlogged under different time (0, 6, 12, 18, 24, 30 d). The results found that the shoot and root growth of knotgrass and spiny mudgrass were not significantly affected by waterlogging stress, but those of seashore paspalum and centipedegrass were. Photosynthetic pigment content showed a significant decrease in centipedegrass and seashore paspalum under waterlogging stress, especially in centipedegrass; while it maintained at a relatively stable level in knotgrass and spiny mudgrass, and even showed an increasing trend in the later stage of waterlogging stress. The net photosynthetic rate (Pn) in the leaves of centipedegrass and seashore paspalum decreased significantly with the time extension of waterlogging stress, while it remained relatively stable in the leaves of knotgrass and spiny mudgrass under waterlogging stress. The stomatal conductors (Gs) and transpiration rate (Tr) of knotgrass and spiny mudgrass were not significantly affected by waterlogging stress, while the Gs of seashore paspalum and centipedegrass significantly decreased by 25.7% and 37.7% compared with the control, respectively, on the 30th day of stress. These results indicate that knotgrass and spiny mudgrass can maintain normal plant growth and stable photosynthesis under waterlogging stress, showing that they have strong tolerance to waterlogging and are excellent soil stabilization and slope protection plants for river, lake and reservoirs.
Keywords: warm-season turfgrass; biomass; waterlogging stress; photosynthesis
DOI: 10.3969/j.issn.1000-2561.2021.01.019
隨着全球气候变化的加剧,世界范围内洪水的发生频率和严重程度逐渐增加,从而导致植物生长面临土壤淹水胁迫也越来越频繁[1-2]。淹水是一个重要的自然胁迫因素,威胁着大量物种的生存[3]。土壤淹水后,直接造成根际土壤环境缺氧,根系呼吸会受到淹水胁迫的抑制,限制了对营养和水分吸收[4-5],进而影响植株地上部分的正常生长[6]。因此,淹水胁迫往往会降低作物的生长和产量,甚至危及植物的生存。
光合作用作为植物生存和生长的最重要的代谢过程,容易受到环境胁迫的抑制。在淹水胁迫下,耐淹性较强的植物种类或品种对光合作用的影响较小,而耐淹性较弱的植物光合速率却大大降低,特别是湿地原生植物在不限制光合作用的情况下更能适应淹水条件[4,7-9]。因此,分析植物在淹水情况下的光合特性是诊断植物耐淹性的有效方法。在正常情况下植物中的叶绿素含量相对稳定,保证植株正常的光合作用,淹水胁迫下植株叶片分解代谢增强和合成代谢受阻,引起叶片中叶绿素含量下降,更加剧了光合作用的下降幅度,使得同化物显著降低,随着淹水时间的延长叶片逐渐失绿变黄,最终衰老脱落[10-11]。然而,耐淹性强的植物,在淹水初期由于植物的应激反应,气孔迅速关闭,当其适应了外界环境之后,气孔又可重新开放[12],并一直保持开放的状态,这种部分气孔的再次开放及保持保证了落羽杉[Taxodium distichum (L.) Rich.]和洋白蜡(Fraxinus pennsylvanica)在水淹胁迫下的正常生长[13]。气孔限制导致的二氧化碳可用性降低,被认为是淹水对光合作用的初始负面影响,因为植物需要通过气孔关闭防止叶片蒸腾造成水分损失[14]。淹水胁迫后,耐淹性较弱植物的叶片碳水化合物可能在数天内迅速积累,因为根系呼吸抑制通过降低根系中糖分的消耗来限制糖分从茎到根的转移,光合同化产物在叶片中的积累会对光合速率形成负反馈抑制[15-16]。
暖季型草坪草由于经常性的频繁大雨或过度灌溉后排水缓慢而遭受不同程度的淹水胁迫。不同植物对淹水胁迫的耐受能力相差较大。Zong等[17]前期对双穗雀稗(Paspalum paspaloides)、伪针茅(Pseudoraphis spinescens)、海滨雀稗(Paspalum vaginatum)及假俭草(Eremochloa ophiuroides)的耐淹性及其在淹水胁迫下的生理变化进行了研究,发现双穗雀稗的耐淹性较好,其次是伪针茅和海滨雀稗,而假俭草的耐淹性最差,淹水胁迫下植物根系活力越高、根系乳酸脱氢酶和乙醇脱氢酶活性增加越少、抗氧化酶活性和可溶性蛋白含量浓度维持较低水平可能是其耐淹能力较强的原因。Bush等[18]的研究结果表明,淹水胁迫显著提高了地毯草(Axonopus compressus)和假俭草组织中铁、锰的含量,且在淹水6周后仍然能够存活。韩文娇等[19]研究了水淹胁迫对狗牙根(Cynodon dactylon)光合作用的影响,结果表明表土水淹处理的狗牙根净光合速率、气孔导度、蒸腾速率和气孔限制值均显著降低,胞间CO2浓度显著增加。刘送平等[20]研究了植株全部淹没条件对双穗雀稗、空心莲子草(Alternanthera philoxeroides)、牛鞭草(Hemarthria altissima)和狗牙根的光合色素含量的影响,发现在全淹条件下,4种植物通过增大叶绿素a/b值,以适应水淹环境。尽管淹水胁迫下,不同暖季型草坪草光合特性的变化已有部分研究,但多集中于淹水胁迫解除后的恢复阶段光合特性分析[21-23],而对淹水胁迫下耐淹性不同的暖季型草坪草光合特性的研究鲜有报道,因此研究耐淹性不同的暖季型草坪草在淹水胁迫下的光合特性变化情况可以帮助我们进一步了解不同植物的耐淹性机理。
本研究以耐淹性不同的双穗雀稗、伪针茅、海滨雀稗及假俭草4种暖季型草坪草为试验材料,分析不同材料的生长、叶片叶绿素含量及其光合特性等方面对模拟淹水胁迫的响应情况,以期为临近洪泛区的绿化和固土护坡选择合适的材料提供技术支撑。
1 材料与方法
1.1 材料
本研究以4种耐淹性不同的暖季型草坪草新品系为研究材料,其中,双穗雀稗和伪针茅的耐淹性较强,海滨雀稗和假俭草的耐淹性较弱[24]。所有材料均在江苏省中国科学院植物研究所草业中心试验地进行培养(北纬32?02,东经118?28,海拔30 m)。
1.2 方法
1.2.1 培养方法 2014年6—9月,選取长势一致至少带1个腋芽的匍匐茎段扦插种植于装有基质(沙∶土=1∶4)的塑料花盆中(花盆高12 cm,直径14 cm),材料种植后培养2个月。培养期间每10 d进行1次修剪,根据不同草种的生长特性,假俭草和海滨雀稗的修剪高度为5 cm,伪针茅和双穗雀稗的修剪高度为10 cm。当盆中盖度达到80%以上后停止修剪,再培养一段时间后挑选生长状况接近的材料开始试验,试验持续30 d。
利用“双套盆法”对材料进行淹水处理[24],将修剪后的参试材料连花盆一起放入注有蒸馏水的高25 cm、直径29 cm的水桶中,使水面高出土面2~3 cm,分别在淹水胁迫0、6、12、18、24、30 d时进行取样;而对照植株的土壤含水量保持在田间持水量的50%~60%的范围内。每个草种选取56盆进行试验,其中6个淹水胁迫时间,每个时间点对照和处理各4盆,最后试验结束时对照和处理各4盆用于测定生物量。试验期间不供给营养,同时为了弥补因水分蒸发及植物蒸腾等因素造成的水分损失,每3 d对水桶进行补水使其水面始终保持特定的高度,每5 d换水1次,适时去除水中的水藻等杂质,维持水体透明,以保证植物正常光合作用。
1.2.2 测定方法 (1)相对生物量的测定。茎叶干重:在淹水胁迫30 d后,收获材料并洗净泥土等杂质,剪除根系的茎秆于80 ℃的恒温条件下烘干至恒重并称重,相对茎叶干重=淹水处理后的茎叶干重(g)/对照茎叶干重(g)×100%。根系干重:在淹水胁迫30 d后,将材料从花盆中取出,洗净泥土等杂质后将根系从植株上分离,分离出的根系鲜样于80 ℃恒温条件下烘干至恒重并称重,相对根系干重=淹水处理后的根系干重(g)/对照根系干重(g)×100%。
(2)叶片中光合色素含量的测定。光合色素含量测定采用刘家尧等[25]的方法,即浸提24 h测定叶片光合色素含量[19]。分别在淹水处理0、6、12、18、24、30 d时取处理和对照相同叶位新鲜的成熟功能叶,称取0.02 g剪碎放入10 mL试管中加5 mL 95%乙醇提取液,于黑暗条件下浸提24 h。利用752-紫外可见分光光度计(上海仪电分析仪器有限公司)测定提取液OD470、OD649、OD665的光密度。
(3)叶片光合参数的测定。分别在淹水处理0、6、12、18、24、30 d时,在上午09:00—12:00随机选取植株相同叶位的叶片,利用Li- 6400XT型便携式光合仪(Li-Cor 6400XT,Li-Cor Inc,USA)测定叶片净光合速率[Net photosynthetic rate,Pn,μmol/(m2·s)]、气孔导度[Stomatal conductance,Gs,mmol/(m2·s)]、细胞间隙CO2浓度[Intercellular CO2 concentration,Ci,μmol/mol]、蒸腾速率[Transpiration rate,Tr,mmol/(m2·s)]。测定时设定CO2为400 μmol/L,光强为1000 μmol/(m2·s)。每次测定均选取长势良好的相同叶位的成熟叶片,一般选由上到下第2~3片叶,每个重复至少独立测定3片叶子,取其平均值作为该重复光合参数的最终测定值。
1.3 数据分析
用Excel 2003软件对数据进行整理并作图,并用SPSS 13.0软件对数据进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 淹水胁迫对4种暖季型草坪草生物量的影响
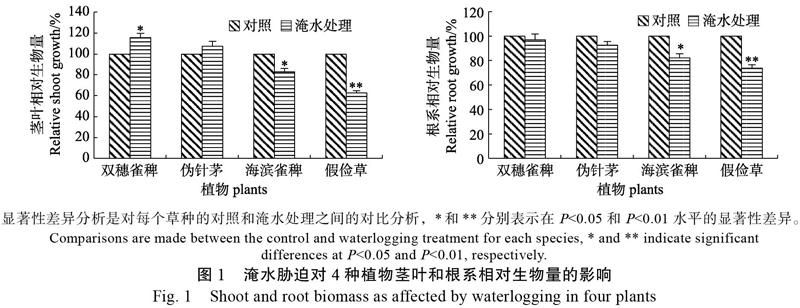
从图1可见,供试材料在经过30 d的淹水胁迫处理后,与对照相比,显著促进了双穗雀稗茎叶的生长,而伪针茅变化不显著,但海滨雀稗受到显著抑制、假俭草受到极显著抑制,上述材料的茎叶生长量分别为对照的115.68%、107.47%、82.86%、62.55%。在根系生长方面,双穗雀稗、伪针茅未受到显著影响,但海滨雀稗的根系生长受到了显著抑制、假俭草受到了极显著抑制,其相对生长量分别为对照的97.06%、92.63%、82.16%、73.80%。4份材料在淹水胁迫下的茎叶生长量和根系生长量的变化表明,耐淹性强弱依次为双穗雀稗>伪针茅>海滨雀稗>假俭草。
2.2 淹水胁迫对4种暖季型草坪草叶片叶绿素a、b和类胡萝卜素含量的影响
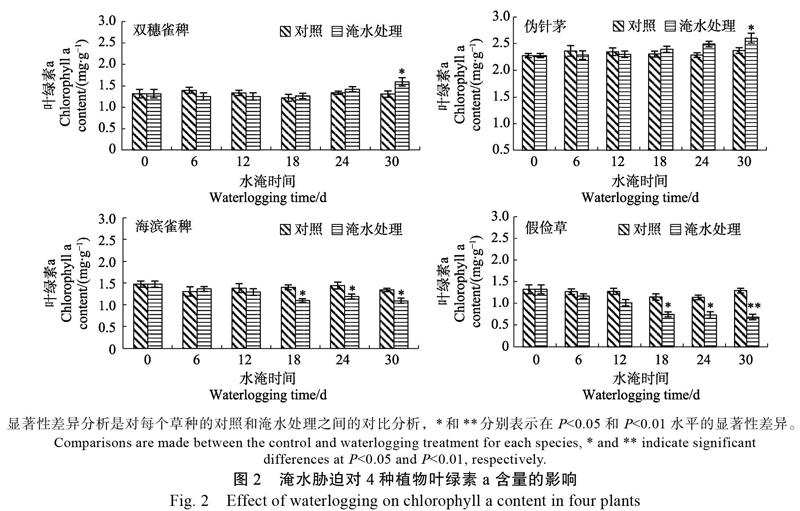
2.2.1 叶绿素a含量的变化 从图2可见,淹水胁迫时间达到18 d后,耐淹性较弱的假俭草和海滨雀稗的叶绿素a含量受到较大的影响,呈现显著的下降趋势;在淹水胁迫处理30 d时,假俭草叶绿素a含量为0.58 mg/g,比对照下降了55.06%,下降幅度最大;海滨雀稗叶片中叶绿素a含量为1.09 mg/g,与对照相比下降了16.73%;而耐淹性较强的双穗雀稗在淹水胁迫6~24 d均对叶绿素a含量的影响不显著,到处理30 d时其叶绿素a含量显著高于对照,达到1.59 mg/g,是对照的1.22倍;伪针茅叶片中叶绿素a含量的变化趋势与双穗雀稗类似,在处理30 d时,其叶片中叶绿素a含量较对照显著上升了10.13%,为2.60 mg/g,但涨幅不及双穗雀稗高。
2.2.2 叶绿素b含量的变化 从图3可见,4种植物叶片中叶绿素b的含量随着处理时间的延长
呈现不同的变化方式。在处理24 d后,耐淹性较强的双穗雀稗和伪针茅叶片中叶绿素b的含量均有显著增加,到处理30 d时分别升高到0.86 mg/g和1.29 mg/g,与对照相比分别上升了25.43%和16.58%;耐淹性较弱的假俭草和海滨雀稗叶片中叶绿素b的含量在淹水18 d后显著下降,到处理30 d时其含量分别仅有0.38 mg/g和0.65 mg/g,比对照下降了38.17%和19.80%。
2.2.3 类胡萝卜素含量的变化 淹水胁迫30 d后4种植物的类胡萝卜素含量变化同叶绿素a、叶绿素b较为一致,耐淹性较弱的假俭草和海滨雀稗,其类胡萝卜素含量分别在处理18 d和30 d后显著下降,而双穗雀稗和伪针茅耐淹性材料在處理初期变化不显著,到处理24 d和30 d时其类胡萝卜素含量均有显著提高,分别可达对照的112.00%和116.00%(图4)。
2.3 淹水胁迫对4种暖季型草坪草叶片光合作用的影响
2.3.1 净光合速率(Pn)的变化 从图5可见,耐淹性较弱的假俭草由于受到淹水胁迫的伤害,其Pn保持平稳下降的趋势,到30 d淹水结束时,其Pn下降为对照的67.50%;海滨雀稗在淹水胁迫下的Pn变化趋势与其相同,但在整个处理期间,其Pn下降的幅度小于假俭草,到30 d淹水结束时下降为对照的82.31%;耐淹性较好的双穗雀稗,在淹水处理过程中(30 d之前)的Pn与对照相比没有显著差异,到试验结束时,其Pn反而较对照显著提高,为23.58 μmol/(m2·s),是对照的124.35%。在整个淹水处理期间,淹水胁迫对伪针茅的Pn没有显著的影响。
2.3.2 气孔导度(Gs)的变化 从图6可见,与对照相比,耐淹性较强的双穗雀稗和伪针茅的Gs在淹水胁迫期间均有所下降,但下降不明显,其Gs在淹水胁迫30 d后分别为0.133 mmol/(m2·s)和0.169 mmol/(m2·s)。耐淹性较弱的海滨雀稗的Gs在淹水胁迫24 d时出现显著下降,在淹水胁迫30 d后仅为对照的74.30%。耐淹性最差的假俭草的Gs在淹水胁迫18 d时即显著下降,到淹水胁迫处理结束时,其Gs仅为对照的62.33%,是供试材料中下降幅度最大的。
2.3.3 细胞间隙CO2浓度(Ci)的变化 从图7可见,耐淹性较强的双穗雀稗和伪针茅的Ci在淹水胁迫12 d和18 d时出现了显著的升高,最高分别为对照的148.35%和134.11%,其他处理时间差异不显著。而耐淹性相对较弱的海滨雀稗的Ci呈现出显著升高再下降又显著升高的趋势,表明其随着淹水时间的延长,Ci的积累显著增加,最高达对照的157.51%。而耐淹性最差的假俭草的Ci 在淹水胁迫后呈现出先升高再降低又升高的趋势,最高达254.09 μmol/mol,为对照的177.38%。
2.3.4 蒸騰速率(Tr)的变化 从图8可见,4种植物在淹水胁迫后Tr的变化各异,其中,耐淹性差的假俭草的Tr在水淹胁迫6 d时显著增加,随着水淹时间的延长,到水淹18 d时显著下降,为对照的71.22%,且后期一直显著低于对照;而海滨雀稗在淹水后就一直低于对照材料,且在12 d和24 d时显著下降,说明淹水胁迫确实对它们的光合作用有一定的抑制作用。而耐淹性较好的双穗雀稗和伪针茅Tr虽在整个过程中呈上下波动,但与对照均无显著差异。
3 讨论
对于植物耐淹性的评价研究表明,很多植物能够忍受较长时间的淹水胁迫而不完全死亡[20, 22-23, 26-27]。本研究中参试的4种暖季型草坪草在淹水胁迫30 d后均保持60%以上的相对生物量积累,可能是因为其根离叶鞘的距离相对较近,进入叶鞘的氧气通过茎秆、根系通气组织的运输到达根部需氧区,从而使根部的缺氧症状得到缓解,保证植株的相对正常生长[28-29]。而且还发现参试的双穗雀稗和伪针茅在夏季高温环境下遭受淹水胁迫后不但没有死亡,甚至出现累积的生物量高于对照的情况,其耐淹性明显强于海滨雀稗和假俭草,可能是由于其具有发达的通气组织,从而保证淹水期间氧气通过露出水面部分器官运输到根部,确保根系的有氧呼吸,维持其正常的生长。另外,土壤中充足的水分可以迅速补充外界高温引起的强蒸腾后植株缺失的水分,保证其生长所需的水分,从而促进植株的生长[30]。本试验证实双穗雀稗的耐淹性良好,与谭淑端等[23]的研究一致。
作为植物光合作用的主要场所,叶片对外界胁迫比较敏感,利用叶片光合色素的含量和光合作用中Pn、Gs、Ci和Tr等指标来研究植物在淹水胁迫下的生长情况很有价值[31]。叶绿素作为光合色素,参与植物光合作用中光能的吸收、传递和转化,其含量的高低在一定程度上决定了植物光合作用的高低。叶片中的类胡萝卜素是光吸收的辅助色素,在吸收和传递电子过程中起关键作用,同时还可以吸收过多的光能,这种功能可以使叶绿素免遭伤害[32]。有研究证实淹水胁迫后植物叶片内叶绿素和类胡萝卜素等的含量较对照显著降低[33-34]。本试验中假俭草和海滨雀稗在淹水胁迫后,各光合色素的含量均下降,且假俭草的降幅更大,淹水胁迫对其伤害更大;双穗雀稗和伪针茅的光合色素含量在试验结束时都高于对照,说明其能够很好的适应淹水环境,在淹水胁迫下能够生长更好,这与卢雪琴等[22]对耐淹性强的百喜草(Paspalum notatum)和香根草(Vetiveria zizanioides)的研究结果一致。
植物的Pn是评价其在逆境胁迫下光合生理生态响应能力的非常关键的指标。不同植物在淹水胁迫后Pn因植物对淹水胁迫的敏感性不同而差异显著,对淹水胁迫敏感的材料在淹水几天之内就会出现叶片萎蔫、失绿,继而枯萎的受害症状[35],其叶片的Pn下降,随时间的延长下降的幅度增加,最终可达到负值[36]。本研究中所选水土保持植物在淹水胁迫后,Pn没有出现负值的情况,说明他们均有一定的耐淹性,但不同的材料间存在明显差异,如假俭草在水淹胁迫处理结束时Pn下降了近20%,而双穗雀稗和伪针茅在淹水胁迫初期Pn仅受到微小的影响,但其能够很快的适应淹水环境并逐渐恢复正常[37],可能是由于其叶片中的光合色素在淹水条件下能够保持完好,且相对于未淹水土壤,淹水土壤的太阳能辐照度和温度较高[38],随着时间的延长,其最终的Pn反而高于对照。
植物在淹水胁迫后气孔开放程度是影响植物光合强度的一种重要因素[39]。已有的研究表明,Gs与植物的耐淹性密切相关,Gs降低导致植物与外界的气体交换能力降低,并影响植物的蒸腾作用[40]。而Pn的降低直接导致植物对于CO2的利用率降低,Gs降低导致呼吸作用产生的CO2又未能及时释放到外界环境中,CO2在细胞间隙聚集,导致Ci升高[8, 14, 41],直接影响植物的生长[42]。本研究中海滨雀稗和假俭草的Gs在淹水胁迫后期均出现了显著的下降,且2种植物的Ci显著升高、Pn和Tr显著降低,可能由于Gs的降低导致植物与外界的气体交换能力减弱,从而影响了2种植物光合作用,进而导致生长受阻,海滨雀稗和假俭草对淹水胁迫的适应能力相对较弱。而双穗雀稗和伪针茅在淹水胁迫下,Gs未出现显著的下降,且Pn也未出现显著的降低,其原因可能是淹水胁迫未引起其气孔关闭,保证了2种植物气体交换的正常进行,从而维持相对稳定的Pn,提高了CO2的利用率,从而维持其Ci和Tr处于合理的范围,保证了植株的正常生长,双穗雀稗和伪针茅对淹水胁迫的适应能力较强。
4 结论
本研究结果表明,参试的4种暖季型草坪草的耐淹性均较好,在淹水胁迫后地上部分都能保持较稳定的生长,淹水处理30 d后均没有死亡也没有明显的叶片萎蔫、失绿、枯萎等症状,其中双穗雀稗和伪针茅的表现明显优于假俭草和海滨雀稗。究其原因,发现双穗雀稗和伪针茅保持光合色素含量相对稳定能力明显强于假俭草和海滨雀稗,从而维持其对光能的有效吸收和转化,同时,双穗雀稗和伪针茅维持其气孔导度相对稳定的能力也强于假俭草和海滨雀稗,保证了2种植物气体交换的正常进行,从而维持相对稳定的净光合速率,提高了CO2的利用率,保证了植株的正常生长,表现出较强的耐淹特性,是河岸带优良的绿化和固土护坡植物。
参考文献
Hirabayashi Y, Mahendran R, Koirala S, et al. Global flood risk under climate change[J]. Nature Climate Change, 2013, 3(9): 816-821.
Voesenek L A C J, Sasidharan R. Ethylene and oxygen signalling-drive plant survival during flooding[J]. Plant Biology, 2013, 15(3): 426-435.
Jackson M B, Colmer T D. Response and adaptation by plants to flooding stress[J]. Annals of Botany, 2005, 96(4): 501-505.
Striker G G, Colmer T D. Flooding tolerance of forage legumes[J]. Journal of Experimental Botany, 2017, 68(8): 1851-1872.
Colmer T D, Greenway H. Ion transport in seminal and adventitious roots of cereals during O2 deficiency[J]. Journal of Experimental Botany, 2011, 62(1): 39-57.
Armstrong W. Aeration in higher plants[M]. London: Academic Press Inc, 1980: 225-332.
Pereira T S, Lobato A K S, Alves G A R, et al. Tolerance to waterlogging in young Euterpe oleracea plants[J]. Photosynthetica, 2014, 52(2): 186-192.
Pimentel P, Almada R D, Salvatierra A, et al. Physiological and morphological responses of Prunus species with different degree of tolerance to long-term root hypoxia[J]. Scientia Horticulturae, 2014, 180: 14-23.
Zhu M, Li F H, Shi Z S. Morphological and photosynthetic response of waxy corn inbred line to waterlogging[J]. Photosynthetica, 2016, 54(4): 636-640.
張克清, 李志华, 沈益新. 不同生长期淹水对绿豆生长及生理性状的影响[J]. 江苏农业科学, 2008(1): 176-178.
李萍萍,蒋 洁. 不同程度淹水对几种景观牧草光合作用的影响[J]. 江苏农业科学,2006(4): 180-183.
Colmer T D, Pedersen O. Underwater photosynthesis and respiration in leaves of submerged wetland plants: gas films improve CO2 and O2 exchange[J]. New Phytologist,2008, 177(4): 918-926.
Pezeshki S R, Patrick W H, Delaune R D, et al. Effects of waterlogging and salinity interaction on Nyssa aquatica seedlings[J]. Forest Ecology and Management, 1989, 27(1): 41-51.
Herzog M, Striker G G, Colmer T D, et al. Mechanisms of waterlogging tolerance in wheat - a review of root and shoot physiology[J]. Plant, Cell and Environment, 2016, 39(5): 1068-1086.
Irfan M, Hayat S, Hayat Q, et al. Physiological and biochemical changes in plants under waterlogging[J]. Protoplasma, 2010, 241: 3-17.
Perez-Jimenez M, Hernandez-Munuera M, Pinero M C, et al. Are commercial sweet cherry rootstocks adapted to climate change? Short-term waterlogging and CO2 effects on sweet cherry cv. ‘Burlat[J]. Plant, Cell and Environment, 2018, 41(5): 908-918.
Zong J, Gao Y, Chen J, et al. Growth and enzymatic activity of four warm-season turfgrass species exposed to waterlogging[J]. Journal of the American Society for Horticultural Science, 2015, 140(2): 151-162.
Bush E W, McCrimmon J N, Shepard D P, et al. Carpetgrass and centipedegrass tissue iron and manganese accumulation in response to soil waterlogging[J]. Journal of Plant Nutrition, 1999, 22(3): 435-444.
韩文娇, 白林利, 李昌晓. 水淹胁迫对狗牙根光合、生长及营养元素含量的影响[J]. 草业学报, 2016, 25(5): 49-59.
刘送平, 李秋华, 支崇远, 等. 四种水库消落带植物对水淹环境的适应性研究[J]. 生态科学, 2013, 32(4): 462-468.
裴顺祥, 洪 明, 郭泉水, 等. 三峡库区消落带水淹结束后狗牙根的光合生理生态特性[J]. 生态学杂志, 2014, 33(12): 3222-3229.
卢雪琴, 夏汉平, 彭长连. 淹水对5种禾本科植物光合特性的影响[J]. 福建林学院学报, 2004, 24(4): 374-378.
谭淑端, 张守君, 张克荣, 等. 长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响[J]. 武汉植物学研究, 2009, 27(4): 391-396.
高艳芝, 宗俊勤, 孟 璠, 等. 不同暖季型草坪草种耐淹性能评价[J]. 草地学报, 2014, 22(5): 1021-1030.
刘家尧, 刘 新. 植物生理学实验教程[M]. 北京: 高等教育出版社, 2010: 11-15.
Jiang Y W, Wang K H. Growth, physiological and anatomical responses of creeping bentgrass cultivars to different depths of waterlogging[J]. Crop Science, 2006, 46(6): 2420-2426.
Wang K H, Bian S M, Jiang Y W. Anaerobic metabolism in roots of Kentucky bluegrass in response to short term waterlogging alone and in combination with high temperatures[J]. Plant and Soil, 2009, 314(1-2): 221-229.
Etherington J R. Relationship between morphological adaptation to grazing, carbon balance and waterlogging tolerance in clones of Dactylis glomerata[J]. New Phytologist, 1984, 98(4): 647-658.
Fukao T, Xu K, Ronald P C, et al. A variable cluster of ethylene response factor like genes regulates metabolic and developmental acclimation responses to submergence in rice[J]. The Plant Cell, 2006, 18(8): 2021-2034.
Striker G G, Manzur M E, Grimoldi A A. Increasing defoliation frequency constrains regrowth of Lotus tenuis under flooding. The role of crown reserves[J]. Plant and Soil, 2011, 343(1-2): 261-272.
崔兴国. 盐胁迫对车轴草叶绿素含量及光合特性的影响[J]. 黑龙江农业科学, 2011(4): 78-79, 86.
孙小玲, 许岳飞, 马鲁沂, 等. 植株叶片的光合色素构成对遮阴的响应[J]. 植物生态学报, 2010, 34(8): 989-999.
李昌晓, 钟章成, 刘 芸. 模拟三峡库区消落带土壤水分变化对落羽杉幼苗光合特性的影响[J]. 生态学报, 2005, 25(8): 1953-1959.
张玉琼, 张鹤英. 淹水逆境下玉米若干生理生化特性的变化[J]. 安徽农业大学学报, 1998, 25(4): 378-381.
尹冬梅, 陈发棣, 陈素梅. 涝渍胁迫下5种菊花近缘种属植物生理特性[J]. 生态学报, 2009, 29(4): 2143-2148.
蒋 慧, 王秋姣, 冉德龙, 等. 不同水分胁迫对金焰绣线菊光合特性的影响[J]. 江苏农业科学, 2015, 43(5): 178- 180.
陈芳清, 郭成圆, 王传华, 等. 水淹对秋华柳幼苗生理生态特征的影响[J]. 应用生态学报, 2008, 19(6): 1229-1233.
Mollard F P O, Striker G G, Ploschuk E L, et al. Subtle topographical differences along a floodplain promote different plant strategies among Paspalum dilatatum subspecies and populations[J]. Austral Ecology, 2010, 35(2): 189-196.
Ogle K, Reynolds J F. Desert dogma revisited: coupling of stomatal conductance and photosynthesis in the desert shrub, Larrea tridentata[J]. Plant, Cell and Environment, 2002, 25(7): 909-921.
Verma K K, Singh M, Gupta R K, et al. Photosynthetic gas exchange, chlorophyll fluorescence, antioxidant enzymes, and growth responses of Jatropha curcas during soil flooding[J]. Turkish Journal of Botany, 2014, 38(1): 130-140.
Zhao H F, Zhao Y, Zhang C, et al. Growth, leaf gas exchange, and chlorophyll fluorescence responses of two cultivars of Salix integra Thunb. to waterlogging stress[J]. Journal of Agricultural Science and Technology, 2014, 16(1): 137-149.
Wang C Y, Li C X, Wei H, et al. Effects of long-term periodic submergence on photosynthesis and growth of Taxodium distichum and Taxodium ascendens saplings in the hydro-fluctuation zone of the three gorges reservoir of China[J]. PLoS One, 2016, 11(9): e0162867.
責任编辑:沈德发
