正己烷亚急性吸入染毒致大鼠肝肾毒性的机制
2021-02-22邱正义陈辉婷潘艺梅洪啟铸罗凌凤汪靖李昱辰
邱正义,陈辉婷,潘艺梅,洪啟铸,罗凌凤,汪靖,李昱辰
福建医科大学公共卫生学院 a.预防医学系 b.实验中心,福建 福州 350004
正己烷(n-hexane)是一种通过原油裂解而产生的有机溶剂,主要用于制造黏合鞋革、箱包的黏胶,也常应用于电子信息产业生产中的清洗作业。随着我国工业的发展,越来越多的工人与正己烷发生职业接触[1-2],且正己烷职业中毒人群中女性比例明显高于男性[3]。在职业暴露条件下,正己烷经呼吸道吸入体内,经过肝脏等代谢,最终主要由肾脏排出体外。目前正己烷神经损伤及机制方面报道较多[4-5],但肝肾毒性损伤及机制报道较少。肝脏是大多数毒物作用的靶器官,参与机体内毒物转化的过程[6]。正己烷主要在肝脏内代谢,主要代谢产物为2,5-己二酮、2-己醇和2-己酮等[2],这一活化代谢过程主要由肝脏内的P450酶系完成。细胞色素P450家族1亚家族A成员2(cytochrome P450 family 1 subfamily A polypeptide 2,CYP1A2)是肝脏中重要的CYP450氧化酶之一,含量约为肝总CYP450氧化酶的13%[7]。环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP-homologous protein,CHOP)在正常生理状态下基本检测不到,但在内质网应激(endoplasmic reticulum stress,ERS)状态下其表达显著升高,是ERS的标志之一[8]。本研究通过建立正己烷吸入染毒模型,观察肝脏和肾脏组织结构和功能的改变,研究肝脏代谢酶CYP1A2基因和肾脏组织CHOP基因的表达,初步探讨正己烷是否干扰肝脏组织代谢功能,是否会诱发肾脏组织ERS反应,为进一步研究正己烷的肝肾毒性及其机制提供新思路。
1 对象与方法
1.1 试剂及器材
1.1.1 主要试剂 正己烷(上海国药集团,中国),PBS(北京中衫金桥共公司,中国),DEPC(Invitrogen公司,美国),TRIZOL REAGENT(Invitrogen公司,美国),PrimeScriptTMRT Reagent和SYBR@ Premix Ex TaqTM试剂盒[宝生物工程(大连)有限公司,中国]。丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)、血尿素氮(blood urea nitrogen,BUN)和血肌酐(serum creatinine,SCr)等检测试剂盒均购自中国南京建成生物工程研究所。
1.1.2 主要器材 SP5型激光共聚焦显微镜(Leica公司,德国),CH8606电子分析天平(Mettler Instrumente AG公司,瑞士),Z323K台式离心机(Hermle公司,德国),生物组织包埋机(浙江省金华市科迪仪器有限公司,中国),石蜡切片机(Leica公司,德国),电热恒温水浴锅(哈尔滨市东联电子技术开发有限公司,中国),UV755B型紫外分光光度仪(海精密仪器科学有限公司,美国),-80℃超低温冰箱(SANYO公司,日本),7500型实时荧光定量PCR仪(ABI公司,美国),CK40-F200 BH-2型倒置显微镜(Olympus公司,日本),RCO3000TVBA CO2培养箱(REVCO公司,美国),96孔培养板(Costar公司,中国),MK3型酶标仪(Thermo公司,美国),L-RDJ/1000静式染毒柜(广州市九方电子设备有限公司,中国)。
1.2 方法
1.2.1 动物培养及染毒 清洁级雌性Sprague-Dawley大鼠40只,体重(160±10)g,由福建医科大学实验动物中心提供,生产许可证编号:SYXK(闽)2017-0003。饲养条件 :温度(21±2)℃,相对湿度(68±10)%,自由进食饮水。适应性喂养1周后,随机分成4组,设1个对照组和3个染毒组,根据课题组前期研究[9]的实验结果,对照组吸入正常空气,染毒组分别给予4 212、12 637、37 910 mg·m-3正己烷,在染毒柜中静式吸入染毒,每天染毒4 h,连续28 d。动物实验符合《福建医科大学实验动物伦理委员会章程》(2013)。
1.2.2 观察指标
1.2.2.1 脏器系数 正己烷染毒大鼠28 d后称重,眼眶后静脉采血后处死,剥离肝脏,剔除周边的结缔组织,用滤纸吸干后电子天平称重,记录肝脏湿重(g),计算肝脏脏器系数(%)。取出双侧肾脏称重,计算肾脏脏器系数(%)。
1.2.2.2 病理学观察 取各组大鼠肝脏组织和一侧肾组织,采用4%中性甲醛溶液固定,梯度乙醇(体积分数70%、80%、90%、95%、100%)脱水,二甲苯透明,制作组织石蜡标本。连续切片,63℃烤片,脱蜡、水化,苏木精染色15 min,盐酸乙醇溶液分化5 s,氨水溶液返蓝1 min,伊红染色5 min,脱水、透明、封片,显微镜下观察并拍照。
1.2.2.3 测定血清ALT和AST活力、BUN和SCr含量大鼠血液于4℃静置2 h后,转速2 000 r·min-1,离心20 min(离心半径6 cm),再用200 μL移液枪移取上清液1.5 mL至Eppendorf管,置于-20℃冰箱保存。根据ELISA试剂盒说明书,分别检测各组血清中ALT、AST活力及BUN、SCr含量。
1.2.2.4 实时荧光定量PCR法检测CYP1A2、CHOPmRNA的表达情况 每组取其中6只大鼠肝脏的相同小叶部位,切取30 mg大鼠肝脏组织加入1 mL TRIZOL裂解液研磨,移入1.5 mL无核糖核酸酶的 Eppendorf管中,颠倒混匀,室温静止5 min;同样每组取其中6只老鼠相同侧肾脏,切取50 mg肾皮质区组织放入研磨器中,步骤同肝脏组织。按照TRIZOL试剂说明书操作提取总RNA。
依照PrimeScriptTMRT试剂盒说明书操作合成cDNA。按照SYBR@ Premix Ex TaqTM试剂盒说明书操作,于7500型实时荧光定量PCR仪上进行扩增反应。应用β-actin作为内参,校正各样本的mRNA相对表达量,不同剂量组设置3个复孔。扩增条件:第一步95℃预变性30 s;第二步PCR反应,95℃ 5 s,60℃ 34 s,共40个循环。扩增反应结束后,绘制溶解曲线进行扩增产物的特异性分析。反应条件:95℃ 15 s,60℃1 min,95 ℃ 15 s。实 验 重 复3次。β-actin、CYP1A2、CHOP基因引物序列由生工生物工程(上海)股份有限公司设计合成,引物序列见表1。
采用2-ΔΔCt法计算mRNA相对表达水平。
1.3 统计学分析
采用SPSS 21.0统计软件进行数据分析。资料经正态性检验后符合正态分布,因此数据以均数±标准差来表示。采用单因素方差分析比较多组间差异,若方差齐性则采用Dunnett-t法将各染毒剂量组与对照组进行比较,若方差不齐则采用 Dunnet’s T3进行两两比较。检验水准α=0.05。

表1 实时荧光定量PCR引物序列Table 1 Real-time PCR primer sequences
2 结果
2.1 大鼠体重及肝肾脏器系数
各剂量组大鼠体重呈下降趋势(趋势性检验P<0.05),其中37 910 mg·m-3正己烷组与对照组相比差异具有统计学意义(P< 0.05),各染毒剂量组的肝脏系数及肾脏系数与对照组比较,差异无统计学意义(P>0.05),见表2。
表2 正己烷亚急性吸入染毒后大鼠体重及肝肾脏器系数(±s,n=10)Table 2 Body weight and liver/kidney organ coefficient of rats following subacute n-hexane inhalation exposure (±s, n=10)
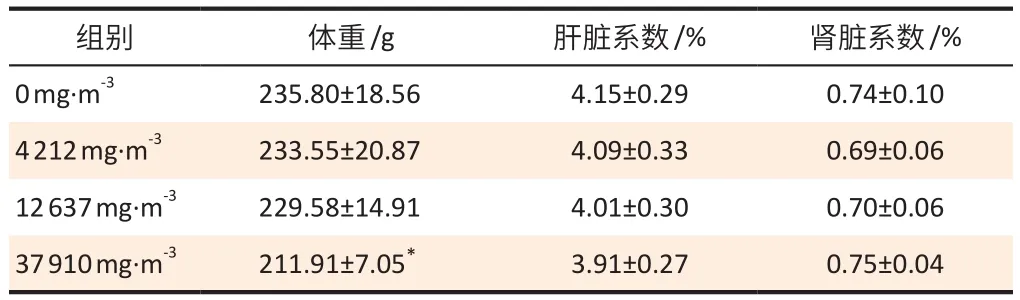
表2 正己烷亚急性吸入染毒后大鼠体重及肝肾脏器系数(±s,n=10)Table 2 Body weight and liver/kidney organ coefficient of rats following subacute n-hexane inhalation exposure (±s, n=10)
[注]* :与对照(0 mg·m-3)组相比,P < 0.05。
组别 体重/g 肝脏系数/% 肾脏系数/%0 mg·m-3 235.80±18.56 4.15±0.29 0.74±0.10 4 212 mg·m-3 233.55±20.87 4.09±0.33 0.69±0.06 12 637 mg·m-3 229.58±14.91 4.01±0.30 0.70±0.06 37 910 mg·m-3 211.91±7.05* 3.91±0.27 0.75±0.04
2.2 大鼠肝肾组织病理学观察结果
如图1所示,在光学显微镜下,对照组肝组织的肝小叶呈正常多面棱柱状,分界清楚,肝细胞形态正常一致,肝索以中央静脉为中心呈放射状排列;4 212 mg·m-3正己烷组的肝细胞体积增大、肝细胞分界模糊,随着染毒剂量的上升,肝小叶分界不清,肝索排列紊乱,窦间隙变窄,肝组织出现明显充血水肿。
如图2所示,对照组大鼠肾组织切片中肾小管结构清晰,染色均匀,排列整齐;4 212、12 637 mg·m-3正己烷组大鼠肾组织切片中肾小管轻微扩张;37 910 mg·m-3正己烷组大鼠肾组织切片中可见部分肾小管上皮细胞水肿,伴有少量肾间质充血。
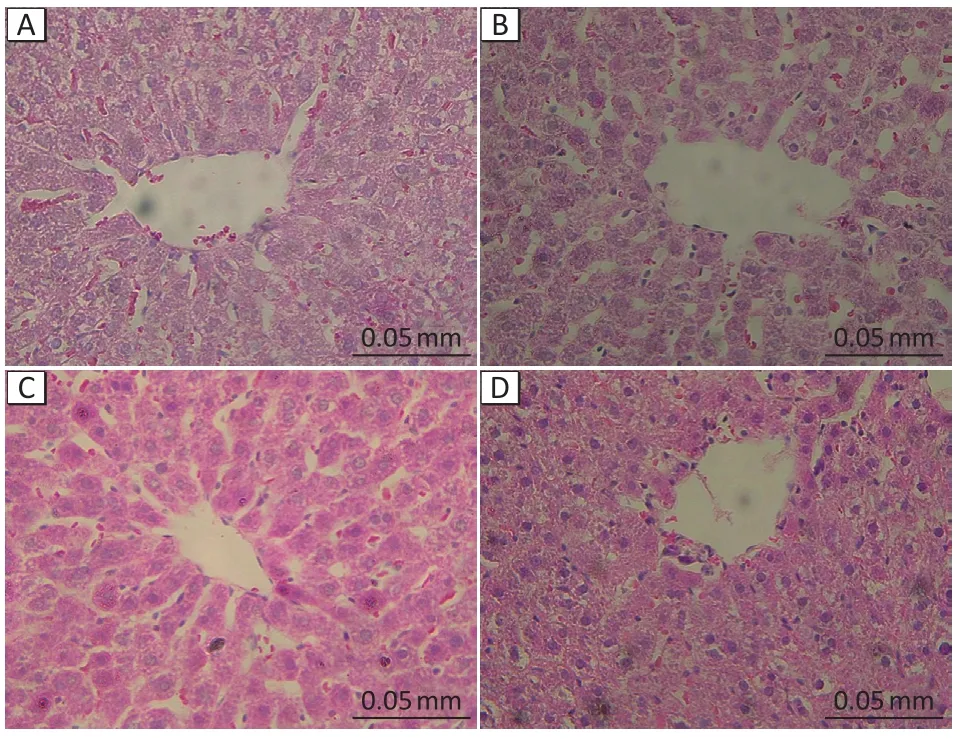
图1 正己烷亚急性染毒后大鼠肝脏病理学改变(HE染色)Figure 1 Pathological changes in rat liver after subacute exposure to n-hexane (HE staining)
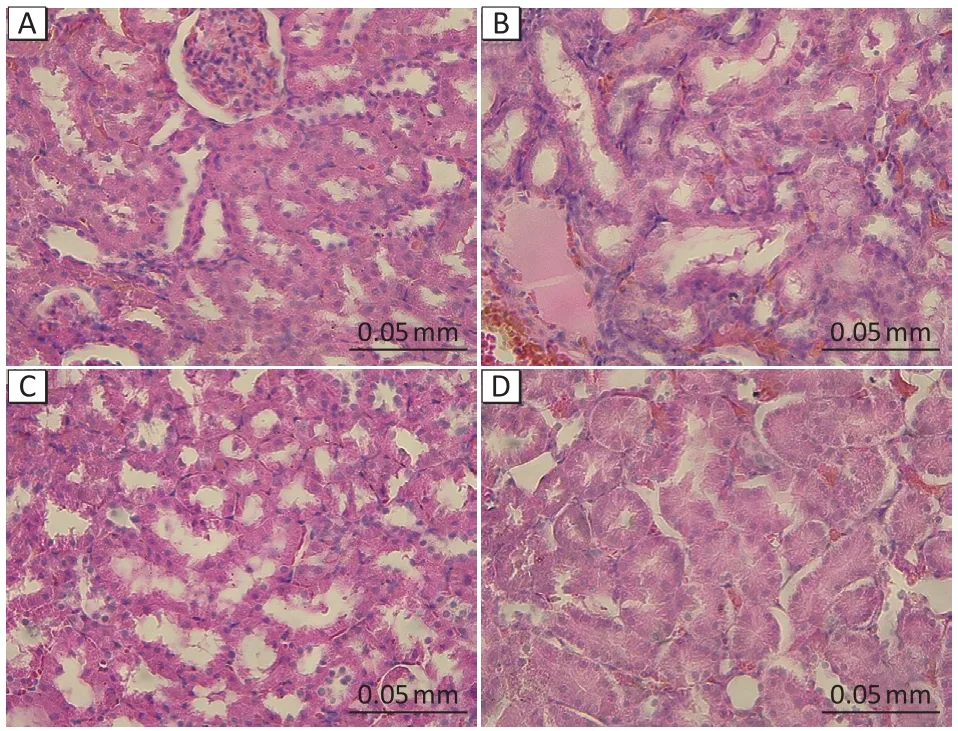
图2 正己烷亚急性染毒后大鼠肾脏病理学改变(HE染色)Figure 2 Pathological changes in rat kidney after subacute exposure to n-hexane (HE staining)
2.3 大鼠血清中ALT和AST活力、BUN和SCr含量的变化
各染毒组血清ALT活力与对照组比较,差异无统计学意义(P> 0.05);37 910 mg·m-3正己烷组血清AST活力高于对照组(P< 0.05);各染毒组血清BUN和SCr含量与对照组比较,差异均无统计学意义(P> 0.05)。见表3。
2.4 大鼠肝脏CYP1A2 mRNA、肾脏CHOP mRNA的表达水平
正己烷各染毒组CYP1A2mRNA相对表达量均低于对照组,差异均有统计学意义(P< 0.05)。与对照组比较,各染毒组CHOPmRNA的相对表达量均上调,且差异均有统计学意义(P< 0.05),见表4。
表3 大鼠正己烷亚急性吸入染毒后血清中ALT和AST活力、BUN和SCr含量的变化(±s,n=10)Table 3 Changes in serum ALT, AST, BUN, and SCr of rats exposed to subacute inhalation of n-hexane (±s, n=10)

表3 大鼠正己烷亚急性吸入染毒后血清中ALT和AST活力、BUN和SCr含量的变化(±s,n=10)Table 3 Changes in serum ALT, AST, BUN, and SCr of rats exposed to subacute inhalation of n-hexane (±s, n=10)
[注]* :与对照(0 mg·m-3)组相比,P < 0.05。
组别 ALT活力/(U·L-1)AST活力/(U·L-1)BUN浓度/(mmol·L-1)SCr浓度/(μmol·L-1)0 mg·m-3 39.44±13.09 72.88±11.59 5.98±0.42 56.38±25.26 4 212 mg·m-3 42.83±13.45 79.52±11.49 6.32±0.48 56.68±4.96 12 637 mg·m-3 45.82±10.81 83.14±9.05 6.73±1.27 58.92±7.19 37 910 mg·m-3 49.42±9.82 93.63±6.84* 6.95±1.32 61.13±9.61
表4 大鼠正己烷亚急性吸入染毒肝脏CYP1A2和肾脏CHOP mRNA表达水平(±s,n=3)Table 4 Expression levels of CYP1A2 mRNA in liver and CHOP mRNA in kidney of rats exposed to subacute inhalation of n-hexane (±s, n=3)

表4 大鼠正己烷亚急性吸入染毒肝脏CYP1A2和肾脏CHOP mRNA表达水平(±s,n=3)Table 4 Expression levels of CYP1A2 mRNA in liver and CHOP mRNA in kidney of rats exposed to subacute inhalation of n-hexane (±s, n=3)
[注]* :与对照(0 mg·m-3)组相比,P < 0.05。
组别 CYP1A2 CHOP 0 mg·m-3 1.00±0.06 1.00±0.04 4 212 mg·m-3 0.01±0.00* 2.22±0.19*12 637 mg·m-3 0.08±0.07* 2.05±0.02*37 910 mg·m-3 0.14±0.09* 2.95±0.28*
3 讨论
本研究通过模拟正己烷职业暴露途径,建立静式吸入染毒模型,探究正己烷亚急性染毒对雌性大鼠肝肾的损伤。本实验各剂量组大鼠体重呈下降趋势,未观察到脏器系数的改变。但对大鼠肝脏和肾脏组织病理学观察发现,正己烷染毒后可致肝小叶分界不清,肝索排列紊乱,窦间隙变窄,肝组织出现明显充血水肿,肾脏病理切片出现了肾小管轻微扩张和上皮细胞水肿。
正己烷主要在肝脏内代谢,主要代谢产物为2,5-己二酮、2-己醇和2-己酮等[2]。血清ALT、AST是评价肝功能损伤程度的关键指标[10],检测肾功能受损时比较敏感的是BUN和SCr这两项指标[11]。本研究结果显示,与对照组比较,37 910 mg·m-3剂量组AST水平差异有统计学意义(P< 0.05)。各染毒组染毒后大鼠血清中SCr及BUN含量与对照组相比差异均无统计学意义(P> 0.05)。本研究表明,正己烷亚急性暴露可引起大鼠肝功能产生病理损害,而肾功能指标未出现具有统计学意义上的改变,该结果提示,同等条件下可能肝脏对正己烷毒作用的敏感性要高于肾脏。
正己烷职业中毒人群中,女性的比例明显高于男性,以育龄女性为主[12]。国内外研究表明,正己烷染毒可影响内源性性激素雌二醇(estradiol,E2)合成,干扰体内性激素平衡[13]。肝脏也是E2等性激素代谢的主要器官,羟基化是E2代谢的主要方式[14],CYP1A2在此过程中起重要作用。本研究结果显示,与对照组比较,各染毒组大鼠的肝脏CYP1A2mRNA相对表达量减少(P< 0.05)。结果提示,正己烷可抑制肝脏内代谢酶CYP1A2基因的表达,从而影响E2等甾体激素在肝脏内的代谢。
研究表明,不同的肾损伤模型均会触发内质网应激反应,并介导肾脏疾病的发生[15]。CHOP是ERS诱导产生的凋亡信号分子,是ERS细胞凋亡反应的直接结果[16]。Jung等[17]的研究发现,CHOP蛋白在正常细胞中通常很少表达,只有在发生凋亡的细胞中CHOP才被大量转录并翻译。在本次实验中正己烷染毒组与对照组比较,CHOPmRNA表达均上调(P< 0.05)。结果提示,本实验条件下,肾功能虽未出现明显损伤,但肾组织可能触发了ERS反应,但其在此时所起的作用需进一步深入研究。
综上,在本实验条件下,正己烷亚急性暴露可引起雌性大鼠肝脏损害,并可抑制肝脏甾体激素代谢酶CYP1A2mRNA的表达。肾功能未出现显著改变,但肾脏组织ERS相关的CHOPmRNA出现明显上调,表明在此条件下亚急性正己烷染毒可能会触发大鼠肾组织ERS反应,但其确切的作用和机制尚需进一步研究。
