鼠痘病毒FQ-PCR 检测方法的建立及初步应用
2021-02-22王莎莎付瑞王吉岳秉飞
王莎莎付 瑞王 吉岳秉飞
(中国食品药品检定研究院,北京 102629)
鼠痘病毒(ectromelia virus,ECTV)是一类有囊膜,基因组为180 ~200 kb 大小的线性双股DNA 病毒,是动物病毒中体积大、结构最复杂的DNA 病毒,病毒粒子呈卵圆形或砖形,大小为230 nm×170 nm,在分类上属于痘病毒科,脊索动物痘病毒亚科,正痘病毒属。 ECTV 的自然宿主为小鼠,1930 年首次在英国的实验小鼠种群中分离,随后在墨西哥、日本、美国、中国均有发现[1]。 ECTV 多呈爆发性流行,致死率较高,常造成全群淘汰,危害极大。 不同宿主的易感性不同,临床上急性感染小鼠以四肢、尾和头部肿胀、溃烂、坏死甚至脚趾脱落为特征,故又称脱脚病,而隐性带毒鼠通常没有明显症状,为实验小鼠种群的重大安全隐患。 实验室常用酶联免疫吸附试验检测ECTV 抗体进行日常监测,而隐性带毒鼠的血清抗体水平较低,血清学检测方法有可能造成假阴性[2],且感染动物的病毒抗体的产生存在空窗期,因此,对实验小鼠的ECTV 核酸筛查在感染初期非常重要。 本研究建立了ECTV 特异灵敏的TaqMan 探针法实时荧光定量PCR(fluorescence quantitative PCR,FQ-PCR)检测方法,能够实现快速批量检测,且首次在黄鼠组织中检测到ECTV 核酸,提示在使用实验用动物时还需重视ECTV 的感染情况。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
22 只6 周龄雄性(18~22 g)清洁级小鼠来自中国食品药品检定研究院动物生产供应室[SCXK(京)2017-0005],[SYXK(京)2017-0013],63 只14~34 月龄屏障环境饲养裸鼹鼠,重22g ~42g, 其中雌性31 只,雄性32 只,由海军军医大学提供[SCXK(沪)2017-0002]。 动物饲养于屏障设施[SYXK(沪)2017-0004]。 由中国食品药品检定研究院审批通过(中检动(福)第2019(A)001 号),所有动物均按3R 原则给予人道的关怀。
1.1.2 实验样品与毒种
鼠痘病毒(ectromelia virus,ECTV)、牛痘病毒(vaccinia virus, VACV )、 鼠 腺 病 毒 ( murine adenovirus, MAdV)、 小 鼠 多 瘤 病 毒( murine polyomavirus ,Poly)、小鼠微小病毒(minute virus of mice,MVM)为本室保存;63 份裸鼹鼠脾组织样本(编号为NP1~NP63 号)来自中国人民解放军第二军医大学;22 只清洁级小鼠脾组织(编号为MS1 ~MS22)和4 只黄鼠的20 份组织样本为本实验室送检样品,来自于国内4 个实验动物使用单位,其中黄鼠的组织包括肝组织(编号为SQLi1 ~SQLi4)、脾组织(编号为SQS1 ~SQS4)、肾组织(编号为SQK1 ~SQK4)、肺组织(编号为SQLu1 ~SQLu4)、淋巴组织(编号为SQLy1~SQLy4)。
1.2 主要试剂与仪器
DNA 快速提取试剂盒品牌为QIAGEN;普通PCR 系列试剂及标准阳性质粒均购自宝生物工程(大连)有限公司;TaqMan Gene Expression Master Mix 品牌为ABI。 PCR 仪和核酸琼脂糖凝胶电泳仪品牌为为美国Bio-RAD;凝胶成像分析仪品牌为为美国Kodak;荧光定量PCR 仪7500fast Real-Time PCR System 品牌为美国ABI。
1.3 实验方法
1.3.1 引物设计
比对NCBI 上现有的ECTV 基因序列,选择同源性最高的crmD基因(NCBI ID:KJ563295)保守区域,设计FQ-PCR 的引物探针,序列如表1 示。
1.3.2 质粒标准品的制备
合成ECTV 基因crmD序列包含引物探针的部分,转入pMD19-T 质粒中,作为ECTV FQ-PCR 的标准质粒pMD19-ECTV,浓度为1.0×109copies/μL。
1.3.3 病毒DNA 的获取
对正常BHK21 细胞、BHK21 细胞培养的ECTV毒株和VACV、MAdV、Poly、MVM 病毒培养液,以及63 份裸鼹鼠脾组织样本和22 份小鼠脾组织样本、4只黄鼠的肝、脾、肾、肺、淋巴结等20 份组织样本按照DNA 快速提取试剂盒操作方法进行DNA 提取。提取的DNA 冻存于-30℃备用。
1.3.4 ECTV FQ-PCR 扩增体系及标准曲线的建立
经条件优化, FQ-PCR 的最佳反应体系为引物探针混合物(10 μmol/L)1 μL,模板1 μL,加入TaqMan Gene Expression Master Mix 以及无RNase 水使总反应体积达到20 μL。 使用荧光定量PCR 仪7500fast Real-time PCR System 设定程序50℃预热2 min;95℃预变性10 min;扩增循环为95℃ 15 s,60℃1 min,共40 个循环,在每个循环的延伸结束时进行荧光信号检测。
将pMD19-ECTV 作为标准品,进行10 倍系列稀释为1.0×109~1.0×100copies/μL,作为模板进行实时荧光定量PCR 反应,选取线性较好6 个稀释度建立标准曲线。
1.3.5 ECTV FQ-PCR 检测方法的特异性、灵敏性、准确性和稳定性检测

表1 用于扩增crmD 基因的引物与TaqMan 探针序列Table 1 Pimers and TaqMan probes sequences for the crmD gene amplification
使用建立的FQ-PCR 方法检测ECTV、VACV、MAdV、Poly、MVM 病毒核酸,并设立BHK21 细胞核酸和无RNase 水作为阴性对照(N/C)检测ECTV FQ-PCR 方法的特异性。 检测1.0×109~1.0×100copies/μL 的标准质粒,每个稀释度做三个平行,检测方法的灵敏性。 使用建立的FQ-PCR 方法对3 份阳性样品进行多次重复实验,评价方法的准确性和稳定性。
1.3.6 ECTV FQ-PCR 在不同样品中的应用
使用建立的ECTV FQ-PCR 方法对1.3.3 中获取的不同的样本DNA 进行ECTV 筛查,并对阳性样本使用普通PCR 引物crmD1 ∶5'-CTGCGAATTT GAAGGATC-3 '; crmD2: 5 '-CGTCGTGGGTGTTAG TTG -3'进行扩增[3],扩增产物测序鉴定。
2 结果
2.1 ECTV FQ-PCR 扩增体系及标准曲线的建立
选取标准质粒pMD19-ECTV 稀释度为1.0×108~1.0×103copies/μL 的检测结果制定标准曲线,标准曲线如图1 所示,其相关系数Slope 为-3.487、相关系数R2值为0.998,扩增效率Eff%为93.544%(90%~110%之间)。
2.2 ECTV FQ-PCR 特异性检测
如图2 所示, 建立的ECTV FQ-PCR 检测VACV、MAdV、Poly、MVM 病毒核酸以及BHK21 细胞核酸和无RNase 水均无明显扩增曲线,而对ECTV 病毒DNA 有S 型扩增曲线,CT 值为12.29,说明建立的方法有很好的特异性。
2.3 ECTV FQ-PCR 灵敏性检测
对1.0×109~1.0×100copies/μL 稀释度的标准质粒pMD19-ECTV 进行检测,每个稀释度三个平行,所能检测的最小浓度梯度的循环阈值(CT)≤35,拷贝数(Copies)≥10 时FQ-PCR 结果可信,结果如图3,显示标准质粒浓度为10 copies/μL 时CT 值为33.09,三个平行实验均有扩增曲线,测得拷贝数为30.90 copies,在可信范围之内,而浓度为1 copies/μL 时CT 值为36.01,测得的拷贝数为4.5 copies,但在三个平行实验中,仅有一个实验有数据,说明已超出检测限。 因此确定该方法的灵敏度为10 copies。
2.4 ECTV FQ-PCR 准确性和稳定性检测
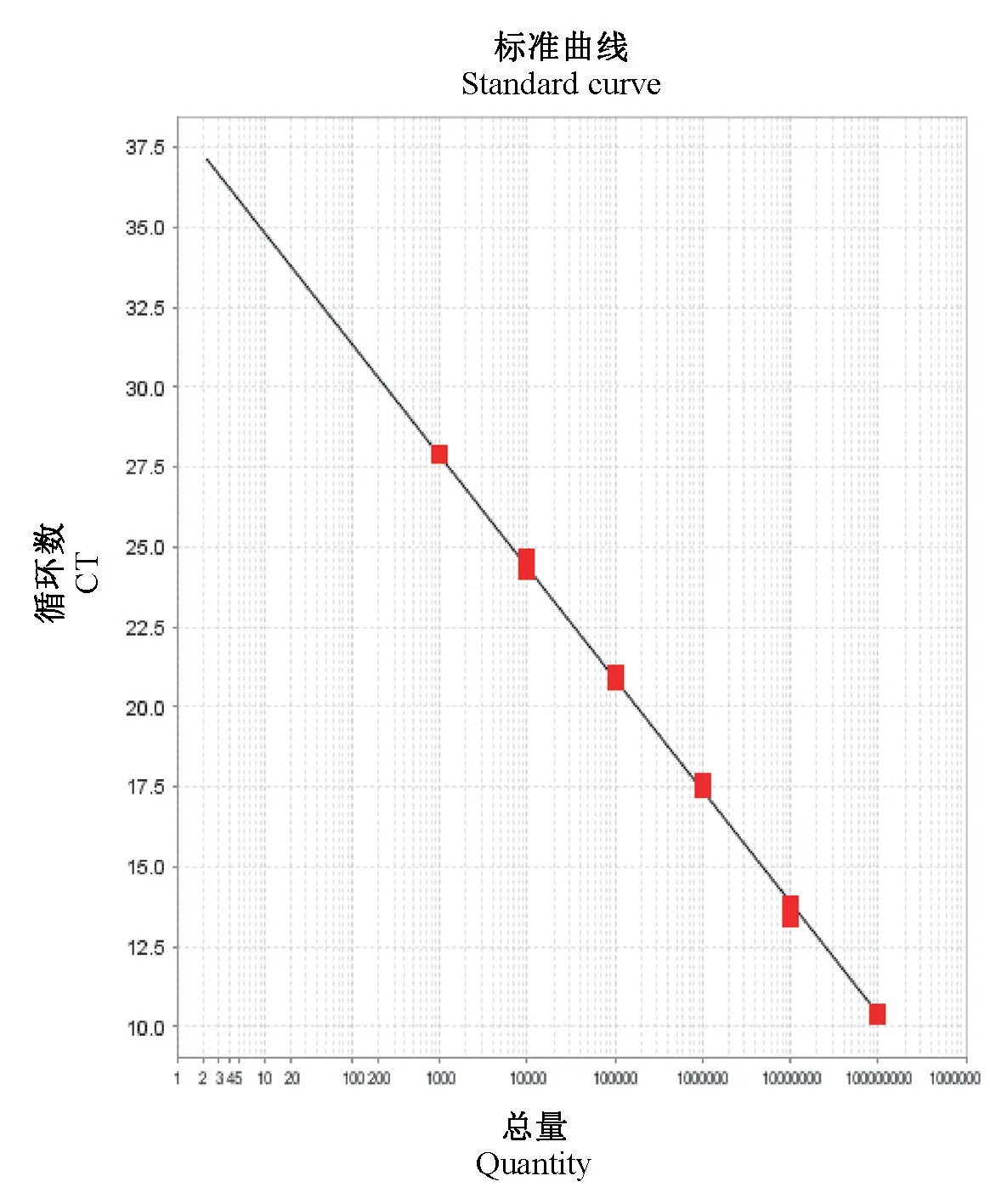
图1 ECTV FQ-PCR 标准曲线Note.Target, Target 1 Slope, -3.487.Y-lnter,38.291.R2,0.998.Eff%,93.544%.Figure 1 ECTV FQ-PCR standard curve
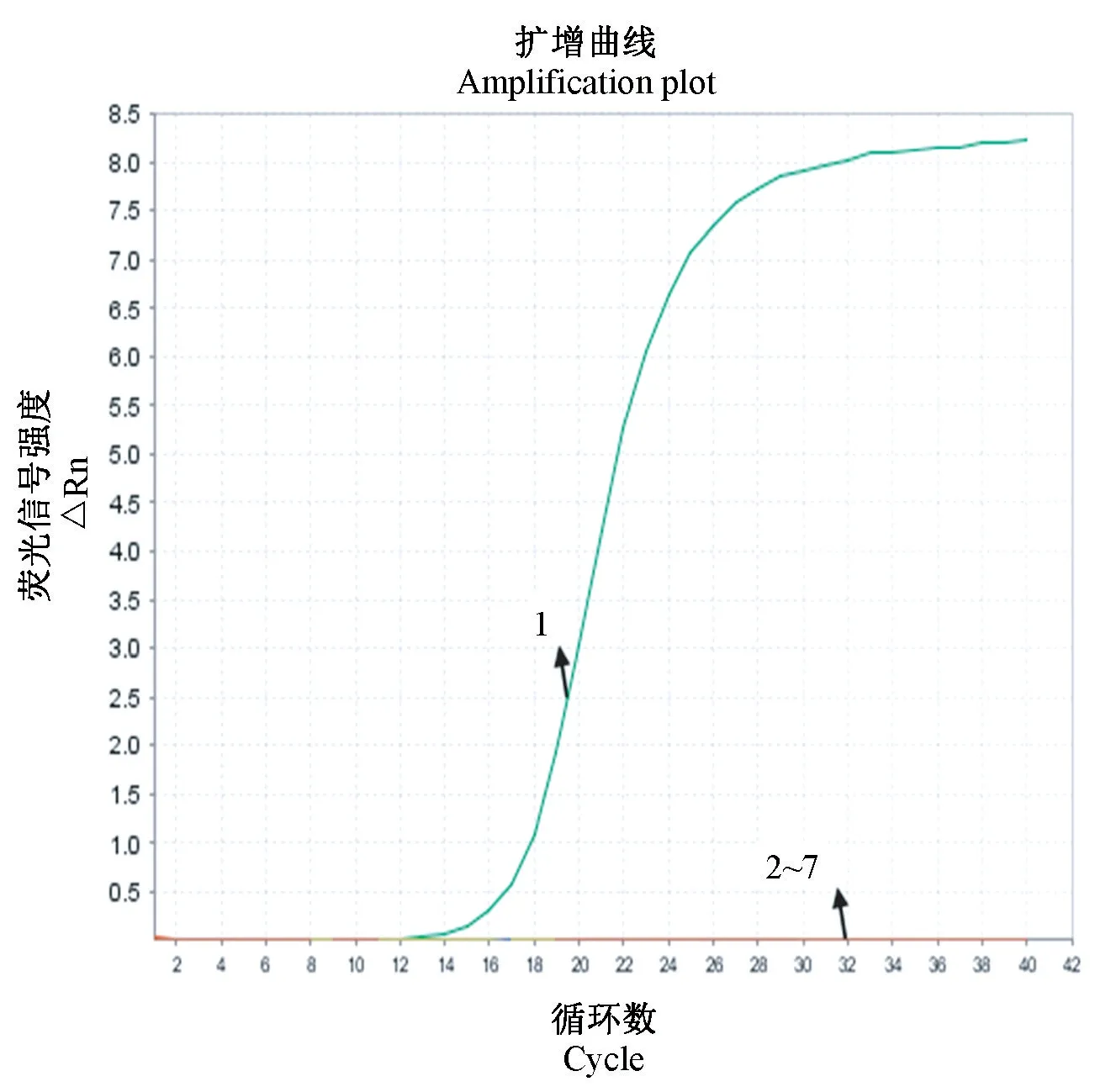
图2 ECTV FQ-PCR 特异性检测结果Note.1, ECTV.2-7, VACV/MAdV/Poly/MVM/BHK21 cell/RNase free water.Figure 2 ECTV FQ-PCR specificity test
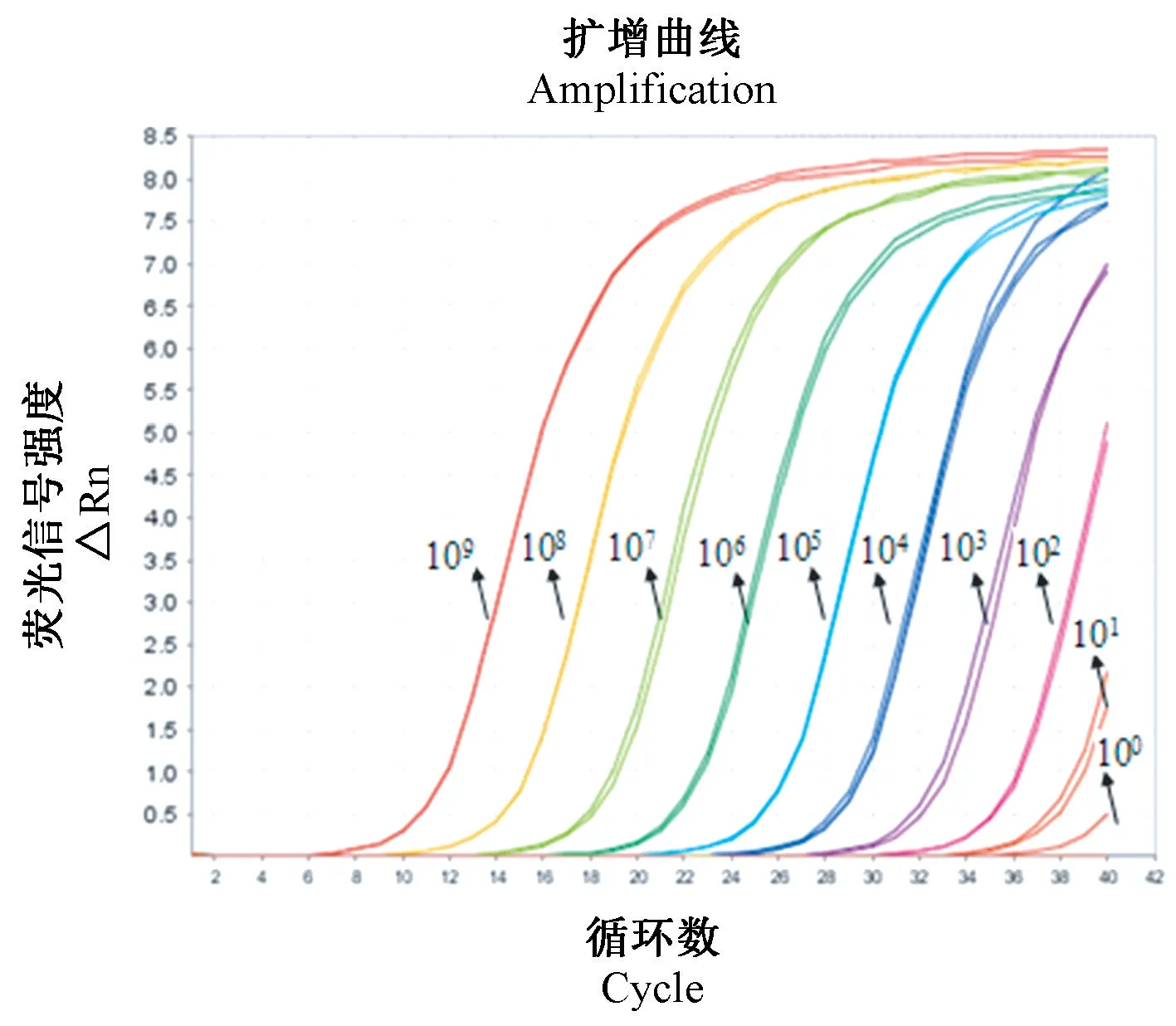
图3 ECTV FQ-PCR 灵敏度检测扩增曲线Figure 3 ECTV FQ-PCR sensitivity test amplification curves
使用 浓 度 分 别 为1 × 106copies/μL、1 × 105copies/μL、1×104copies/μL 的标准品进行荧光定量PCR 检测,且进行三个平行实验,最终实测值的均值分别为1.2×106copies/μL、1.078×105copies/μL、1.33×104copies/μL,计算CTSD 值及CV 值如表2。3 个浓度梯度3 次重复实验Ct 值的变异系数(CV)均小于5%,表明方法重复性、稳定性良好。
2.5 ECTV FQ-PCR 在鼠组织样品中的应用
对收集到的动物组织样本进行ECTV 筛查,结果如表3、图4 所示,显示在黄鼠的肝、脾、肾、肺、淋巴组织中均检测到ECTV 阳性,阳性样品中ECTV的核酸拷贝量均较低,其中浓度最高的是黄鼠淋巴组织SQLy1,达106.967 copies/μL,且淋巴组织的检测结果均为阳性。 对阳性样本进行PCR 后测序,显示其与ECTV 核酸的同源性为99%,进一步验证了检测的黄鼠感染了ECTV。 而在实验室裸鼹鼠组织和小鼠组织ECTV 筛查结果显示均为阴性。
3 讨论
鼠痘病毒作为我国现行国标《实验动物微生物等级及检测》(GB14922.2-2011)中规定的清洁级及以上级别小鼠的必检项目[4],我国实验室已经建立了较为严格的饲养管理及卫生防疫制度,对国内实验室中的鼠痘病毒的流行情况进行了很好的控制。 现行国家标准中实验动物鼠痘病毒的检测方法为血清学方法,包括酶联免疫吸附实验、免疫酶试验、免疫荧光试验、免疫酶组织化学法,通常情况下,实验室的标准检测方法为酶联免疫吸附试验。据不完全统计,我国1983 年至2011 年间的7 篇关于ECTV 的报道,仅有两篇报道检出ECTV 阳性,且阳性率很低[5]。 近些年已经很少有关于ECTV 阳性的报道,本实验室2017 至2019 年间使用酶联免疫吸附试验方法检测小鼠血清中的ECTV 抗体,未检出阳性,本实验使用的小鼠、裸鼹鼠、黄鼠分别使用小鼠、裸鼹鼠、大鼠的鼠痘病毒酶联免疫吸附试验方法检测为鼠痘抗体阴性。 由于分子学方法直接检测抗原,且弥补了血清学检测方法在感染空窗期检测造成的假阴性,具有很好的应用前景。
为了全面的评价ECTV 对实验室小鼠的感染威胁,本研究拟建立ECTV FQ-PCR 对裸鼹鼠、黄鼠、小鼠组织进行筛查。 选取了位于ECTV 核酸两端的重复序列中的CrmD基因的保守区域设计引物探针,建立的ECTV Q-PCR 能够灵敏特异的检测ECTV 核酸,标准曲线的相关系数Slope 为-3.487、相关 系数 R2值 为 0.998, 扩 增 效 率 Eff% 为93.544%,最低能检测到浓度为10copies 的样品。
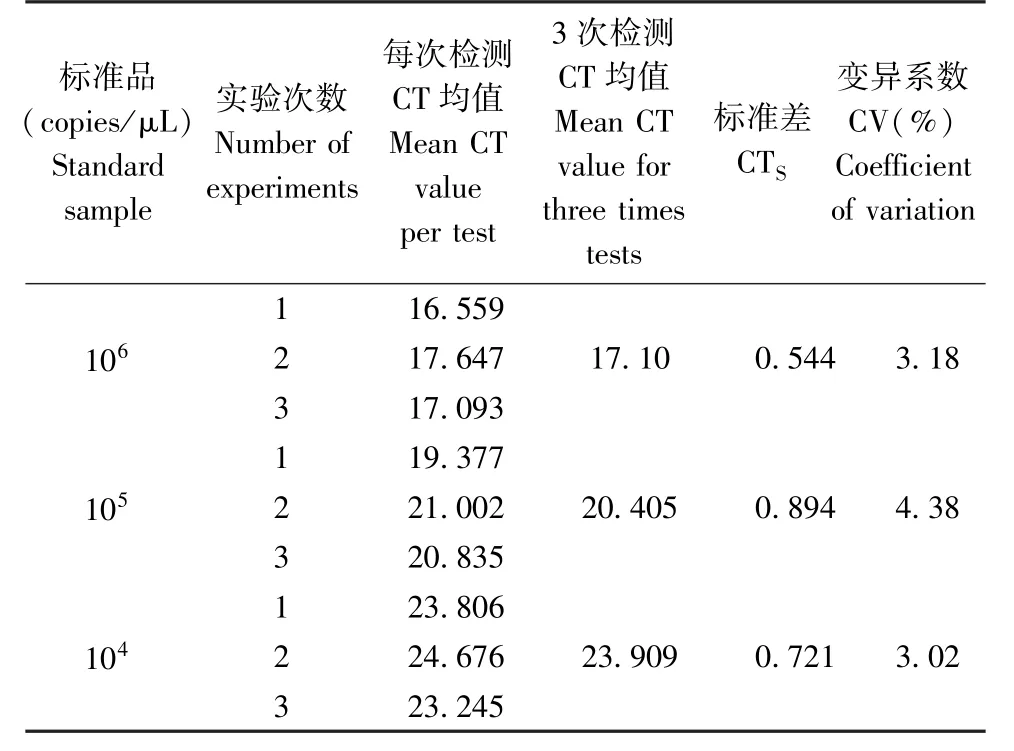
表2 荧光定量PCR 检测方法的重复性和稳定性实验结果Table 2 Repeatability and stability testing results of Q-PCR
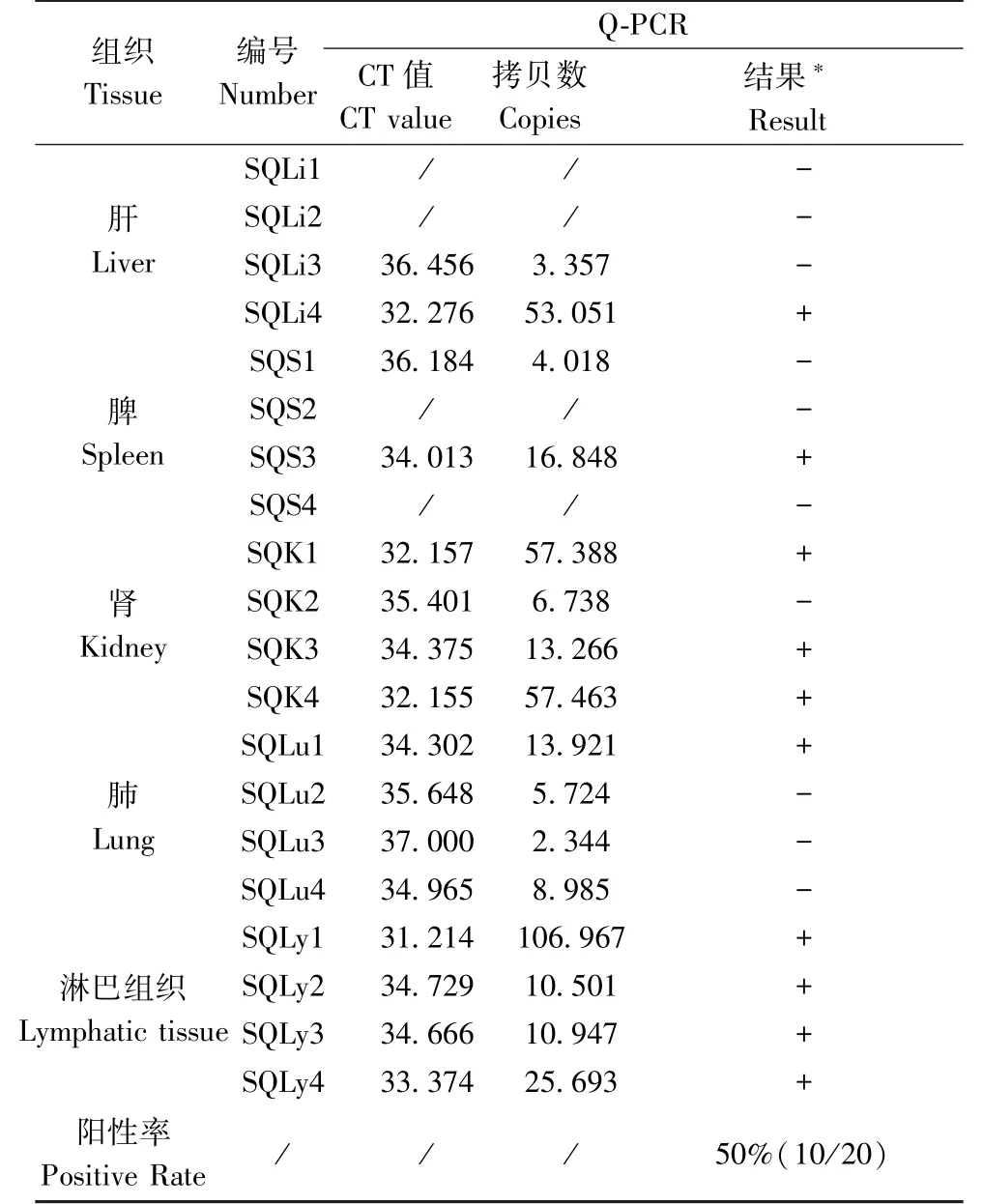
表3 黄鼠组织样本ECTV 检测结果Table 3 Results of ECTV detection for ground squirrel tissue samples
图4 黄鼠组织ECTV FQ-PCR 检测的扩增曲线Figure 4 The amplification curve of ground squirrel tissue samples for ECTV FQ-PCR test
近些年关于ECTV 的分子学诊断方法得到了广泛关注,分别针对ERPV_027 基因[6]、核心蛋白P4b基因[7]设计了荧光定量PCR 方法,针对CrmD基因建立了环介导等温扩增可视化检测方法[2]。 本研究针对CrmD基因建立FQ-PCR 方法,CrmD基因位于ECTV 的两端重复序列中,相当于一个病毒粒子中含有2 个拷贝的基因,且CrmD基因与病毒繁殖方式有关[8],在感染组织中核酸峰度较高,进一步提高了检测的灵敏度。 TaqMan 荧光定量PCR 方法具有灵敏度高、特异性强、操作简便易于高通量检测等优点,具有较高的适用性。
使用建立的ECTV FQ-PCR 检测实验室22 份小鼠组织,未检测出阳性,说明国内屏障系统小鼠ECTV 的感染得到了很好的监测和控制。 检测63份裸鼹鼠组织ECTV 结果为阴性,说明裸鼹鼠对ECTV 敏感性较低,但裸鼹鼠对ECTV 是否具有抗病毒作用还需要进一步的研究分析。 20 份黄鼠组织检测出ECTV 阳性,说明黄鼠为ECTV 的易感宿主。 小鼠感染ECTV 时,首先通过皮下感染位点扩散至淋巴结,侵入血液后引发一级病毒血症使病毒进入脾和肝[8]。 本研究在4 只黄鼠的淋巴结均检测到ECTV,而在肝、脾、肾、肺组织仅有部分检测出病毒,说明ECTV 在黄鼠体内有与小鼠相似的感染途径。 使用ECTV FQ-PCR 黄鼠组织的检出率为50%,但病毒的拷贝数都比较低,而使用血清学方法未检出黄鼠鼠痘抗体阳性可能是由于此时正处于感染初期,为鼠痘抗体产生的空窗期,因此造成假阴性,也可能是由于使用大鼠的酶联免疫吸附实验与黄鼠中鼠痘抗体没有交叉反应,造成阴性结果。黄鼠主要分布于我国北部和西部地区,由于其特有的生物学特性,已被大量用于医学实验和冬眠生理学的实验材料,神经生物学工作者也开始使用黄鼠作为研究对象[9-10],也应用于病毒性肝炎的实验动物模型[11]。 但是黄鼠的实验动物化研究还存在很多空白,微生物携带情况及致病性研究为黄鼠饲养规范提供技术支持,有效促进黄鼠的实验动物化进程。 同时,黄鼠感染ECTV 提示其作为新兴实验用动物使用时,需要避免其对实验动物饲养环境的污染,以免引起ECTV 在实验室小鼠的爆发。
