生物与化学转化黄芩苷为黄芩素的研究
2021-02-22江慧玲王鸿飞巴塔拿奥斯曼科拉罗海波陈育如
刘 超,江慧玲,王鸿飞,巴塔拿,奥斯曼·科拉,罗海波,陈育如
(1.南京师范大学食品与制药工程学院,江苏 南京 210023) (2.南京师范大学江苏省微生物与功能基因组学重点实验室,江苏省微生物资源产业化工程技术研究中心,江苏 南京 210023) (3.阿达纳阿尔帕斯兰科技大学工程学院,土耳其 阿达纳 01180)
黄芩(ScutellariabaicalensisGeorgi)属唇形科黄芩属植物,别称苦芩、山茶根、条芩等,适宜生长在海拔500~1 500 m的向阳且较干燥的地区[1-2],分布较广,在我国北方多数省区如黑龙江、辽宁、内蒙古、河南、河北等地及日本、朝鲜、俄罗斯等地[3-4]均可种植. 黄芩是中国和东亚国家常用的一种重要的传统药材,通过传统医学的“清热”机制治疗呼吸道和胃肠道的细菌感染[5]. 黄芩茎叶可药用也可做茶饮[6]. 近年来,除地下部分根外,其地上部分的研究受到广泛关注[7]. 植化和药理学研究发现,黄芩根及茎叶中主要成分为黄酮类化合物[8],具有抗氧化、抗炎、抑制肿瘤等作用[9-11]. 黄芩根成分的研究主要集中于黄酮类、苷类、萜类、有机酸、微量元素等方面[12-14],已分离出70多种黄酮类化合物,包含黄酮、黄酮醇、二氢黄酮及其苷类成分、1个双黄酮、1个查尔酮类成分,同时还分离得到10多种木脂素及其苷类成分,以及汉汉黄芩素、白杨素、芹菜素等[15-18].
传统的黄芩素制备有酸水解法、热裂解法及化学合成法. 酸水解法过程需要消耗大量的酸,环境污染大. 热裂解方法所需温度高,能耗大且产率较低. 本工作对生物转化和改良酸水解转化黄芩苷为黄芩素进行了探讨,以期低成本、高效率地制备黄芩素.
1 材料、设备与方法
1.1 材料与试剂
1.1.1 菌种与培养基
黑曲霉(Aspergillusniger)、根霉(Rhizopuschinensis)、 嗜松青霉(Penicilliumpinophilum)、木霉(Trichodermaviride)、米曲霉(Aspergillusoryzae)等均由本课题组分离保藏.
斜面保藏培养基:200 g土豆、20 g葡萄糖、1.5%~2%琼脂、1 000 mL水.
固体发酵培养基:3 g甘蔗渣、4 g豆渣、7 g麸皮、15 mL营养液(硫酸镁0.08%、硫酸铵2.0%、磷酸二氢钾0.04%,pH6.5).
1.1.2 材料与试剂
黄芩根,市购;黄芩根提取物,山东天华制药,含量92.6%;土豆,市购.
黄芩苷标准品、黄芩素标准品,上海源叶生物科技有限公司,HPLC≥98%;无水磷酸氢二钠,天津市科密欧化学试剂有限公司,AR;柠檬酸、无水磷酸二氢钾,国药集团化学试剂有限公司,AR;浓硫酸、无水硫酸镁、硫酸铵,西陇化工股份有限公司,AR.
1.2 仪器与设备
CJ-1D垂直超净工作台,天津市泰斯特仪器有限公司;高压蒸汽灭菌锅,日本TOMY公司;Agilent1100组合式高效液相色谱仪、Agilent Technologies 6460 Triple Quad LC/MS液质联用仪,美国安捷伦公司;数控超声波清洗器,昆山市超声仪器有限公司;SHBⅢ循环水式多用真空泵,郑州长城科工贸有限公司;DK-8D电热恒温水槽,上海精宏实验设备有限公司.
1.3 方法
1.3.1 黄芩根成分分析
1.3.1.1 黄芩根提取液制备
准确称取黄芩根粉末1 g,按1∶20料液比加入20 mL 体积浓度70%乙醇,经超声辅助浸提1 h后,0.22 μm 微孔滤膜精密过滤,置于-4 ℃冰箱保存,供HPLC分析.
1.3.1.2 高效液相色谱条件
色谱柱:UltimateAQ-C18;检测器:VWD(DEAAD02884)detector;检测波长:335 nm;进样量:20 μL;流动相:0.1%甲酸水-乙腈(A-B);流速:0.6 mL/min;柱温:30 ℃,等梯度洗脱.
1.3.1.3 质谱条件
电喷雾电离(ESI)接口;负离子模式检测;加热毛细管温度300 ℃;扫描范围m/z 100~1 000;吹扫气压力2.41×105Pa;雾化气压3.5 kV;一级质谱碰撞能量为135 V,二级质谱碰撞能量为10、20、30、40 eV.
1.3.2 转化菌株的筛选
1.3.2.1 菌株培养
孢子悬液的制备:在黑曲霉、木霉、根霉、嗜松青霉和米曲霉斜面菌种中分别加入5 mL无菌水,用接种环将孢子刮入水中制得孢子菌悬液.
固体培养基培养:在固体培养基中分别接入上述孢子菌悬液,搅匀,28 ℃恒温培养5 d.
1.3.2.2 酶液制备
将发酵好的物料按曲∶水=1∶4(质量比)的比例加入pH 5.0的磷酸氢二钠-柠檬酸缓冲液(0.2 mol/L磷酸氢二钠、0.1 mol/L柠檬酸),在45 ℃的水浴中浸提40 min,抽滤后即得酶液.
1.3.3 标准溶液的配制
黄芩苷标准品:精密称取黄芩苷标准品25 mg,溶解于100 mL 70%乙醇溶剂中,精确配制成浓度为0.25 mg/mL的黄芩苷标准品溶液. 用70%乙醇溶液稀释成以下浓度:0.02、0.04、0.06、0.08、0.1 mg/mL,以黄芩苷浓度(mg/mL)为横坐标,峰面(mAU*s)为纵坐标,绘制标准曲线.
黄芩素标准品:精密称取黄芩素标准品10 mg,溶解于100 mL的70%乙醇溶剂中,精确配制成浓度为0.1 mg/mL的黄芩素标准品溶液. 用70%乙醇溶液稀释成以下浓度:0.02、0.04、0.06、0.08、0.1 mg/mL,以黄芩素浓度(mg/mL)为横坐标,峰面积(mAU*s)为纵坐标,绘制标准曲线.
1.4 转化产物分析
黄芩苷转化率的计算:
黄芩苷转化率yConversion(%)=(C0-C1)/C0×100%,
式中,C0为黄芩苷的初始浓度,由黄芩苷的标准曲线按照一定系数比计算得到;C1为转化后黄芩苷的浓度,由黄芩苷的标准曲线得到.
黄芩素得率的计算:
黄芩素得率yYield(%)=(C2-C3)/C4×100%,
式中,C2为转化后黄芩素的浓度,由黄芩素的标准曲线计算得到;C3为转化前黄芩素的浓度,由黄芩素的标准曲线得到;C4为转化后黄芩素的理论浓度[19].
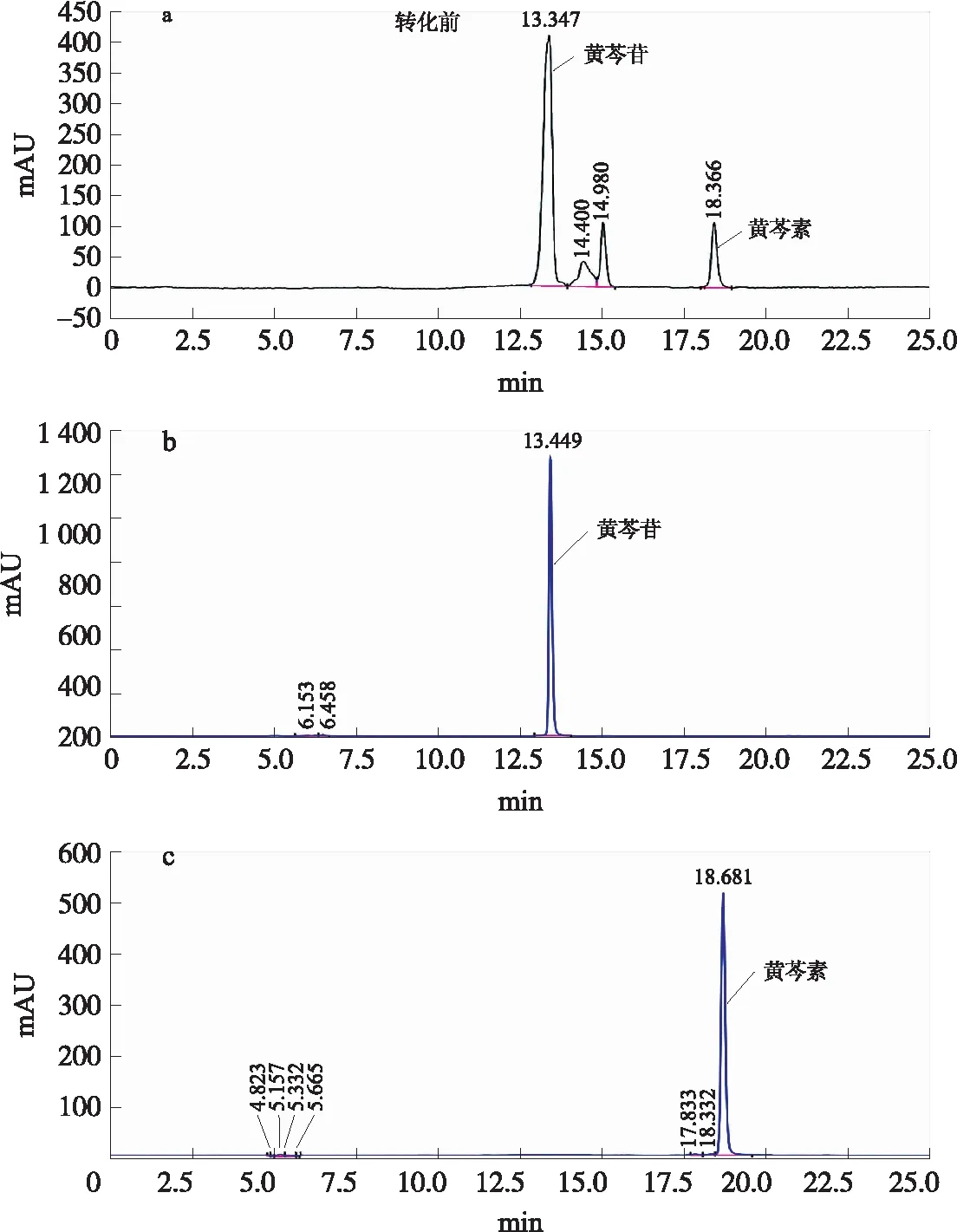
图1 黄芩根提取液和标准品HPLC图Fig.1 HPLC spectrum of Scutellaria root extract and standards
2 结果与讨论
2.1 黄芩根黄酮类化合物的鉴定
黄芩根提取液经HPLC分析,有4个较明显的峰(见图1a),经与标准品进行对比和LC-MS分析,得到其中13.4 min出现的峰对应的是黄芩苷,18.4 min出现的峰对应的是黄芩素.
图1a为黄芩根按照1.3.1的方法经超声辅助提取1 h后提取液的HPLC分析图. 在1.3.1.2的检测条件下,黄芩根提取液中有4种醇溶性物质被检出,出峰时间分别为13.3、14.4、14.9和18.3 min. 与标准对照品对照(图1b和c),图中最高峰为黄芩苷(13.3 min),含量为5.13%;18.4 min的峰是黄芩素,含量为0.40%.
2.2 黄芩根提取物化学酸水解
配置浓度分别为60%、70%、80%、90%、98%的硫酸,于40 ℃分别水解黄芩根提取物15 min,考察硫酸浓度对水解效果的影响,结果如图2所示.
选择98%浓硫酸,分别于0、20、40、60、80、100 ℃分别水解黄芩根提取物15 min,考察温度对化学酸水解黄芩苷的影响,结果如图3所示.
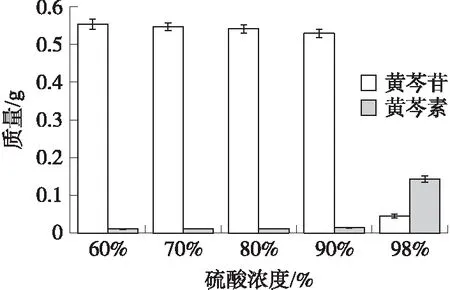
图2 硫酸浓度对黄芩素生成量的影响Fig.2 The effect of sulfuric acid concentration on the concentration of baicalein

图3 反应温度对黄芩素生成量的影响Fig.3 The effect of temperature on the concentration of baicalein
从图2可见,98%的硫酸水解时,黄芩苷的减少量和黄芩素的增加量最多,与其他浓度条件下有明显差异,说明98%的强酸对黄芩苷的快速水解最为有利.
从图3可见,起始温度为0 ℃时,转化率为95.1%,产物得率为51.5%;起始温度为100 ℃时,转化率为98.8%,产物得率为38.6%. 可见,温度过高导致原料分解,使产物得率低,故起始温度较低较为合适. 考虑到0 ℃与40 ℃的转化率与得率无明显差异,从工业生产的经济成本考虑,40 ℃或常温更为经济.
40 ℃ 98%硫酸水解反应15 min转化黄芩根提取物2 g,得到黄芩苷转化率为98.3%,产物黄芩素得率为51.6%,与传统的化学水解方法相比得率提高了6.2%.
2.3 黄芩苷的微生物酶法转化
2.3.1 微生物转化的菌种筛选

表1 不同菌株转化黄芩根提取液0.5 h后原料及产物浓度Table 1 Concentration of raw materials and products after transformation of Radix Scutellariae extract by different strains for 0.5 h mg/mL
选取实验室保存的5株真菌转化黄芩苷,发酵培养 5 d,浸提酶液的pH调至5.0,按质量浓度比为1∶5(g/mL)的比例浸提酶液,所得酶液10 mL加入黄芩根提取物2 g,于55 ℃恒温水浴中反应,0.5 h后测定原料及产物浓度,结果如表1所示.
由表1可见,转化黄芩根提取液0.5 h后,5种菌株均能将黄芩苷转化为黄芩素. 空白样中黄芩素的浓度为0.01 mg/mL. 经米曲霉酶液转化后,黄芩素浓度为0.11 mg/mL,是转化前原样中黄芩素原始浓度的11倍;木霉转化后黄芩素浓度为0.05 mg/mL,为原始浓度的5倍;根霉转化后黄芩素浓度为0.04 mg/mL,为原始浓度的4倍;嗜松青霉基本无转化效果. 经黑曲霉酶液转化0.5 h后,黄芩苷浓度降为0.29 mg/mL,为原始浓度的58%;黄芩素浓度从0.01 mg/mL提高至0.15 mg/mL,为原始浓度的15倍. 可见,5种菌株中以黑曲霉转化黄芩根提取液中黄芩苷的转化率最高,故后续选择黑曲霉为转化菌株.
2.3.2 黑曲霉酶液转化结果
黑曲霉所提酶液在适宜条件下,转化2 g黄芩根提取物8 h,共转化黄芩苷1.7 g,得到产物黄芩素0.7 g;转化10 h,共转化黄芩苷1.79 g,得到产物黄芩素0.93 g. 与马宗敏等[20]将18.58 mg黄芩苷转化为9.43 mg黄芩素、转化率为83.8%相比,本工作将1.79 g黄芩苷转化为0.93 g黄芩素,转化率为89.5%.
2.4 不同转化方法的效果比较
化学水解和生物转化黄芩素的对比结果如表2所示.
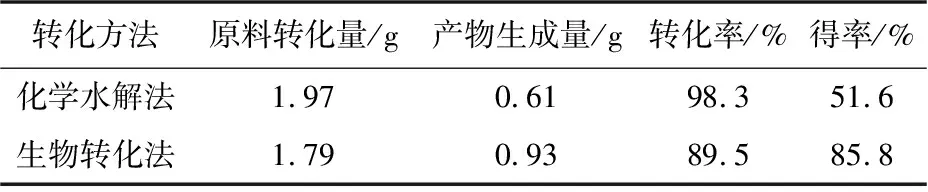
表2 化学和生物方法转化黄芩苷与黄芩素的含量变化Table 2 Content changes of baicalin and baicalein transformed by chemical and biological methods
由表2可见,利用优化后的化学水解法对1.97 g黄芩苷进行转化,得到0.61 g黄芩素,转化率为98.3%,得率为51.6%,比许闽等[21]报道的转化率提高了6.2%;利用本实验室筛出的黑曲酶所提酶液对1.79 g黄芩苷进行转化,得到0.93 g黄芩素,转化率为89.5%,得率为85.8%,与郭艳霞等[19]用纤维素酶和果胶酶混合将黄芩苷转化为黄芩素,转化率为62.1%进行对比,本工作的转化率高出27.4%,得率更高.
3 结论
本文采用生物转化法和化学水解法将黄芩苷转化为黄芩素. 化学水解法能够高效转化原料黄芩苷,转化率达到98.3%,但产物得率仅为51.6%,且易造成环境污染. 生物转化法的转化率与得率分别达到89.5%与85.8%,在保证转化率和得率的情况下,生物转化法克服了强酸的缺点,是更为高效且绿色环保的方法.
