功能叶早衰突变体水稻后期自然衰老的生理特性研究
2021-02-22王复标戎玲玲余世洲孙惠敏
王复标 戎玲玲 安 婷 余世洲 孙惠敏
(1井冈山大学生命科学学院,江西 吉安 343009;2西北农林科技大学农学院,陕西 杨凌 712100)
叶片早衰是水稻生理代谢机能过早衰退的一种生理现象,是由遗传因子调控的细胞程序性死亡过程。我国大面积推广种植的杂交水稻,在生育后期普遍穗大粒多,而叶片生育后期早衰已成为限制产量和品质提高的重要因素[1-2]。水稻上部3 片功能叶分化起步晚、受光条件优越、功能期较长,在生育后期主要为籽粒灌浆提供光合碳水化合物[3-4]。研究表明,水稻功能叶提供了籽粒灌浆结实所需光合碳水化合物的70%~80%[5-6]。因此,研究水稻生育后期不同叶位功能叶的光合生理特性衰老变化,对充分挖掘水稻品种的产量潜力,制定高产甚至超高产育种及栽培措施具有重要意义。
叶片衰老的原因较为复杂,其过程涉及叶绿素降解、叶片结构损伤、细胞膜结构破坏、活性氧(reactive oxygen species, ROS)及抗氧化保护酶类活性降低以及衰老相关基因的表达等诸多代谢途径[7-12]。目前研究叶片早衰的方法大多集中在高温、高盐、重金属、紫外等逆境胁迫下诱导叶片衰老;分析胁迫条件下叶片衰老的形态结构、生理特性及基因表达的变化[13-15]。然而,逆境胁迫往往会对植物造成较大伤害;且逆境胁迫诱导的早衰与水稻叶片自然衰老过程的生理代谢差异巨大。因此,逆境胁迫诱导叶片衰老的研究结果难以直接应用于水稻生育后期耐早衰品种的选育指导。
研究人员通过物理、化学或辐射诱变等多种手段,获得了小麦、玉米、大麦、水稻等农作物的叶片早衰突变体,并对其调控基因进行了定位与克隆[16-18]。然而,这些突变体的株高和生育期普遍与野生型有明显差异,大多数突变体在苗期或营养生长阶段就显示出较为明显的叶片早衰症状[18-21]。孙出等[20]利用60Coγ 射线辐射浙恢7954 成熟种子,获得了1 份早衰突变体els-R7954,该突变体基部叶片在分蘖期就出现较明显的褐色早衰症状;至孕穗期,其上部3 片功能叶表现出早衰症状;到灌浆期,各功能叶基本枯萎死亡,生育期均难以持续至水稻成熟期。由于前人筛选获得的突变体功能叶早衰症状基本在生育早期就已显现,且功能叶生育期普遍较短,因此,已报道的突变体难以用来研究不同叶位功能叶在生育后期自然衰老过程中叶绿素荧光和抗氧化代谢生理特性的变化。本研究选用经60Co-γ 辐射诱变获得的株高和生育期与野生型基本一致的叶片早衰突变体水稻材料,该突变体功能叶的衰老起始于生育后期,且生育期基本可以持续到水稻成熟期,比较分析了突变体与野生型上部3 片功能叶在生育后期自然衰老过程中叶绿素荧光及其抗氧化代谢的差异,旨在为进一步研究分析水稻叶片早衰机理及不同功能叶对籽粒灌浆的影响奠定理论基础。
1 材料与方法
1.1 试验材料
供试材料为抽穗后剑叶开始早衰的突变体(oryza sativapremature leaf senescence 2,ospls2)及其野生型浙恢7954(WT)。该突变体是通过对野生型浙恢7954成熟种子进行60Co-γ 射线辐射后筛选获得,已种植到M8,突变体早衰性状遗传表现稳定。突变体ospls2 的遗传表现为,在水稻苗期到分蘖拔节期之前,其株高、叶片颜色、分蘖数与WT 几乎无差别,外观未表现出明显的叶片早衰症状;但在孕穗期后,突变体叶片由下到上逐渐表现出衰老症状;到抽穗期,中部和下部功能叶(分别指倒2 叶和倒3 叶)已表现出较明显的早衰症状,3~4 d 后,上部功能叶(剑叶)叶尖开始出现早衰症状。首先是叶尖处出现铁锈状斑点症状,之后早衰斑点症状沿叶脉逐渐扩展至整个叶片,到抽穗后28 d 左右,早衰症状覆盖整个剑叶,随后逐渐卷曲枯死,倒3 叶也在抽穗后21 d 左右逐渐卷曲枯死(ospls2 倒3 叶的生理指标测定不包括28 d),此时WT 上部3 片功能叶除倒2 叶和倒3 叶在抽穗后的28 d 表现正常的衰老黄化外,其他时期叶色基本保持正常的绿色(图1)。
试验于2019年在井冈山大学教学实验农场进行。5月下旬播种,6月下旬移栽,常规大田水肥管理。每品种种植3 个小区,每小区种植6 行×8 列。待水稻抽穗时,每品种选取同一天抽穗的植株挂牌标记,在上午9:00-11:00 进行取样,分别采集ospls2 和野生型上部3 片功能叶(剑叶、倒2 叶和倒3 叶),每7 d 取样一次,用于后续各项生理指标的测定。随机取样,重复3 次。
1.2 测定项目与方法
1.2.1 叶绿素和叶绿素荧光测定 叶绿素含量测定:参照Lichtenthaler[22]的方法,80%丙酮提取后,采用UV-VIS-spectrophotometer-756(上海光谱仪器有限公司)测定叶绿素含量。光系统Ⅱ(photosystem Ⅱ,PSⅡ)叶绿素荧光参数测定:采用Dual-PAM-100 双通道调制叶绿素荧光仪(德国walz 公司)测定各时期功能叶叶绿素初始荧光(initial chlorophy fluorescence,F0)和PS Ⅱ最大光化学效率(maximum photochemical efficiency of PSⅡ,Fv/Fm)。测定前试验材料先遮光暗处理25 min,仪器测定模式选择Fluo,分析模式选择饱和脉冲分析(SP analysis),其他参数选择默认设置。
1.2.2 相对电导率和H2O2含量测定 相对电导率测定参照Pradhan 等[14]方法,采用浸泡法,将叶片用自来水冲洗干净后用去离子水冲洗3 次,擦干水分,去除叶片主脉,叶片剪成2 cm 左右的长条。称取0.1 g样品于装有10 mL 去离子水的试管中,重复3 次,室温浸泡12 h,用雷磁DDS-307 电导率仪(上海仪电科学仪器股份有限公司)测定浸泡液电导率(R1),然后沸水浴30 min,冷却至室温再次测定电导率(R2),相对电导率=R1/R2×100%。H2O2含量测定采用硫酸钛法[23]。
1.2.3 抗氧化保护酶活性测定 超氧化物歧化酶(superoxide dismutase,SOD)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX) 活性测定参照Cakmak等[24]的方法。SOD 活性测定采用氮蓝四唑(nitro-blue tetrazolium,NBT)光还原法,以黄嘌呤氧化酶抑制率为50%时作为一个酶活力单位;APX 活性以抗坏血酸(ascorbic acid, ASA)被氧化时,溶液在290 nm 波长外的下降速率来计算。过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT) 活性测定参照Scebba等[25]的方法,POD 活性采用愈创木酚氧化法测定;CAT 活性利用H2O2在240 波长下有最大吸收进行测定,以1 min 内A240吸光值下降0.1 为1 个酶活力单位(U)。
1.2.4 可溶性糖含量测定 将新鲜样品先在120℃烘箱杀青,然后75℃烘干至恒重,研磨至粉末,称取0.05 g 干样粉末,为避免淀粉对测定的干扰,提取液采用80%乙醇,利用蒽酮法测定可溶性糖含量[17]。
1.3 数据分析
数据处理与制图采用Microsoft Excel 2010 完成。
2 结果与分析
2.1 ospls2 和WT 叶绿素和叶绿素荧光的差异
由图2 可知,在水稻生育后期叶片自然衰老过程中,ospls2 除剑叶叶绿素含量在抽穗后0 d 与WT 剑叶无明显差异外,倒2、倒3 叶均明显低于同时期的WT,且随着叶片的衰老,叶绿素含量迅速下降,至抽穗后21 d, 其剑叶、倒2 叶和倒3 叶叶绿素含量分别仅为抽穗期0 d 的49.70%、37.62%和35.09%。同一时期,WT 各功能叶间叶绿素含量差异不明显,且均随着叶片衰老而缓慢下降。在抽穗后21 d,WT 剑叶、倒2 叶和倒3 叶叶绿素含量分别较抽穗后0 d 下降了23.94%、30.59%和22.83%;同一时期的ospls2 剑叶、倒2 叶和倒3 叶的叶绿素含量分别下降了50.30%、62.38%和64.91%,ospls2 下降幅度明显大于WT。将叶片叶绿素含量降低50%作为叶片功能期持续时间的衡量标准[1,8],ospls2 各功能叶的功能期均小于21 d,而WT 各功能叶的功能期均大于21 d。对相同叶位的功能叶,ospls2 在整个取样时期叶绿素a/b 值均明显低于WT,且随着叶龄的增加呈降低趋势;从不同叶位的功能叶来看,ospls2 下部功能叶的叶绿素a/b 值明显低于上部功能叶。WT 功能叶间的叶绿素a/b 值差异不明显。
由图3-A 可知,在整个取样时期(除抽穗期0 d外),ospls2 各功能叶的F0均明显高于WT,且随着叶片衰老明显上升;从不同叶位功能叶来看,下部功能叶的F0明显大于上部功能叶。WT 不同功能叶在取样的早期(抽穗后0 ~14 d)F0均维持在较低水平,不同叶位功能叶间差异不明显,抽穗后21 d 开始呈上升趋势。由图3-B 可知,WT 上部3 片功能叶中的Fv/Fm差异不明显,仅在自然衰老后期(抽穗后14 d)开始下降。ospls2 除剑叶的Fv/Fm在衰老早期阶段(抽穗后0~7 d)与WT 无明显差别外,其他取样时期,各功能叶的Fv/Fm均明显低于WT,且随着抽穗后天数的增加呈明显下降趋势,就不同叶位功能叶而言,表现为剑叶>倒2 叶>倒3 叶。
2.2 ospls2 和WT 相对电导率和H2O2 含量差异
ROS 的增加被认为是引起叶片衰老的主要原因[3,7]。由图4 可知,除倒3 叶外ospls2 另外2 片功能叶的H2O2含量和相对电导率均随着叶片衰老呈明显的上升趋势,且总体表现为倒2 叶大于剑叶。不同取样时期,ospls2 各功能叶的H2O2含量和相对电导率均明显高于相同叶位的WT。WT 各功能叶之间的H2O2含量差异不明显,但整体均随叶片衰老而明显上升。WT 各功能叶的相对电导率在叶片衰老早期(抽穗后0~7 d)均维持在较低水平,但倒2 叶和剑叶在叶片衰老后期(抽穗后21 ~28 d)明显上升,倒3 叶则在抽穗后7~21 d 明显上升(图4)。
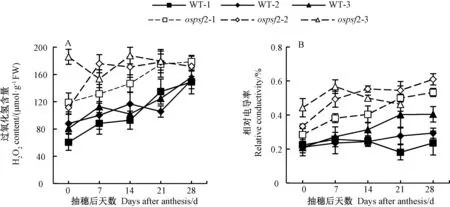
图4 突变体ospls2 和浙恢7954(WT)抽穗后功能叶H2O2 和相对电导率的变化Fig.4 Variation of H2O2 and relative conductivity in functional leaves of the ospls2 mutant and its wild type Zhehui 7954 after anthesis
2.3 ospls2 和WT 抗氧化保护酶活性差异
抗氧化保护酶在植物体内担负清除ROS 的功能,其活性的高低与植物叶片的衰老密切相关[6,8,17]。由图5-A 可知,ospls2 各功能叶中的SOD 活性均随着叶片衰老呈明显下降趋势,且倒3 叶明显低于同一取样时期的剑叶和倒2 叶。整个取样时期(除抽穗期0 d外),ospls2 各功能叶的SOD 活性均明显低于WT。WT各功能叶SOD 活性高低表现为剑叶>倒2 叶>倒3 叶,其中,倒2 叶和倒3 叶均随着叶片衰老呈缓慢下降趋势,而剑叶表现为缓慢上升趋势。由图5-B、C 可知,整个取样时期(除抽穗后0 ~7 d 外),ospls2 各功能叶的CAT 和APX 活性均明显低于WT,CAT 活性在抽穗后7~14 d 明显降低,而APX 活性(除剑叶外)在抽穗后0~7 d 快速下降。WT 各功能叶的CAT 活性基本在抽穗后14 d 达到最大,APX 活性则在抽穗后0~7 d 较高,然后随着叶片衰老明显下降。由图5-D 可知,POD 活性变化趋势则相反,ospls2 剑叶和倒2 叶的POD 活性均随着叶片衰老呈明显的上升趋势,而倒3叶呈下降趋势。ospls2 各功能叶中POD 活性均明显高于相同叶位的WT。WT 不同功能叶之间的POD 活性在叶片衰老早期(抽穗后0 ~7 d)差异不明显,且均在抽穗后14~21 d 缓慢上升。

图5 突变体ospls2 和浙恢7954(WT)抽穗后功能叶抗氧化保护酶的变化Fig.5 Variation of the activities of antioxidant protective enzyme in functional leaves of the ospls2 mutant and its wild type Zhehui 7954 after anthesis
2.4 ospls2 和WT 可溶性糖含量的差异
水稻可溶性糖含量可直接反映生育后期功能叶光合碳同化能力,其含量降低被认为是叶片衰老的基本特征[7,13]。由图6 可知,在整个取样时期,ospls2 各功能叶可溶性糖含量均明显低于相同叶位的WT,且均在抽穗后7~14 d 明显下降,其中下部功能叶可溶性糖含量明显低于上部功能叶。WT 剑叶可溶性糖含量在整个取样时期(除抽穗后21 d 外)明显大于倒2 叶和倒3 叶,其中,剑叶在抽穗后21 d 下降至最低,倒2叶和倒3 叶均在抽穗后14 d 下降至最低。
3 讨论
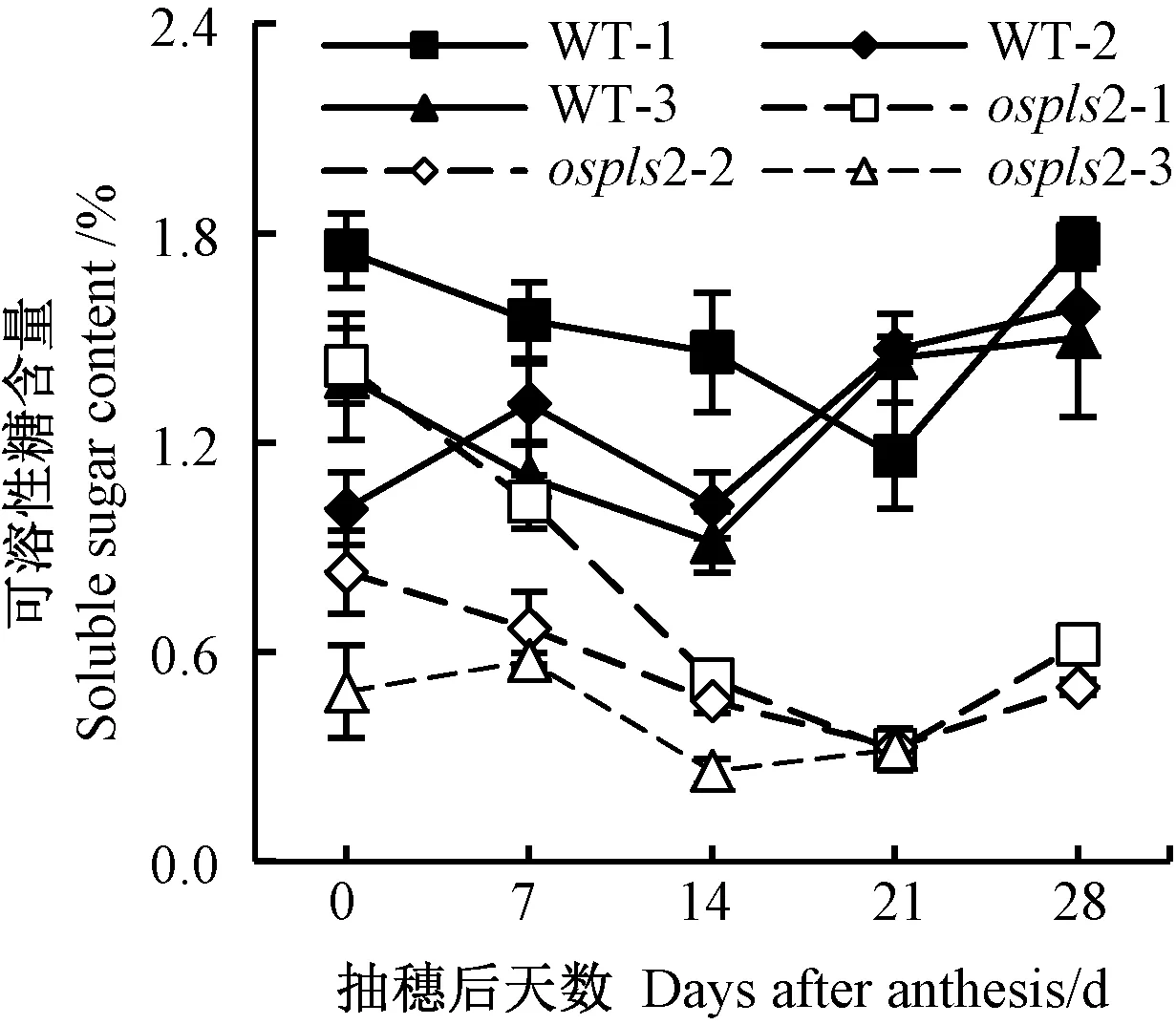
图6 突变体ospls2 和浙恢7954(WT)抽穗后功能叶可溶性糖含量Fig.6 Variation of the soluble sugar in functional leaves of the ospls2 mutant and its wild type Zhehui 7954 after anthesis
目前已有关于部分水稻叶片早衰突变体的相关报道,其叶片早衰表型分别为:osled叶片为枯斑早衰[2],es5 叶片为苗期早衰[5],es3(t)[10]和esl5[16]叶片均为黄化早衰,els-R7954[20]为叶片出现褐色斑点早衰。本试验研究的突变体ospls2 和els-R7954 选育途径相同,均采用60Co-γ 射线辐射诱变浙恢7954 成熟种子选育。但2 个突变体在表型上存在明显区别,els-R7954 叶片在分蘖期即表现出早衰症状,其功能叶在孕穗期表现出明显的早衰症状,且在灌浆期全部枯萎死亡,导致els-R7954 在成熟期株高、叶片大小、分蘖数和茎秆粗细均明显低于WT;ospls2 叶片的衰老明显晚于els-R7954,其叶片在分蘖拔节期之前与WT 基本相同,均保持正常的绿色,功能叶则在生育后期开始衰老且生育期基本可以维持到水稻成熟期。究其原因,可能是ospls2 在整个生育期叶片衰老时间较els-R7954 推迟导致的。
叶绿素a/b 值的下降是衡量水稻叶片衰老的重要生理特征[8]。前人研究表明,水稻、玉米等农作物的叶片衰老时,叶绿素和净光合速率均明显下降,且叶绿素a 的降解速率比叶绿素b 快[26-29]。其原因可能与叶绿素a 和叶绿素b 在光反应过程中的功能不同有关。在叶绿体中,叶绿素a 主要存在于光系统Ⅰ(photosystem Ⅰ, PSⅠ)和PSⅡ中,其中,少量处于激发态的叶绿素a 在光能转换过程中发挥重要作用,极易遭受ROS 的氧化损伤;而叶绿素b 主要存在于PSⅡ中,与特异性的天线蛋白结合成捕光色素蛋白复合物,主要在光反应过程中起捕获光能和聚集能量的作用[30-31]。Foyer 等[32]研究表明,叶绿体光反应产生的ROS 含量约占植物细胞的90%,且叶绿素a 对ROS 的反应较叶绿素b 更为敏感。Dietz 等[33]研究也显示,随着叶片的衰老作物叶肉细胞将产生大量的ROS。本研究中,随着灌浆结实及叶片的衰老,早衰突变体各功能叶中的H2O2含量明显高于WT,且下部功能叶总体高于上部功能叶,这可能是ospls2 叶绿素a/b 值下降速率大于WT 的重要生理因素之一。
通过对水稻生育后期叶片衰老过程中叶绿素荧光的观测,可以探究叶片自然衰老过程中光合生理特征变化与细胞结构间的生理联系[34-35]。F0是PSⅡ反应中心处于完全开放状态时的荧光产量,代表不参与PSⅡ光化学反应的初始光能辐射部分,其大小与叶绿素含量有关。李小蕊等[34]研究表明,F0随着叶绿素含量的降低而下降,但PSⅡ光反应中心损伤或者失活又可以使其升高,因此,在叶片衰老过程中F0的升高或者降低主要与引起其变化的关键因素有关。本研究表明,ospls2 功能叶Fv/Fm总体明显小于WT,且衰老程度大的下部功能叶明显小于上部功能叶,表明早衰突变体的PSⅡ光反应中心损伤或者失活明显高于WT,这可能是引起其初始荧光F0上升的主要原因之一,说明在水稻生育后期功能叶自然衰老过程中,早衰突变体F0变化的方向主要取决于其PSⅡ光反应中心的损伤与破坏。
酶促抗氧化系统是植物清除ROS 的重要系统,可以迅速清除逆境胁迫、氧化损伤等各种代谢过程产生的ROS,使叶片ROS 始终维持在较低水平,保护植物免遭ROS 的氧化损伤[17,36]。在本研究中,ospls2 各功能叶中的SOD、CAT 和APX 活性明显低于相同叶位的WT,且均随着叶片的衰老明显下降,表明在水稻生育后期叶片衰老过程中,抗氧化保护酶活性的降低导致ROS 不能被及时清除,这可能是引起早衰突变体叶片过早衰老的主要原因。生育后期ospls2 功能叶叶绿素含量降低和相对电导率增加都表明其叶片结构遭遇了氧化损伤。前人研究表明,当植物遭遇短暂的生物或非生物胁迫时,可以诱导植物抗氧化保护酶活性瞬时增加[2,7,14]。本研究结果显示,ospls2 剑叶的抗氧化保护酶活性在叶片衰老的起始阶段(抽穗后0~7 d)并未表现出瞬时上升现象,而WT 剑叶的抗氧化保护酶活性在叶片衰老的起始阶均有不同程度的缓慢上升,这可能是WT 功能叶ROS 含量明显低于ospls2 的重要原因。值得注意的是,在生育后期水稻功能叶衰老过程中,两试验材料功能叶中不同抗氧化保护酶活性下降的起始时间不同。其中,ospls2 功能叶CAT 活性在抽穗后7~14 d 才明显下降,而APX 活性则在抽穗后0~7 d 即表现出明显的下降趋势;WT 功能叶CAT 活性的下降时间也明显晚于APX。表明ospls2 功能叶衰老起始阶段H2O2的积累可能主要与其APX 活性的降低有关,而衰老的中后期(抽穗后7 ~14 d)H2O2的积累可能主要源于CAT 活性的快速下降。
POD 是植物遭遇逆境胁迫时清除ROS 的关键酶,但关于叶片衰老过程中POD 活性的变化却不明确。Hui 等[17]研究小麦生育后期剑叶的衰老发现,小麦滞绿突变体(tag1)和野生型的剑叶POD 活性随着叶片的衰老明显上升。王贵民等[6]研究高产杂交水稻生育后期剑叶的衰老发现,剑叶POD 活性随着叶片的衰老明显降低。本研究中,ospls2 各功能叶的POD 活性均明显高于WT,且均随着叶片衰老明显上升。Vianello 等[37]对植物与微生物互作过程的研究显示,POD 可以催化植物质膜NADPH 氧化酶产生大量的ROS。此外,前人研究也表明,在各种逆境胁迫过程中,POD 具有双功能酶活性:一方面,在逆境胁迫时,其可以催化H2O2生成水;另一方面,它还可以催化质膜NADPH 氧化酶使植物产生ROS[25,36-37]。本研究推测POD 可能主要起促进ROS 产生致使叶片加速衰老的作用,而未起到抗氧化保护的功能。ospls2 功能叶叶绿素含量和可溶性糖含量的降低以及相对电导率的上升也可能是POD 在叶片衰老过程中对叶片结构的损伤作用导致的。
4 结论
水稻突变体ospls2 功能叶叶绿素荧光和抗氧化酶保护系统与生育后期叶片衰老密切相关。在整个抽穗灌浆结实期,ospls2 各功能叶叶绿素含量,叶绿素a/b值,Fv/Fm,SOD、CAT 和APX 活性均明显低于相同叶位的WT,且均随着叶片的衰老明显降低;POD 活性变化趋势则相反。在功能叶衰老早期,ospls2 ROS 的积累主要源于APX 活性的降低,在衰老中后期则可能主要与CAT 活性的降低有关。因此,可能是早衰突变体抗氧化保护酶系统的过早崩溃造成其叶片结构过早损伤,导致使其功能叶在生育后期光合碳水化合物供应不足而衰老。
