‘鄂马铃薯3号’对干旱胁迫早期响应的转录组分析
2021-02-21刘圣宣程云霞刘腾飞宋波涛
刘圣宣,程云霞,刘腾飞*,宋波涛
(1.农业农村部马铃薯生物学与生物技术重点实验室/湖北马铃暮工程技术研究中心/华中农业大学,湖北 武汉 430070;2.塔里木大学植物科学学院,新疆 阿拉尔 843300)
马铃薯(Solanum tuberosum L.)是继水稻、玉米和小麦之后,全球第四大粮食作物,为保障全球粮食安全以及满足未来人口增长对粮食的进一步需求等方面起着重要作用。马铃薯也是中国第四大农作物,因其具有高产、耐贫瘠、抗逆性强、经济效益高及产业链长等优点,从而成为贫困地区的主要粮食作物。此外,在不挤占粮食作物用地的前提下,通过种植马铃薯能有效扩充粮食供给,保障国家粮食安全。中国马铃薯年种植面积及总产量均居世界首位,种植面积和产量分别占全球的27.38%和24.53%[1],但是就马铃薯平均单产而言,中国是偏低的,甚至不及世界平均水平。由此可见,中国马铃薯的单产水平仍有很大的提升空间,而提高马铃薯单产水平的策略之一是选育优良品种。
干旱胁迫是制约作物产量的重要因素之一,不仅造成作物减产,甚至导致作物绝收。统计数据显示,由干旱引起的粮食减产率平均高达10.1%,是威胁粮食生产的最严重极端气候灾害[2]。作为干旱敏感作物,马铃薯的生长发育和产量的形成均受到干旱的严重威胁,其种植面积的扩大也受到干旱因素的限制[3]。因而,选育具有干旱抗性的新品种对于马铃薯产业的可持续发展有着积极意义。
由于固着生长的属性,植物在整个生命周期中需要应对各种不同胁迫的挑战,因而进化出了强大的环境适应能力。植物细胞通过改变细胞膨压或是膜受体活性来识别环境胁迫。随后胞外信号通过第二信使传递转化为胞内信号激活下游信号转导途径,启动逆境下的转录调控,从而积累胁迫相关的蛋白和代谢物应对逆境[4]。植物响应干旱胁迫的转录调控主要由脱落酸(Abscisic acid,ABA)依赖和非ABA 依赖两种途径实现。其中ABA 响应元件(ABA-responsive element,ABRE)和转录因子ABRE-binding protein/ABRE-binding factors(AREB/ABFs)在 ABA 依赖途径的基因表达调控中起关键作用,与之类似干旱响应元件(Dehydration-responsive element/C-repeat, DRE/CRT)和转录因子Dehydration responsive element binding(DREB)factors 在非ABA 依赖途径的基因表达调控中起关键作用[4]。
由于马铃薯根系浅并且稀疏的特征,大多数栽培种对干旱胁迫较为敏感,水分缺乏能抑制甚至完全停止马铃薯许多生理过程,如光合作用、呼吸作用和胞内的酶促反应[5],甚至短时间的干旱胁迫都能严重危害马铃薯的正常生长发育,最终影响块茎产量和品质[6]。由于同源四倍体栽培种马铃薯遗传背景复杂的特征,相较于其他作物,对马铃薯抗旱性研究机制严重滞后。近些年,利用RNA-seq 或Microarray 技术,多项研究对马铃薯干旱胁迫下的转录调控进行了分析[7-14],结果显示多种信号通路和代谢通路参与了马铃薯对干旱胁迫的响应,如ABA 途径、活性氧(Reactive oxygen species,ROS)清除、胚胎发育晚期富集蛋白(Late embryogenesis abundant,LEA)和热激蛋白的累积,碳水化合物代谢和氨基酸代谢途径。然而,研究极少针对马铃薯干旱胁迫早期的响应特征进行探究。基于此本研究利用栽培品种‘鄂马铃薯3 号’组培苗通过短时间干旱胁迫处理,通过形态观察,含水率变化测定及转录组分析以揭示马铃薯应对干旱胁迫的早期响应特征,为马铃薯抗旱性研究提供参考。
1 材料与方法
1.1 供试材料
试验所用的马铃薯材料为栽培品种‘鄂马铃薯3 号’(Solanum tuberosum cv. E3)。马铃薯试管苗培养于农业农村部马铃薯生物学及生物技术重点实验室的培养室,培养室温度设定为20℃,光照设定为(16 h 光照/8 h 黑暗),光照强度为400~600 μmol/m2·s。
1.2 材料处理
将‘鄂马铃薯3 号’试管苗在4%蔗糖的MS 培养基生长2 周后用于试管苗的干旱处理,处理方法为将试管苗整株拔出,放在吸水纸上置于环境控制良好的培养室中(温度为20℃,湿度为50%)进行模拟干旱早期胁迫处理。分别在处理0,1 和6 h 进行整株取样,每5 株作为一个重复,每个时间点取3 次重复进行后续表型及含水量分析和RNA 抽提。
1.3 含水量测定
取样后立即对每个样本进行称重,质量记为M1。然后将样品放入恒温干燥箱,烘干至恒重后,质量记为M2。含水量(%)=(M1 - M2)/M1 ×100,而后将结果导入GraphPad Prism 9 统计软件进行绘图及统计分析。统计分析采用GraphPad Prism 9 内置的One-way ANOVA 多重比较方法。
1.4 RNA抽提、文库构建和转录组分析
将上述样品在液氮中研磨成粉末,利用植物总RNA 提取试剂盒(RN33,艾德莱,中国)进行抽提,具体操作步骤严格按照说明书进行。每个样品取约2 μg RNA 用于文库构建。文库构建及测序委托北京贝瑞和康生物技术有限公司完成。获得的clean data 利用Salmon v.1.4.0 以DM1-3 v6.1(http://spuddb.uga.edu/dm_v6_1_download.shtml)转录本注释作为参考,参数设置为默认对转录本进行量化[15,16]。随后将Salmon 输出的数据导入R 包DESeq2[17],进一步进行差异表达分析。差异基因筛选的阈值为FDR <0.01, log2(fold change)>1。
2 结果与分析
2.1 ‘鄂马铃薯3 号’试管苗干旱处理过程中的表型及含水量变化
分别对‘鄂马铃薯3 号’试管苗不同干旱处理时间后的表型进行观察,结果如图1A 所示。干旱处理0 h 时,‘鄂马铃薯3 号’试管苗表现正常,在干旱处理1 h 后出现了微弱的萎蔫现象,而当干旱处理6 h 后‘鄂马铃薯3 号’试管苗叶片出现了明显的萎蔫,说明此时马铃薯已经出现了干旱胁迫。随后进一步对不同处理时间马铃薯叶片的含水量进行了测定,测定结果如图1B 所示。与表型观察结果相一致,‘鄂马铃薯3 号’试管苗在干旱处理0 h 时含水量最高,在处理1 h 后显著降低,而处理6 h 后含水量进一步降低。上述结果表明,随着干旱处理时间的延长,‘鄂马铃薯3号’试管苗受胁迫的程度逐步加深。
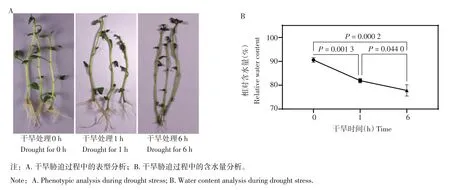
图1 马铃薯干旱胁迫处理不同时间点的表型及含水量分析Figure 1 Phenotype and water content analysis of potato at different time points under drought stress
2.2 ‘鄂马铃薯3 号’试管苗干旱处理过程中转录组分析
为了揭示‘鄂马铃薯3 号’试管苗干旱处理过程中的转录变化,分别取上述干旱处理时间点的试管苗进行RNA 抽提和转录组测序分析。每个时间点取3 个重复,3 个时间点总共构建并测序了9 个转录组文库。测序获得的原始reads 比对到最新注释的DM1-3 转录本上,并将比对到多个转录本的reads 进行了剔除。主成分分析(Principal component analysis,PCA)显示,‘鄂马铃薯3 号’试管苗干旱处理过程中各个时间点上的重复性较好,并且不同时间点间出现明显分离(图2),说明不同时间点间样品的整体转录差异较大。
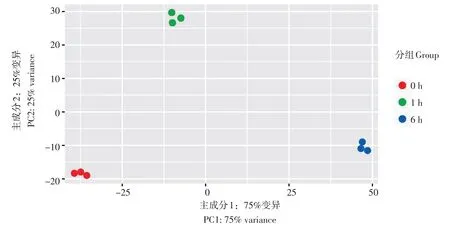
图2 不同干旱处理时间点的转录组数据主成分分析(PCA)Figure 2 Principal component analysis (PAC) for RNA-seq data at different time points under drought stress
2.3 ‘鄂马铃薯3 号’试管苗干旱处理过程中不同时间点的基因差异表达分析
为了鉴定‘鄂马铃薯3 号’试管苗干旱处理过程中不同时间点的差异表达基因(Differentially expressed genes,DEGs),分别对这3 个时间点进行了两两比较,差异基因的阈值设置为FDR <0.01,差异表达倍数超过2,结果如图3所示。1 h vs 0 h、6 h vs 0 h 及 6 h vs 1 h 分别鉴定到 5 315、9 728 和8 606 个差异表达基因,说明随着处理时间的延长,差异基因的数量也进一步增加。其中1 h vs 0 h 和 6 h vs 0 h 共同差异基因为 3 424 个,而所有不同处理间的共有差异基因为1 576 个。
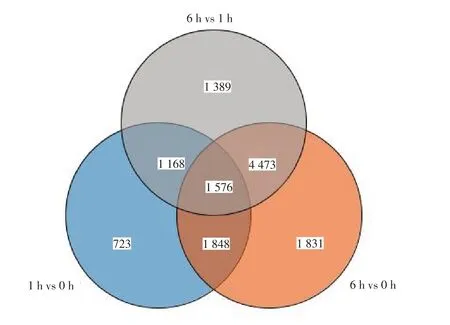
图3 维恩图分析不同干旱处理时间点间的差异基因集Figure 3 Venn diagram analysis of DEG sets among different comparison groups
2.4 ‘鄂马铃薯3 号’试管苗干旱处理过程中不同时间点的top差异基因热图及注释分析
为了揭示每个干旱处理时间点表达差异最大的部分基因,分别在1 h vs 0 h、6 h vs 0 h 及6 h vs 1 h 的差异基因中各选取了10 个上调和下调最为剧烈的基因。去除冗余后一共获得了52 个差异基因,热图聚类及注释如图4 所示。这些基因明显的可以聚为三大类,其中第一类是在处理0 h 时高表达,第二类则为处理6 h 时高表达,第三类为处理1 h 时高表达。其中Soltu.DM.03G035590.1和Soltu.DM.01G031660.1 分别编码两个转录因子GATA transcription factor 和Plant-specific transcription factor YABBY family protein,他们的表达量在干旱处理6 h 后极显著降低,暗示其可能为马铃薯干旱调控的负向因子。在6 h 特异高表达的基因中,包含3 个LEA,而LEA 蛋白被认为是一类干旱胁迫诱导蛋白。此外一个MYB 类的转录因子也在干旱处理6 h 特异高表达,暗示其可能是一个干旱特异诱导的转录因子,可能正向调控马铃薯的抗旱性。
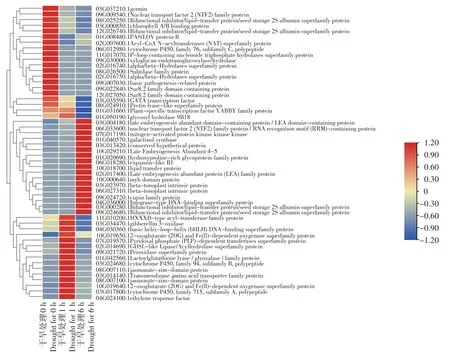
图4 热图分析不同比较组中的上调和下调差异基因TOP10Figure 4 TOP10 up-regulated and down-regulated DEGs as illustrated in heatmap among different comparison groups
2.5 ABA信号途径的相关组分在干旱诱导过程中的表达模式分析
ABA 信号途径被认为是在干旱胁迫过程中起重要作用,根据已发表的文献,分别对已知的参与ABA 途径重要的激酶SnRK2s 家族成员及其下游AREB/ABF/ABI5 类转录因子在马铃薯干旱处理过程中的差异变化进行了探究,结果如表 1 所 示 。 8 个 StSnRK2s 和 7 个 AREB/ABF/ABI5s在1 h vs 0 h 组合中,6 个出现了2 倍以上的表达差异,其中上下调最为剧烈的分别是StSnRK2.1和StABL2。在6 h vs 0 h 组合中,除StSnRK2.2、StSnRK2.5、StABL1 和StABL2,其他基因均出现了两倍以上的上调表达,说明这些ABA 信号途径的相关基因均能受到干旱胁迫的诱导。7 个AREB/ABF/ABI5s 转录因子成员中,StAREB1、StAREB2 和StAREB4 的表达量明显高于其他4个,以StAREB2 的表达量最高,并且在干旱处理过程中的上调最为剧烈,暗示StAREB2 可能是参与干旱胁迫过程中的重要转录因子。而StSnRK2.4 和StSnRK2.8 则为马铃薯干旱胁迫过程中高表达的激酶,且其表达在干旱处理6 h 后均出现超过两倍的上调表达,表明StSnRK2.4 和StSnRK2.8 可能是响应干旱胁迫过程中的重要蛋白激酶。
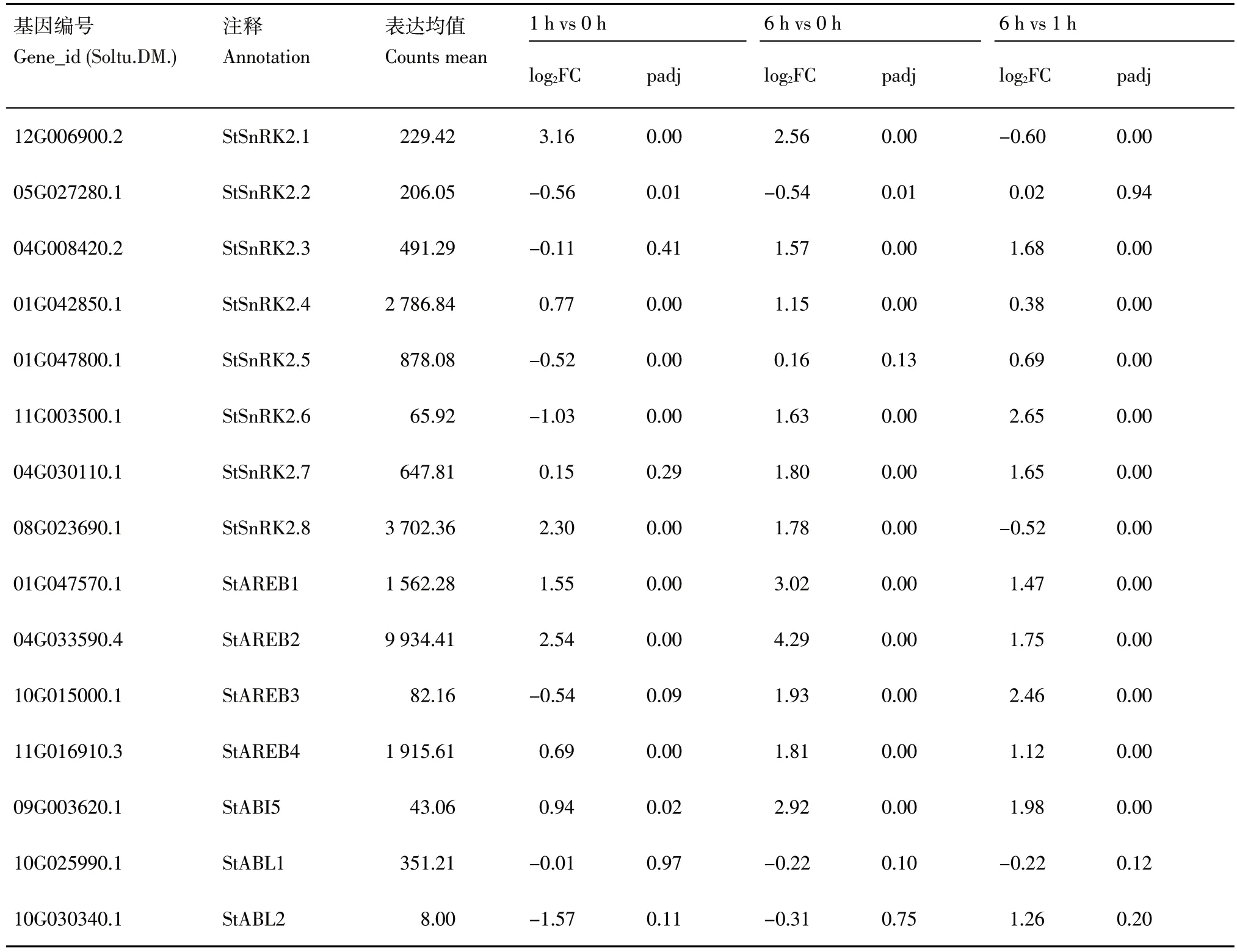
表1 马铃薯ABA信号途径部分基因在不同比较组的表达差异分析Table 1 Differential expression analysis of potato ABA signal pathway-related genes among different comparison groups
3 讨 论
马铃薯通常被认为是干旱敏感性作物,由全球气候变化引起的干旱频发严重威胁了马铃薯的可持续生产。许多研究通过探究马铃薯耐旱性的生理、生化和遗传基础,试图保证马铃薯在干旱胁迫下的产量。马铃薯对干旱的复杂表型反应受其基因型、发育阶段和环境的相互作用影响。因此利用生长条件受到严格控制的组培苗作为材料可以消除一定的干扰。破译马铃薯的干旱应答机制,解析马铃薯干旱应答的核心因子,通过现代基因编辑等手段对这些核心因子进行编辑,实现马铃薯抗旱性的增强对于破解因干旱导致的马铃薯种植限制有着巨大的潜在意义。基于此,本研究以普通马铃薯栽培种为材料,对马铃薯应对干旱的早期响应机制进行了探究。本研究发现利用组培苗为材料可以使得马铃薯在6 h 时即出现明显的干旱胁迫表型(图1),为研究马铃薯的干旱胁迫早期响应提供了参考。
此外本研究还利用高通量转录组测序对马铃薯干旱胁迫早期不同时间进行了转录分析。与前人研究结果类似,马铃薯在应对干旱胁迫时能通过大量的转录调控以适应环境,本研究发现在干旱处理1 及6 h 时,出现两倍差异的基因分别高达5 315 和 9 728 个(图 3)。进一步对 TOP10 差异上调和下调基因分析发现,两个转录因子GATA transcription factor 和Plant-specific transcription factor YABBY family protein 的表达受到干旱的显著抑制(图4),可作为后续目标进行功能验证。此外与前人结果类似,鉴定到3 个受干旱诱导的LEA 蛋白[18,19],其在干旱处理6 h 后高丰度累积,可能是潜在的干旱诱导Marker 基因。MYB 类的转录因子在马铃薯干旱胁迫过程中起重要作用,过表达MYB 转录因子StMYB1R-1 能增强马铃薯抗旱性[20]。本研究同样鉴定到一个MYB domain 蛋白在干旱处理6 h 特异高表达,后续研究也可以通过稳定遗传转化探究其在马铃薯干旱胁迫中的功能。
ABA 在调控植物非生物胁迫方面起着重要作用,Liu 等[21]研究发现,ABA 能调控马铃薯在应对土壤逐步干旱过程中的气孔和光合水分利用效率。Gong 等[8]和 Chen 等[19]通过对马铃薯应对干旱胁迫下的转录组分析,结果均表明干旱胁迫会诱导ABA 信号通路上相关基因的表达。Bai 等[22]在全基因组水平对马铃薯SnRK2s 进行了鉴定和表达模式分析,结果显示马铃薯基因组中存在8 个SnRK2s 成员,部分成员可能参与马铃薯对胁迫的响应。全基因组范围内的序列鉴定和分析发现,马铃薯基因组中有7 个AREB/ABF/ABI5 亚家族成员,其中部分成员能同时响应ABA 和非生物胁迫处理[23]。在此研究中重点探究了这些StSnRK2s 和StAREB/ABF/ABI5s 的表达差异,再次验证蛋白激酶 StSnRK2.4 和 StSnRK2.8 以 及 转 录 因 子StAREB2 可能是ABA 信号通路上响应干旱胁迫过程中的重要组分(表1)。对于这些基因的进一步深入研究将有利于揭示ABA 信号途径在马铃薯干旱胁迫中的重要功能。后续研究通过深入挖掘上述可能的马铃薯应答干旱胁迫的重要基因,解析其作用机制,将有利于加速抗旱种质资源的筛选和抗旱品种的选育进程,对于科学推进中国马铃薯主粮化和主食化产业发展战略具有极其重要的现实意义。
