对加热醋酸钠溶液pH减小的原因探讨
2021-02-18吕旭东
吕旭东
摘要:以数字化实验为手段加热醋酸钠溶液,利用曲线表征pH的变化,再进一步通过符号表征解释变化的原因。
关键词:醋酸钠溶液;水解;pH变化
文章编号:1008-0546(2021)12-0089-01中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2021.12.022
一、問题的提出
高三复习盐类的水解这部分知识时,很多教辅资料上介绍升高温度,醋酸钠水解平衡正向移动,溶液的pH增大,不少学生对此深信不疑,甚至有部分老师在教学中也是凭经验教授知识,未能通过实验进行探究和验证,结果出现了错误的认识。下面,我们采用数字化实验,对升高温度醋酸钠溶液pH变化情况进行探究,并进一步探讨变化的原因,和大家进行交流,以期对今后教学起到参考作用。
二、温度对醋酸钠溶液pH的影响实验
1.实验仪器和药品
实验仪器:烧杯、磁力加热搅拌器、温度传感器(vernier)、pH传感器(vernier)、小磁子、数据采集器、智慧黑板。
实验药品:0.1 mol/LCH3COONa溶液。
2.实验步骤
(1)在小烧杯中放入小磁子,加入约60 mL 0.1 mol/L CH3COONa溶液,按图1安装好实验装置,把温度传感器、pH传感器与数据采集器及智慧黑板连接。

(2)打开Logger Pro软件,点击“采集”按钮,同时测溶液的温度和pH的变化。
(3)打开磁力加热搅拌器的开关对溶液进行搅拌并加热。所得曲线如图2。
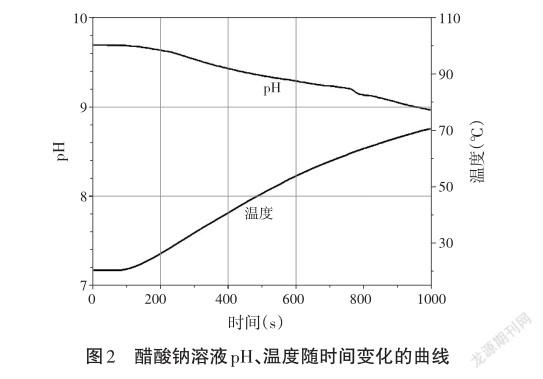
3.实验现象
随着温度的升高,醋酸钠溶液的pH减小。
三、符号表征溶液pH的变化


四、结语
盐类的水解是吸热的,当升高温度时,水解平衡正向移动,导致溶液中的c(OH-)增大,但不能简单的判断溶液中c(H+)就减小的,因为升温时,水的离子积Kw也升高了。所以,巧用已学的平衡常数,利用定性和定量相结合的方法进行处理起到事半功倍的效果。
参考文献
[1][2]北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学(第四版)[M].北京:高等教育出版社,2002:320,409,410
