甜菜BvGSTU9基因的生物信息学及在镉胁迫下的表达分析
2021-02-16周婉婷李佳佳李王胜李思琪王雪倩王录红刘大丽
周婉婷,汪 曼,周 翔,高 卓,3,李佳佳,李王胜,李思琪,王雪倩,王录红,刘大丽
(1国家甜菜种质中期库,黑龙江大学,哈尔滨 150080;2省高校甜菜遗传育种重点实验室/现代农业与生态环境学院,黑龙江大学,哈尔滨 150080;3黑龙江省普通高等学校分子生物学重点实验室/生命科学学院,哈尔滨 150080)
0 引言
镉(Cd)是一种有毒的重金属元素,易被植物根系吸收并富集在植物体中。当镉在植物体内累积到一定程度,便会导致植物体内活性氧(Reactive oxygen species,ROS)大量产生[1],从而影响植物的生长发育,直接或间接影响农作物的产量及质量,并通过食物链富集危害人类健康。
面对重金属污染的土壤,采用传统修复方法成本高耗能大,而将抗逆性较好的能源作物种植于被污染的土壤上,既可以有效利用污染的土地资源,也能一定程度上为生物能源提供原料。甜菜(Beta vulgarisL.)是一种重要的糖料作物。甜菜块根含糖量相对于其他作物较高[2]。20世纪70年代,当美国第一次石油短缺,甜菜育种家们认识到利用蔗糖生物发酵乙醇作为液体燃料时,设想开发仅用于能源生产的甜菜[3]。面对土壤重金属污染现状,甜菜适应非生物胁迫能力较强,通过根际的微生物促进土壤中重金属化合物的分解来提高根对重金属的吸收率,从而提高甜菜对重金属的富集来降低土壤重金属污染程度[4]。因此,甜菜具有生物修复被镉污染土壤的潜在能力[5]。现如今,农业生产收益较低和农业产品价格波动导致农民需求新的经济作物,甜菜作为生物能源和工业糖的原料可以带来经济效益,符合当下农民需求。现今社会对生物燃料的需求不断增加,甜菜产量自然受到关注,非生物性胁迫会降低甜菜产量和质量,因此,甜菜抗逆基因的研究对未来甜菜产量和质量的提高有非常深远的影响。
长期以来的进化使得自然界中各种生物形成了一套代谢有毒物质的解毒酶系统,从而降低了非生物性胁迫对植物体生理生化及正常生长的影响[6]。谷胱甘肽转移酶属于解毒酶系统中一个重要的酶,广泛存在于植物的细胞质基质、线粒体、微粒体中[7]。研究表明,植物GST有多种功能,能够催化谷胱甘肽(GSH)结合过氧化物或络合自由态Cd[8],也能够通过解除活性亲电子复合体来抵御一系列生物和非生物胁迫的伤害[9-10],在抵御ROS对细胞的毒害中发挥重要作用[11]。
现已证实GST广泛存在于原核生物和真核生物中,参与多种有毒代谢产物和外源性化合物的解毒。在20世纪90年代初期,GST基因首先在玉米中被发现[12],此后不断有大量植物GST基因被发掘。植物GST基因的主要功能在于解除外源毒素及内源性有毒代谢物的侵害,催化还原型谷胱甘肽的疏基与多种亲电性和亲脂性底物结合,生成水溶性的化合物,从而降低底物的毒性[13-14]。此外,植物GST还能影响植物生长素和细胞分裂素等植物激素的合成并影响氧化应激和其他刺激,在植物抵抗非生物性胁迫中发挥着重要作用[15]。因此,GST基因常应用于改良植物、提高作物抗逆性等研究[16]。有研究表明不同苎麻品种中,部分BnGST基因受镉胁迫积极响应,判断其与抗镉胁迫机制有关[17]。Kilili等[18]在番茄中,共鉴定出5个同源的Tau类GST,其中Tau类GST参与了广泛的氧化应激反应所涉及的催化和调节功能网络。镉胁迫下水稻GST蛋白质复合体会产生特异性表达,植株通过蛋白质互作提高GSH的含量,在GSTs家族蛋白的作用下,可以有效降低镉对水稻植株的毒害作用[19]。利用生物信息学分析和实时荧光定量PCR技术进行表达分析表明,水稻GST家族基因在植物生长发育和抵御各种生物和非生物胁迫方面发挥着重要作用[20]。
目前,尽管已经证实了植物的镉耐受、积累与GSTs相关,但是其在镉胁迫下精确的作用机制还有待研究,尤其是甜菜BvGSTU9基因的研究较少,可以通过其他植物GST基因的研究结果可以推断出该基因在抵御重金属镉胁迫可以发挥一定作用。因此,本研究以甜菜为研究材料,通过前期生物信息学分析筛选出BvGSTU9基因,运用在线软件进行生物信息学预测,分析该基因氨基酸理化性质、基因结构、组织特异性表达模式,再通过进一步的实时荧光定量PCR分析该基因在镉胁迫下的表达量变化,从而进一步分析BvGSTU9基因在甜菜抵抗重金属胁迫过程中的功能,为将来深入探究GST基因在应答镉胁迫的分子机理中发挥的功能和作用提供科学依据。
1 材料与方法
1.1 实验材料
甜菜品种为‘780016B/12优’,取材于国家甜菜种质资源中期库,于2020年11月—2021年4月进行实验。
1.2 实验设计
根据甜菜BvGSTU9(LOC104894060)基因序列用生物信息学的方法分析蛋白基本性质、结构等。将甜菜在温室中水培,预培养4周后,进行镉胁迫处理。在营养液中加入不同浓度的CdCl2,浓度梯度分别设置为0.1、0.5、1.0 mmol/L,时间梯度分别为0、6、12、24 h,每个处理3次重复。使用实时荧光定量PCR检测该基因的表达情况。
1.3 实验方法
1.3.1 甜菜BvGSTU9生物信息学分析 使用ProtParam(https://web.expasy.org/protparam)分析了蛋白质序列的长度,等电点(pI),平均亲疏水性,蛋白质分子量(MW)和不稳定系数。对甜菜GST蛋白序列利用SMART、NCBI Conserved Domain search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、Pfam(http://pfam.xfam.org/search)分析,采用Blastx搜索其他物种的相似蛋白,并通过Clustalx与MEGA7.0,重新编辑第一列为该序列名称,将文件保存为fasta格式和meg格式。导入meg格式文件,参数设置为默认,使用邻居连接方法构建系统进化树。采用DNAMAN6.0进行氨基酸多序列比对,保存对比结果。
使用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,通过TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜结构域的数目。采用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测BvGSTU9蛋白二级结构;利用SWISS-MODEL(https://swiss model.expasy.org/interac tive)工具预测三级结构。使用Cell-PLoc2.0(http://www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.Cgi)进行亚细胞定位预测分析。
1.3.2 镉胁迫下基因的表达分析 Trizol试剂盒(Invitrogen)提取甜菜叶总的RNA,并反转录成cDNA,利用KOD-PlusNeo高保真酶(TOYOBO)PCR扩增目的基因全长。使用SuperReal PreMix Plus(SYBR Green)荧光定量试剂盒进行qRT-PCR,反应体系为(20 μL):1.0 μL cDNA,10.0 μL 2×SuperReal PreMix Plus,0.4 μL 50×ROX Reference Dye,正反向引物各0.6 μL,7.4 μL ddH2O。qRT-PCR反应程序为:94℃预变性30 s;94℃变性5 s,60℃荧光信号采集30 s,40个循环。检测每份样品的目的基因和内参基因Ct值,3次重复。
1.4 数据处理
使用相对定量2-ΔΔCt方法计算qRT-PCR结果,利用SPSS 19.0软件统计荧光定量PCR试验数据进行差异显著性分析,将分析结果导入Excel进行统计制图。
2 结果与分析
2.1 甜菜BvGSTU9基因生物信息学分析
2.1.1BvGSTU9基因的序列分析 甜菜BvGSTU9基因cDNA全长925 bp,通过NCBI的ORF finder查询得到BvGSTU9的开放阅读框(图1),且用BLAST可以匹配到。结果表明编码区长度为675 bp,翻译的蛋白质有224个氨基酸。对氨基酸的理化性质进行分析,结果表明,该蛋白质分子式为C1187H1826N278O350S6,等电点pI为4.74,消光系数为280 nm,半衰周期在哺乳动物(体外)、酵母(体内)和大肠杆菌(体内)中分别为30、20 h以上和10 h以上。脂肪系数为94.02,不稳定系数为44.75,这些结果表明BvGSTU9是不稳定蛋白质。
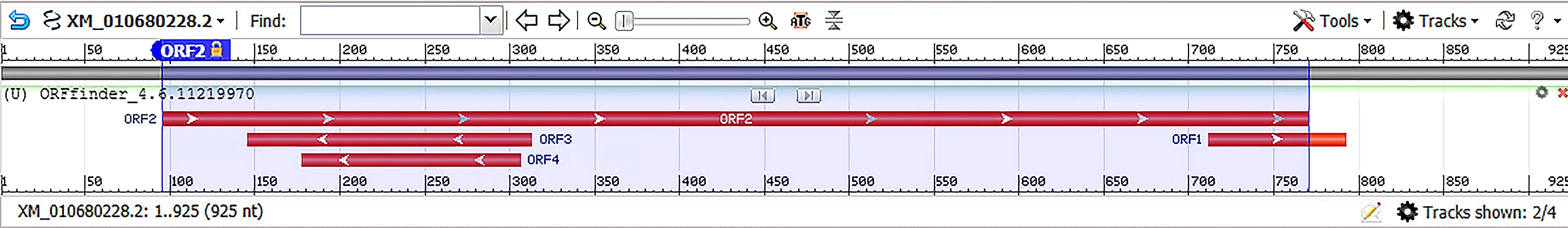
图1 BvGSTU9基因编码框
NCBI Conserved domains分析得出BvGSTU9基因为含有G位点的N末端结构域(蓝色)和含有H位点的C末端结构域(绿色),属于植物Tau类谷胱甘肽转移酶基因家族的成员之一(图2)。
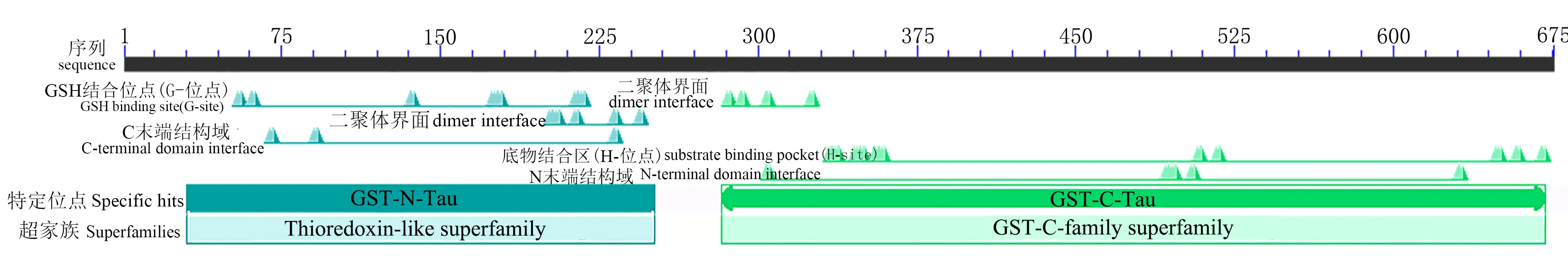
图2 BvGSTU9蛋白保守功能域预测
2.1.2 BvGSTU9蛋白与其他植物GST蛋白的多序列比对和系统进化分析 为了进一步明确BvGSTU9与其他植物GST蛋白之间的进化关系,通过NCBI网站BLAST进行对比,选择类内氨基酸序列同一性大于50%,类间氨基酸序列同源性小于30%[21]进行分析。结果显示BvGSTU9蛋白氨基酸序列与菠菜SoGST(Spinacia oleracea,XM_022004611.1)氨基酸序列相似度为76.60%;与藜麦CqGST(Chenopodium quinoa,XM_021878393.1)氨基酸序列相似度为75.07%。将BvGSTU9的氨基酸序列与藜麦和菠菜GST氨基酸序列进行多序列比对(图3),得到的GST蛋白序列比对的一致性为78.40%,保守结构域较短,且氨基酸相似度较低。有研究表明,不同植物不同类型的GST序列之间的差异还是比较大的。用软件MEGA6.0(邻近法)构建BvGSTU9蛋白与其他16种同源性较高的植物GST蛋白的系统进化树(图4),结果表明,在进化关系中,BvGSTU9蛋白与菠菜最近。
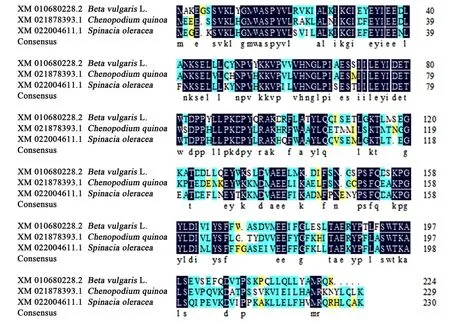
图3 BvGSTU9与其他植物GST的氨基酸序列比对
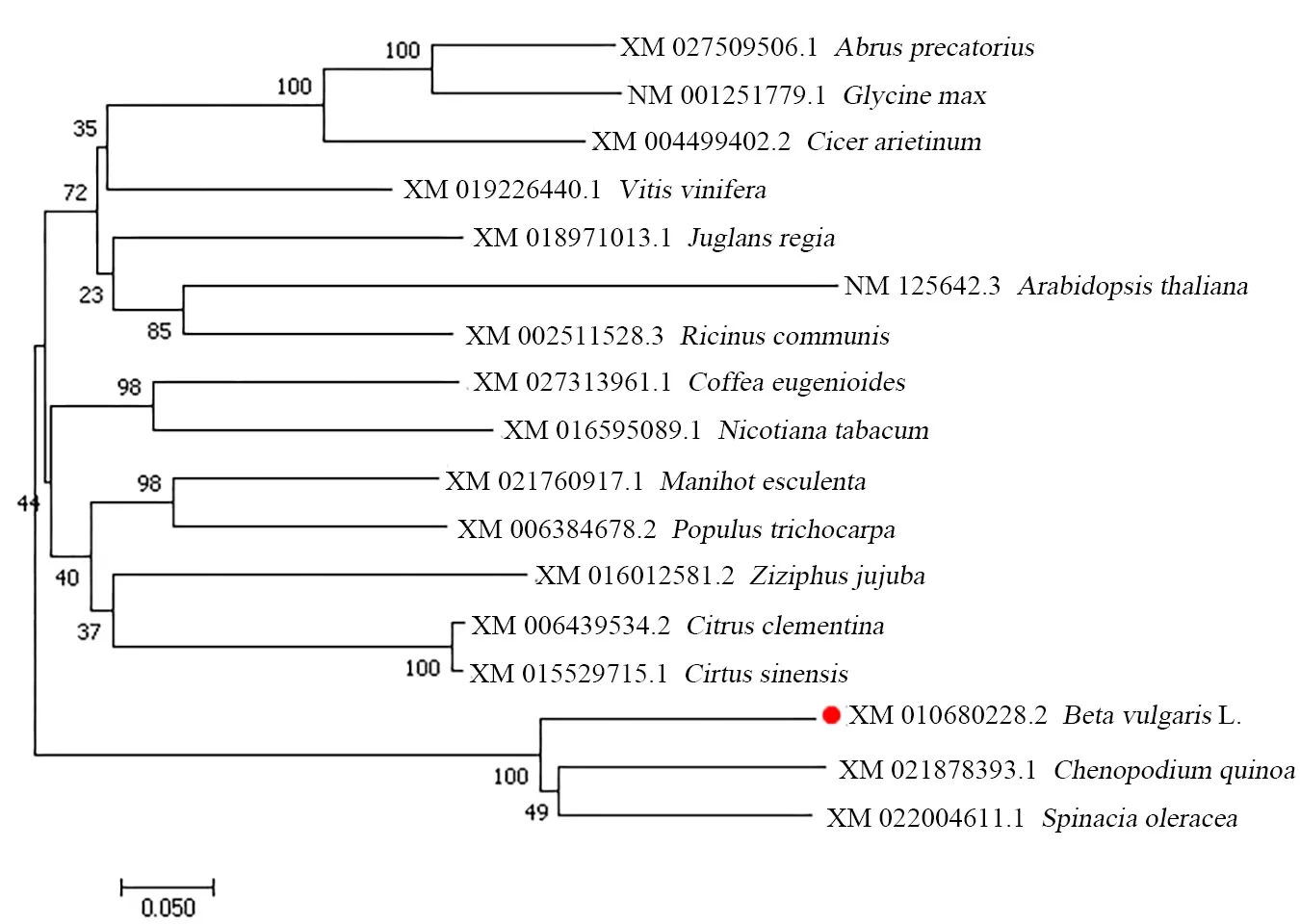
图4 BvGSTU9和其他植物中GSTs蛋白的系统进化树
2.1.3 甜菜BvGSTU9基因结构分析 外显子/内含子的分布结构在某些基因家族进化中起着重要作用。本研究对甜菜BvGSTU9基因和其他16种植物的GSTs进行基因结构分析(图5)。由图可知,大多数基因都含有2个外显子和内含子,同时也有2个基因(CsGSTU9-like,MeGSTU10)不具有UTR结构。BvGSTU9基因外显子/内含子结构与CqGSTU9-like基因,JrGSTU9-like基因非常相似,推断其功能可能存在相似之处。

图5 甜菜BvGSTU9基因进化树和其他植物GST基因结构
2.1.4 跨膜结构、信号肽预测和亚细胞定位 使用软件TMHMM 2.0对甜菜BvGSTU9蛋白的跨膜结构域进行预测。结果表明,BvGSTU9既不存在跨膜结构域,也未发现膜内的氨基酸序列,为膜外非膜蛋白。信号肽序列分析表明,甜菜BvGSTU9蛋白无信号肽,并且不存在剪切位点。由此推测,甜菜BvGSTU9蛋白为非分泌型蛋白,可能不进行蛋白质转运,直接在细胞质基质中起作用。使用Cell-PLoc2.0对甜菜BvGSTU9进行亚细胞定位预测,结果显示,其生命活动的主要场所为细胞质。综合以上结果分析,可以推测出甜菜BvGSTU9蛋白在游离核糖体上合成蛋白多肽,然后由引导肽将蛋白质导向靶位点,然后基本上在细胞质中发挥作用。
2.1.5 蛋白疏水性/亲水性分析 如图6所示,通过PROTSCALE来预测BvGSTU9蛋白的疏水系数。结果表明,其亲水性最强值为-2.70;疏水性最强值为2.35,亲水平均值为-0.246。总体来看,该蛋白亲水性表现较强,为亲水蛋白。
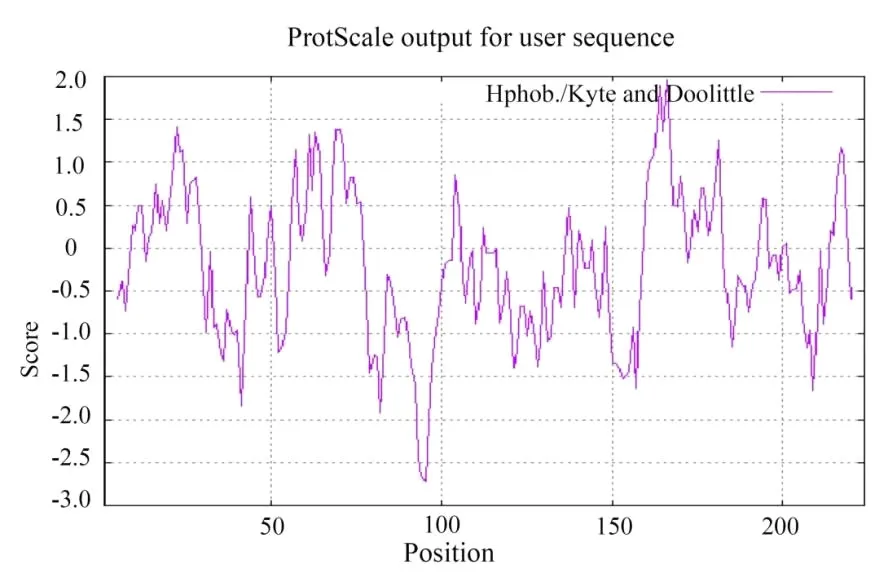
图6 BvGSTU9蛋白的亲疏水性
2.1.6 甜菜BvGSTU9蛋白二级和三级结构预测 根据SOPMA预测二级结构(图7),结构表明该蛋白质主要由α-螺旋、β-折叠、无规则卷曲、和延伸链组成,其中α-螺旋占50.45%,β-折叠为5.36%,无规则卷曲为27.68%,延伸链为16.52%。将甜菜BvGSTU9的氨基酸序列提交到SWISSMODEL在线软件,采用同源建模法,预测该蛋白的三级结构(图8)。结果显示,该蛋白的三级结构主要由α-螺旋、无规则卷曲、折叠结构构成,与二级结构预测结果基本一致。
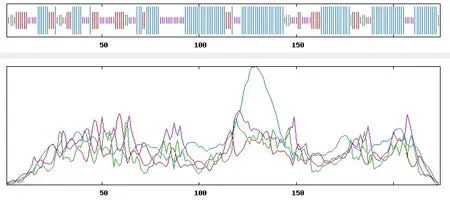
图7 甜菜BvGSTU9蛋白的二级结构预测
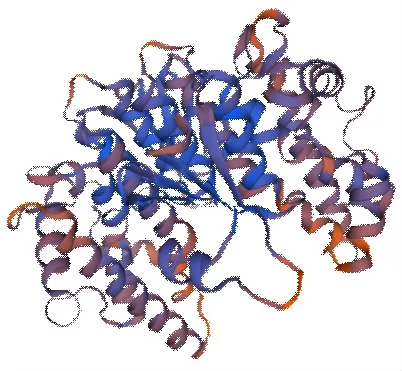
图8 甜菜BvGSTU9蛋白的三级结构预测
2.2 镉胁迫下甜菜BvGSTU9基因的表达分析
实时荧光定量PCR检测结果显示,甜菜BvGSTU9基因在未受镉胁迫植株中表达量较低。0.1 mmol/L和0.5 mmol/L镉胁迫后,BvGSTU9基因相对表达量明显升高,在处理12 h时达到最大值,相对表达量较0 h上升了4倍左右,之后表达量下降。镉胁迫处理浓度为1.0 mmol/L时,相对表达量在12 h最高,到24 h时相对表达量已经低于对照(图9)。这说明该基因与镉胁迫存在着一定的应答关系。
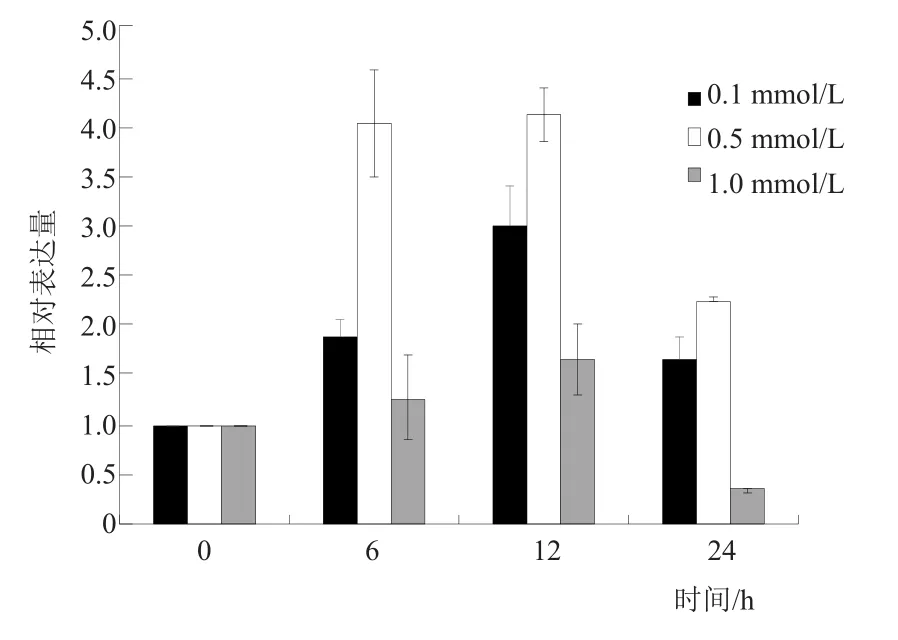
图9 甜菜BvGSTU9基因在不同浓度、不同时间梯度下的表达分析
3 讨论与结论
在重金属的胁迫下,植物体对所需离子的吸收、运输、渗透和调节等过程会受到影响,从而影响细胞代谢,导致植物生长发育受阻。而植物GST基因在植物耐逆性发挥重要作用,该基因在非生物胁迫条件下被诱导表达,同时参与植物细胞的外源性解毒与内源性代谢,并发挥谷胱甘肽过氧化物酶的作用,催化GSH与有害物质的结合,最终解除外源有害物质对细胞的损害[22]。Tripathi等[23]鉴定了水稻中的两种谷胱甘肽转移酶,它们在根部表达较为明显,有助于镉离子的封存。Srivastava等[24]在前人的研究基础上,将拟南芥中的OSGSTU30进行转化,结果显示该基因在应对镉逆境胁迫和干旱胁迫可以发挥作用。戚元成等[25]从盐地碱蓬中克隆并转化拟南芥,转基因拟南芥在非生物性胁迫下GST基因过量表达,GST基因的过量表达能使盐胁迫下转基因拟南芥正常生长。王景荣等[26]对甜瓜CmGST基因进行了生物信息学分析,同时在离子毒害时对CmGST基因的活性进行表达量检测,结果证明,CmGST基因参与了对根系分泌物介导的自毒胁迫响应。可见,GST在植物响应生物逆境胁迫中发挥重要作用。
此外,植物GSTs的相对表达量和各种非生物性胁迫的应对密切相关[27],其中,含有Tau保守结构域的GST亚家族基因,参与植物众多的非生物性胁迫响应。在前期对能源甜菜镉逆境胁迫的转录组测序研究中,发现BvGSTU9基因积极响应镉胁迫且显著性相对较高。本研究以能源甜菜为材料,通过生物信息学分析结果显示BvGSTU9基因属于Tau类GST基因家族。该基因全长925 bp,开放阅读框全长675 bp,该基因所表达的蛋白质有224个氨基酸,与菠菜和藜麦GST蛋白的氨基酸序列相似度最高,其原因可能是这些植物同属于藜科,推测其有相似的功能。Edwards等[28]研究结果中提到大多数GST基因定位于细胞质,少部分定位于细胞核,BvGSTU9基因亚细胞定位于细胞质,与其结论一致。前期实验中,通过克隆和大肠杆菌体外重组表达甜菜目的基因BvGST,发现该基因可以在一定程度上提高宿主菌在镉逆境下的生存率,并且过量表达的BvGST蛋白的酶活性被进一步的诱导调控,从而提高了植株对非生物胁迫的耐受力[29]。为了进一步研究甜菜BvGST基因在镉逆境胁迫下的相对表达量变化情况,本研究用0.1、0.5、1.0 mmol/L的CdCl2处理后的甜菜进行实时荧光定量PCR来检测相对表达量的变化。实验结果显示,在不同浓度的镉胁迫处理条件下,均能诱导甜菜BvGSTU9基因表达上调,与以往研究结果基本一致。在相同处理时间条件下,CdCl2浓度为0.5 mmol/L时该基因的相对表达量达到最高值。随着处理时间的增加,相对表达量整体呈现出先增加后减少的趋势。由此推断,甜菜BvGST基因可能参与应对镉胁迫,并在镉逆境胁迫下发挥着重要的作用。
总之,本研究通过对甜菜BvGSTU9基因的生物信息学分析以及镉逆境胁迫下的表达分析,结合以往的报道揭示了甜菜BvGSTU9基因在应对镉胁迫下可能响应胁迫,证明了BvGSTU9基因是甜菜抗镉胁迫重要的响应基因。目前,已经有较多关于GST生理生化活性与植物抗性的研究报道,不同类型的GST基因已被克隆并成功转化到多种植物中,但是以甜菜为研究对象的研究并不是很充分,在今后的研究中需要深入了解其解毒机制,这对于缓解重金属污染现状以及提高甜菜产量和质量的研究和进一步对BvGST基因进行研究奠定基础。
