OCTA在区分高度近视合并早期青光眼和生理性大视杯中的应用
2021-02-16欧阳君怡聂芬周丹刘艳红郭殷杰周灯明段宣初
欧阳君怡 聂芬 周丹 刘艳红 郭殷杰 周灯明 段宣初
作者单位:1中南大学爱尔眼科学院,长沙 410015;2长沙爱尔眼科医院 爱尔青光眼研究所 410015;3中南大学湘雅二医院眼科,长沙 410011
近年来,近视尤其是高度近视已被公认为原发性开角型青光眼(POAG)的危险因素,大量的临床研究也证实了青光眼与高度近视间的密切关系[1,2]。POAG的早期眼底表现与高度近视相似,视盘发生改变,杯盘比增大或颞侧盘沿变窄甚至消失。青光眼是常见的不可逆性致盲眼病,早期发现与早期治疗非常重要。目前临床上普遍认为,杯盘比的扩大是开角型青光眼早期诊断的一个有价值线索,但是大杯盘比并不是开角型青光眼独有的临床特征,人群中存在一定量的生理性大视杯(Large physiological optic disc cup,LPC)[3]。频域OCT在分辨LPC与早期青光眼性扩大的杯盘比的效能是有限的[4]。新近出现的无创性光学相干断层扫描眼底血流成像技术(Optical coherence tomography angiography,OCTA),可对黄斑和视盘的微血管系统进行评估,可重复性高,可用于监测青光眼等疾病的进展[5,6]。近年来已有很多研究者将OCTA用于青光眼及高度近视的诊断与随访,证明OCTA可以用于青光眼的早期诊断及观察高度近视视网膜血管的变化[7-10]。临床上,高度近视合并青光眼,容易漏诊与误诊,甚至失去早期治疗的机会。基于此,本研究采用OCTA比较高度近视合并早期POAG和高度近视合并LPC的视网膜神经纤维层(Retinal nerve fiber layer,RNFL)厚度、黄斑区神经节细胞复合体(Ganglion cell complex,GCC)厚度、黄斑区及视盘区的血管密度,期望为高度近视眼的LPC或早期青光眼性损害的诊断提供依据。
1 对象与方法
1.1 对象
选择2019年1 ─12月在长沙爱尔眼科医院青光眼专科及屈光专科就诊的高度近视合并早期POAG或LPC患者共25例(42眼)。本研究经长沙爱尔眼科医院伦理委员会批准,批号:长爱伦审字(2019)KYPJ001。在研究前获得所有受试者的知情同意,并遵守赫尔辛基宣言的原则。临床试验注册号为ChiCTR1900021369。若双眼符合纳入标准则双眼纳入研究,其中高度近视眼合并LPC 12例(22眼)作为LPC组,高度近视合并早期POAG 13例(20眼)作为POAG组,另随机选取本院年龄相匹配的非高度近视者8例(16眼)为对照组。
LPC组纳入标准:①眼轴长度(Axis length,AL)>26 mm或等效球镜度(SE)<-6 D;②眼压<21 mmHg(1 mmHg=0.133 kPa);③2位青光眼专科主任医师同时诊断垂直杯盘比大于0.6;④在至少12个月的随访中,没有证据表明有视神经病变或视野缺损(眼底和视野检查,每年至少2次)。
POAG组纳入标准:①诊断标准符合我国原发性青光眼诊断治疗专家共识(2014版)[11];②AL>26 mm或SE<-6 D;③按照H-P-A视野分级方法[6],早期视野缺损定义为视野平均缺损(Mean defect,MD)<-6 dB;④视野检查(Humphrey 750,德国蔡司公司),选用中央24-2阈值测定,当固视丢失率<10%,当假阳性率及假阴性率均<10%认为检查结果可靠。
对照组纳入标准:①年龄、性别与LPC组相匹配的低、中度近视患者;②AL<26 mm或SE>-6 D;③除屈光不正外,无其他眼部疾病。
排除标准:①年龄小于18岁或大于80岁;②房角镜检查房角关闭和(或)明显色素沉着;③任何视网膜或黄斑病变;④任何屈光介质混浊;⑤任何全身或神经系统疾病产生的视野缺损;⑥内眼手术史(除外单纯白内障手术)或玻璃体、视网膜、脉络膜或视神经性疾病;⑦OCTA图像质量差。
1.2 检查方法
1.2.1 一般眼科检查 对所有受试者进行全面的眼科检查,包括视力、主觉验光(RT-5100,日本尼德克)、电脑验光仪(ARK-1,日本尼德克)、眼压测量(Goldman压平眼压计,瑞士Haag-Streit集团)、裂隙灯显微镜及前置镜、视野检查(Humphrey 750,德国蔡司公司)、AL(IOLMaster 700,德国蔡司公司)、房角镜(OMVG200,美国Ocular公司)检查等。
1.2.2 OCTA图像获取与分析 使用美国光视AngioVue(RTVue-XR Avanti,版本2017.1.0,美国OptoVue公司)测量不同区域RNFL厚度及不同层次的血管密度分析值。AngioVue仪器拥有OCT的全部功能,通过机器自带的软件计算得到视网膜血流密度值、视盘旁2~4 mm直径环神经纤维层厚度值。视盘和黄斑扫描分别采用4.5 mm×4.5 mm和6 mm×6 mm模式。平均RNFL厚度测量范围为直径3.45 mm的圆,圆心位于视盘中心;GCC厚度测量范围为以中心凹为中心的7 mm×7 mm扫描区域。视盘旁各方向的血管密度及RNFL厚度按照改良Garway-Heath(GH)方法,将视盘周围分为8个区(见图1),分别为上方鼻侧(Superior nasal,SN)、上方颞侧(Superior temporal ST)、颞侧上方(Temporalsuperior,TS)、鼻侧上方(Nasal superior,NS)、颞侧下方(Temporal inferior,TI)、下方颞侧(Inferior temporal,IT)、下方鼻侧(Inferior nasal,IN)、鼻侧下方(Nasal inferior,NI)。视盘周围放射状毛细血管网(Radial peripapillary capillaries,RPC)层为从视盘边界延伸的700 μm宽的椭圆环,主要分区有全像血管密度、全像毛细血管密度、视盘内全部血管密度、视盘内毛细血管密度、视盘旁血管密度、全像上半部分血管密度、全像下半部分血管密度、视盘旁毛细血管密度、全像上半部分毛细血管密度、全像下半部分毛细血管密度、鼻侧上方毛细血管密度、鼻侧下方毛细血管密度、下方鼻侧毛细血管密度、下方颞侧毛细血管密度、颞侧下方毛细血管密度、颞侧上方毛细血管没丢、上方颞侧毛细血管密度。视网膜浅层(Layer1,L1)毛细血管层是指内界膜下3 μm到内丛状层下15 μm,视网膜深层(Layer2,L2)毛细血管层是内丛状层下15 μm延伸到内丛状层下70 μm。黄斑区以黄斑中心凹为中心分成3个圆环,中心圆为黄斑中心凹,旁中心凹区域为>1~3 mm的半径环,最外面的环为中心凹周边区域>3~6 mm包含6 mm的半径环,旁中心凹区域及中心凹周边区域又分鼻侧(N)、颞侧(T)、上侧(S)、下侧(I)以及上半、下半,主要分区有全像血管密度、上半部分血管密度、下半部分毛细血管密度、中心凹血管密度、旁中心凹血管密度、旁中心凹上半部分血管密度、旁中心凹下半部分血管密度、旁中心凹颞侧血管密度、旁中心凹上方血管密度、旁中心凹鼻侧血管密度、旁中心凹下方血管密度、中心凹周边区域血管密度、中心凹周边区域上半部分血管密度、中心凹周边区域下半部分血管密度、中心凹周边区域颞侧血管密度、中心凹周边区域上方血管密度、中心凹周边区域鼻侧血管密度、中心凹周边区域下方血管密(见图1)。
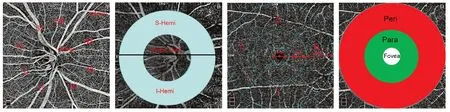
图1.视盘、视盘旁及黄斑各种分区示意图A:视盘、视盘旁分区;B:视盘旁区域(灰色环形区域),黑线把视盘旁区域划分为上半部及下半部;C:黄斑部国际早期糖尿病视网膜病变治疗研究分区;D:黄斑旁中心凹区域(绿色),黄斑中心凹周边区域(红色),中心凹区域(白色)Figure 1.Disc,peripapillary and macular regions.A:Disc and peripapillary regions.B:Peripapillary region (gray ring area).C:Macular early treatment diabetic retinopathy study region; D:Parafoveal region(green area),perifoveal region (red area),foveal region (white area).
1.3 统计学方法
病例对照研究。使用SPSS 22.0进行统计分析。对于符合正态分布的参数,计算其平均值,以均数±标准差表示。采用单因素方差分析(ANOVA)比较3组患者的视盘周围区域RNFL厚度、平均GCC厚度及视盘、视盘旁和黄斑区血管参数,采用LSD多重比较进行两两比较。采用线性混合模型调整年龄对各变量的影响。使用Pearson相关性确定研究人群中RNFL厚度和视盘旁血管密度变量之间的相关性。ROC曲线分析各OCTA参数的青光眼诊断能力。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
3组患者年龄、眼压差异有统计学意义(F=11.7,P<0.001;F=7.7,P<0.001),进一步两两比较显示POAG组年龄大于LPC和对照组,差异均有统计学意义(均P<0.001),LPC组与对照组年龄差异无统计学意义(t=1.05,P=0.5)。POAG组眼压大于LPC组和对照组,差异均有统计学意义(均P<0.05);LPC组和对照组眼压差异无统计学意义(t=0.76,P=0.5)。3组AL、屈光度数、杯盘比总体差异均有统计学意义(F=27.3,P<0.001;F=20.4,P<0.001;F=20.3,P<0.001),进一步两两比较显示,对照组AL小于LPC组及POAG组,差异均有统计学意义(均P<0.05),LPC组与POAG组AL差异无统计学意义(t=1.75,P=0.1);对照组屈光度数小于LPC组及POAG组,差异均有统计学意义(均P<0.001),LPC组与POAG组屈光度数差异无统计学意义(t=0.78,P=0.4);对照组杯盘比小于LPC组及POAG组,差异均有统计学意义(均P<0.001),LPC组与POAG组杯盘比差异无统计学意义(t=1.61,P=0.1)。见表1。
2.2 RNFL和GCC厚度比较
与对照组比较,LPC组、POAG组各分区RNFL厚度(除TI区域外)平均值及RNFL厚度平均值逐渐降低,其中TS、ST、SN、IN、IT区域平均RNFL厚度总体差异均有统计学意义(F=3.2,P=0.05;F=13.2,P<0.001;F=9.4,P<0.001;F=15.7,P<0.001;F=13.5,P<0.001),进一步两两比较显示,对照组与LPC组在SN、IN区域RNFL厚度值差异有统计学意义(均P<0.001);对照组与POAG组在TS、ST、SN、IN、IT区域RNFL厚度值及平均RNFL厚度值差异有统计学意义(均P<0.001);POAG组与LPC组在ST、SN、IT、TI区域RNFL厚度值及平均RNFL值差异有统计学意义(均P<0.05)。3组GCC厚度平均值比较差异无统计学意义(F=1.8,P=0.2)。见表2。
2.3 视盘及视盘周围区域RPC层血管密度分析
与对照组比较,LPC组和POAG组的全像血管密度、视盘内全部血管密度、视盘旁血管密度、视盘旁毛细血管密度分区血管密度平均值均呈下降趋势,且3组间这些指标的血管密度平均值总体差异均有统计学意义(F=29.4,P<0.001;F=6.5,P<0.001;F=30.5,P<0.001;F=16.1,P<0.001)。进一步两两比较显示,对照组与LPC组视盘及视盘旁RPC层血管密度值差异均无统计学意义(均P>0.05),对照组与POAG组血管密度值差异除视盘内毛细血管密度分区外均有统计学意义(均P<0.05);LPC组与POAG组血管密度值差异在全像血管密度、全像毛细血管密度、视盘旁全部血管密度、视盘旁毛细血管密度分区均有统计学意义(均P<0.05)。见表3。

表1.3 组一般临床资料比较Table 1.Characteristic of three groups
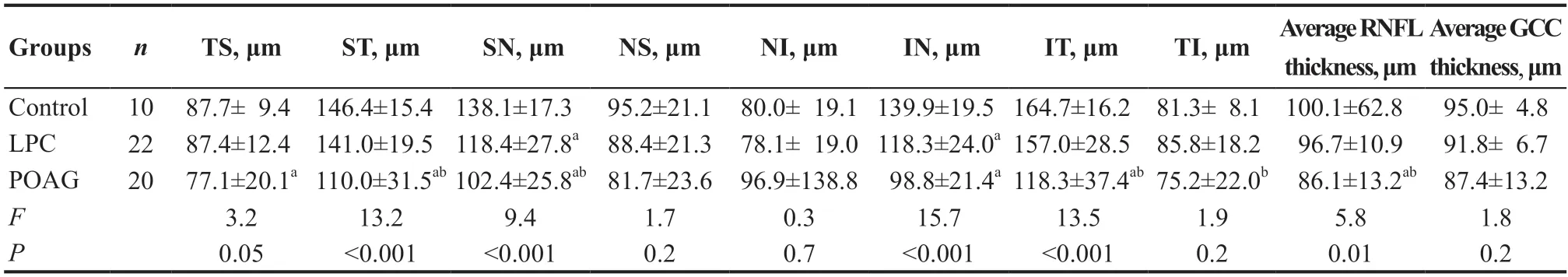
表2.3 组视盘旁各区域平均视网膜神经纤维层厚度、平均神经节细胞层厚度比较Table 2.Differences of RNFL thickness parameters in three groups

表3.3 组视盘及视盘周围放射状毛细血管网层各分区血管密度比较Table 3.Differences of disc and peripapillary disc VD parameters in three groups
2.4 黄斑区血管密度分析
与对照组比较,LPC组、POAG组黄斑区几乎所有浅层及深层各分区血管密度平均值均有下降趋势,3组比较除L1层中心凹及旁中心凹上方分区外其余各分区血管密度平均值总体差异均有统计学意义(均P<0.05)。进一步两两比较显示,对照组在L2层的全像血管密度、旁中心凹血管密度、中心凹周边区域血管密度、中心凹周边区域鼻侧血管密度平均值高于LPC组,且差异均有统计学意义(均P<0.05);对照组除L1及L2层的中心凹分区外其他分区血管密度平均值都高于POAG组,且差异均有统计学意义(均P<0.05);POAG组在L1层的全像血管密度、中心凹周边区域血管密度、中心凹周边区域颞侧血管密度、中心凹周边区域上方血管密度、中心凹周边区域下方血管密度值低于LPC组,且差异均有统计学意义(均P<0.05)。见表4─5。
2.5 OCTA参数AUC值
对比各参数在POAG组与LPC组间诊断效能发现:RNFL厚度ROC曲线下面积(Area under the relative ROC curves,AUC)在IT区域最高(0.78,95%CI:0.64~0.93),而其他区域诊断能力AUC在0.60~0.78之间;平均RNFL厚度AUC(0.72,95%CI:0.56~0.88)比平均GCC厚度值AUC(0.60,95%CI:0.42~0.78)高;视盘内及视盘旁血管密度AUC为视盘旁毛细血管密度最高(0.90,95%CI:0.80~0.99),而其他区域AUC在0.73~0.89之间;黄斑各区域毛细血管密度AUC中浅层中心凹周围下方毛细血管密度最高(0.83,95%CI:0.68~0.95),而其他区域AUC在0.517~0.815之间。黄斑处浅层毛细血管密度AUC(0.74±0.65)平均值比黄斑处深层毛细血管密度AUC(0.61±0.37)平均值高,且AUC值差异有统计学意义(F=8.32,P<0.001)。见表6─7和图2。
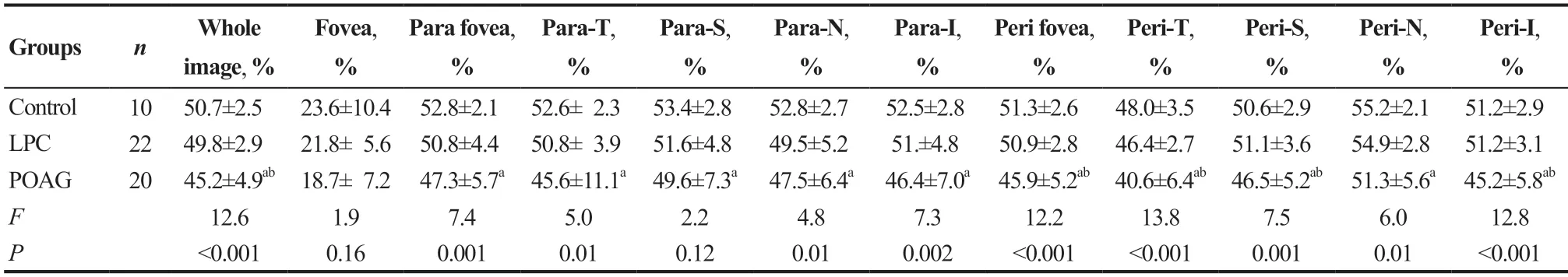
表4.对照组、生理性大视杯组、POAG组黄斑区浅层血流密度比较Table 4.Differences of superficial macular VD parameters in control,POAG and LPC group
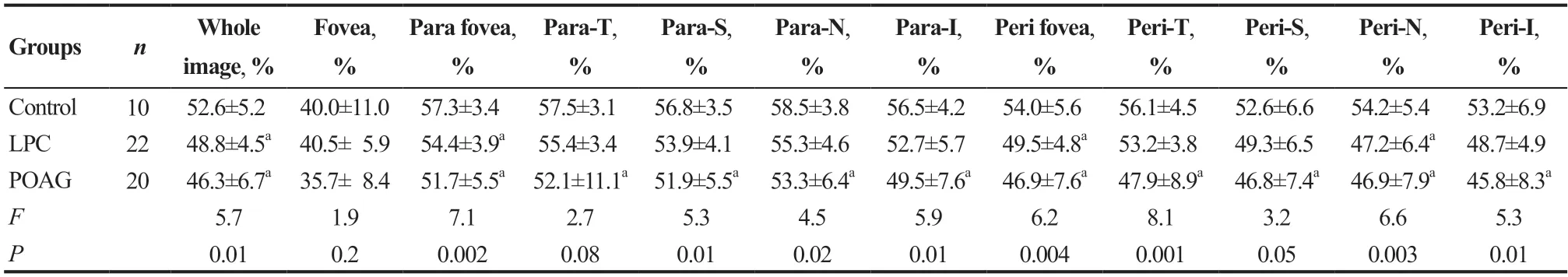
表5.对照组、POAG组、LPC组黄斑区深层血流密度比较Table 5.Differences of deep macular VD parameters in control,LPC and POAG groups
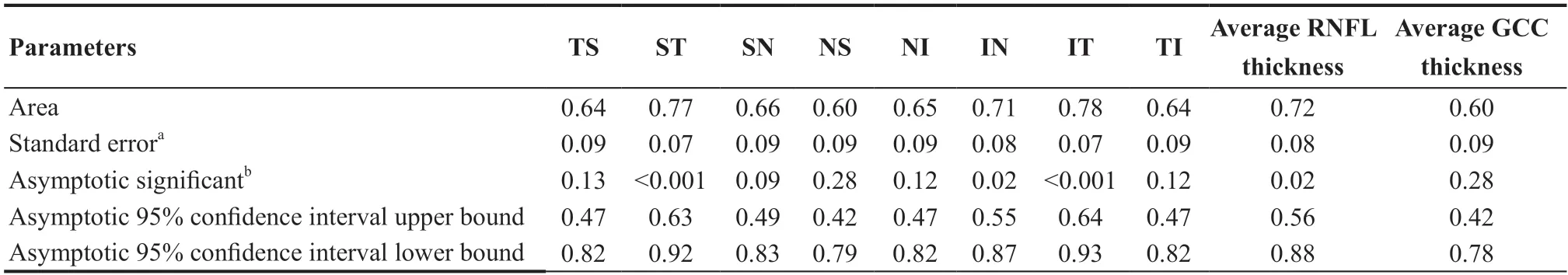
表6.生理性大视杯组(22眼)与POAG组(20眼)间视盘旁各区域平均视网膜神经纤维层厚度和神经节细胞层参数的曲线下面积分析Table 6.AUC analysis for RNFL thickness parameters between POAG group (20 eyes) and LPC group (22 eyes)
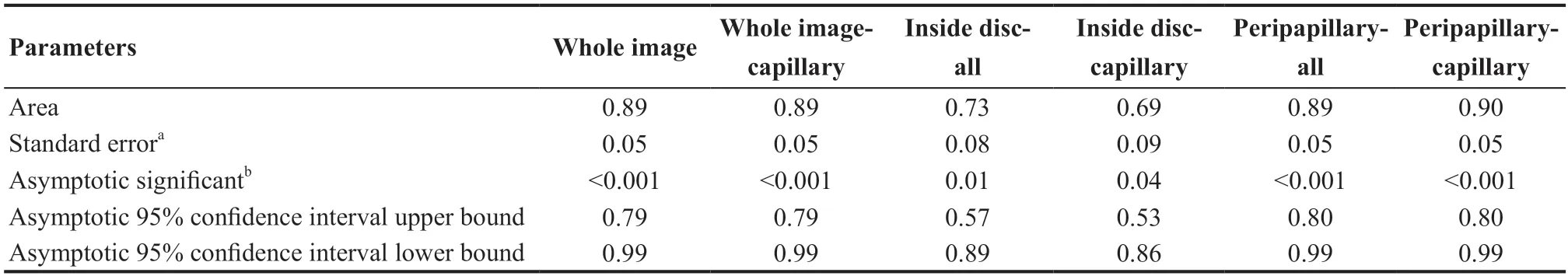
表7.生理性大视杯组(22眼)与POAG组(20眼)间视盘及视盘旁各分区血管密度参数的曲线下面积分析Table 7.AUC analysis for disc and peripapillary disc VD parameters between POAG group (20 eyes) and LPC group (22 eyes)

表8.生理性大视杯组(22眼)与POAG组(20眼)间黄斑中心各分区血管密度参数的曲线下面积分析Table 8.AUC analysis for macular VD parameters between POAG group (20 eyes) and LPC group (22 eyes)
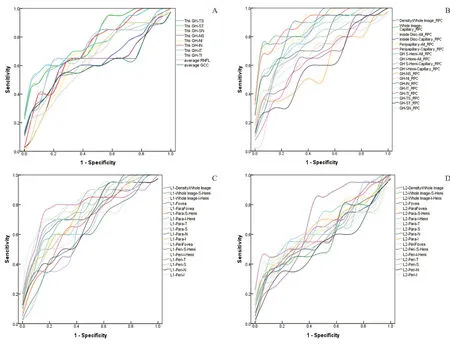
图2 生理性大视杯组与POAG组间各参数ROC曲线图A:视盘旁改良GH分区RNFL厚度参数ROC曲线图;B:视盘及视盘旁各分区血管密度参数ROC曲线图;C:黄斑浅层各分区血管密度参数ROC曲线图;D:黄斑深层各分区血管密度参数ROC曲线图Figure 2.ROC curves of the parameters between the POAG and LPC groups.A:ROC curves of the peripapillary disc RNFL thickness parameters.B:ROC curves of the disc and peripapillary disc VD parameters.C:ROC curves of the superficial macular VD parameters.D:ROC curves of the deep macular VD parameters.POAG,primary open-angle glaucoma; LPC, large physiological optic disc cup; RNFL, retinal nervous fiber layer; VD, vessel density; ROC,receiver operating characteristic curve.
2.6 Pearson相关性分析
对3组所有视盘旁改良GH分区血管密度与RNFL厚度进行Pearson相关分析显示:TS、SN、IN各分区血管密度与RNFL厚度呈正相关(r=0.36,P=0.003;r=0.34,P=0.006;r=0.394,P=0.001);IT、TI、ST、NS、NI各分区血管密度与RNFL厚度呈正相关(r=0.56、0.40、0.52、0.43、0.49,均P<0.001)。
3 讨论
青光眼是一种常见的不可逆性致盲眼病,临床上若杯盘比大于0.6,首先要考虑是否为青光眼。根据2014版我国原发性青光眼诊断治疗专家共识[11],典型的青光眼性视盘改变表现为视杯扩大及加深、颜色苍白,盘沿缺损等。杯盘比扩大在开角型青光眼的诊断上是一个有价值的线索,但是大视杯不是开角型青光眼所独有的临床特征,不能排除生理性的大视杯。随着开角型青光眼的进展,视盘周围有视网膜色素上皮和脉络膜萎缩——即“青光眼晕”,但在高度近视眼中,随着AL的增长,也会形成近视弧等萎缩灶,一部分高度近视眼还会存在盘沿缺损等情况,视盘的变化也不是青光眼所独有的临床症状,高度近视眼中也可出现。所以,当高度近视患者同时合并大视杯时的鉴别诊断就变得非常困难。
据2018年11月18日中南大学爱尔眼科学院与中华医学会眼科学分会视光学组联合发布的《中国青少年用眼行为大数据报告》指出,目前我国100例高度近视患者中至少有1例患者会因高度近视而致盲。这些年来,高度近视作为POAG的危险因素已经被大量的人口统计学眼病调查所证实:如北京眼病研究发现高度近视(-6 D以上)患者青光眼患病率为10.7%,约为正视的4倍[12],在1项2008~2011年韩国全国健康与营养的调查中采用分层抽样方法抽取12 433名韩国人,其中中、高度近视患者青光眼患病率为正视的4.6倍[13],说明高度近视眼中青光眼的筛查变得非常重要,OCTA作为新的无创性眼底血管成像设备,能得到高效可重复的数据,对早期开角型青光眼的诊断意义重大。
既往的研究表明,使用OCTA观察到POAG中黄斑区及视盘区的血管密度明显低于健康眼,并且具有良好的辨别能力[14,15]。Lee等[10]发现OCTA可以用于高度近视合并开角型青光眼的诊断,但是纳入研究的患者为非晚期患者,还不能完全用于高度近视合并早期POAG的诊断。在本研究中,POAG组均为早期青光眼患者,高度近视合并早期POAG眼的视盘旁血管密度值低于高度近视合并LPC,且视盘旁血管密度的AUC值比视盘内血管密度的AUC值更高,与Yarmohammadi等[16]的研究结果一致,另外我们发现视盘旁毛细血管密度是所有OCTA参数中诊断效能最高的,视盘旁改良GH分区下方鼻侧血管密度AUC值达到0.82,为最佳的AUC参数,也大于改良GH分区下方颞侧RNFL厚度的AUC值(0.78),说明血管密度比RNFL厚度有更好的诊断早期青光眼的能力,与Bekkers等[17]研究中发现一致,即视盘旁血管密度参数可以用来鉴别高度近视合并早期POAG或高度近视合并LPC。
黄斑处深层血管信号受OCTA本身无法避免的伪影的影响,既往研究认为黄斑区浅层血管密度的意义比深层血管密度的意义更大[18]。但本研究发现,高度近视合并LPC眼与非高度近视黄斑区深层毛细血管密度有差异,而高度近视LPC眼与高度近视早期POAG患眼深层毛细血管密度无明显差异,认为深层视网膜比浅层视网膜受AL的影响更大,所以高度近视眼深层毛细血管降低会更明显。高度近视合并早期POAG眼黄斑浅层毛细血管密度低于高度近视合并LPC眼,且黄斑区浅层血管血流密度比深层血管密度有更好的诊断效能,与Xu等[19]研究一致。因此,可以使用黄斑区浅层毛细血管密度来鉴别高度近视合并早期POAG眼及高度近视合并LPC眼。
众多研究发现OCT检查对于青光眼早期诊断具有中度的敏感性和高度的特异性[20]。本研究显示下方颞侧方向的RNFL厚度的AUC值最高,在Akashi等[21]的研究中颞侧AUC值最高,主要原因在于本研究采用最新的改良的GH分区方法,比传统的四象限的分区方法更精确。由于高度近视视盘的倾斜等变形,导致OCT视神经纤维分层分割出现较大误差,所以联合OCTA血管参数进行鉴别是今后研究早期青光眼的一大趋势。
本研究还发现视盘旁区域的RNFL厚度与视盘旁视网膜血管密度之间存在较强的的相关性,与既往研究一致[22,23]。最近的1项研究表明,视网膜微血管变化可能继发于视神经的损伤[24]。RNFL厚度与视网膜血管密度的较强相关性也说明了OCTA血管密度对青光眼的早期诊断具有较强的可信度。但是在横断面的研究中,很难去确定视网膜血管密度与RNFL厚度的因果关系。因此我们猜测,减少的血流灌注可能导致RNFL变薄,或者由于营养需求减少,RNFL的损失可能导致微血管的减少。
综上,通过OCTA检测,可以使用黄斑区浅层血管参数、视盘旁血管参数及上方颞侧、上方鼻侧、下方颞侧、颞侧下方等方向的视网膜神经纤维厚度等来诊断及区分高度近视合并POAG及高度近视合并LPC。另外本研究尚存在不足,如POAG分期使用H-P-A视野缺损MD值粗略的分级方法,而且只观察早期POAG患者,样本量也较少,这些都有可能造成结果的偏倚,但是有限的时间内招募到患病率不高的高度近视合并POAG以及高度近视合并LPC患者有很大的挑战;OCTA测量本身也存在局限性,如扫描范围小、分辨率要求高等,这些都需要在今后的研究中,扩大样本量,继续追踪观察。
利益冲突申明本研究无任何利益冲突
作者贡献声明欧阳君怡:课题设计;资料分析及解释;撰写论文;修改论文。聂芬:收集数据;资料分析及解释。周丹:课题设计;收集数据。刘艳红:收集数据;修改论文。郭殷杰:资料分析及解释。周灯明:资料的收集;资料分析及解释。段宣初:课题设计;资料分析与解释;论文修改
