HR-HPV E6/E7 mRNA与HPVL1蛋白检测对早期宫颈癌的诊断价值探讨
2021-02-15沈晓斌王宁侯明生詹莹
沈晓斌 王宁 侯明生 詹莹
[摘要] 目的 探討HR-HPV E6/E7 mRNA和HPVL1蛋白在早期宫颈癌及宫颈上皮病变中的临床意义。 方法 收集2018年6月至2019年5月本院150例患者资料,按宫颈病变程度分为低级别组(n=69)、高级别组(n=29)、宫颈癌组(n=9)和正常组(n=43)四组,同时检测患者HR-HPV E6/E7 mRNA和HPVL1蛋白表达情况,观察两者的相关性,并比较多种筛查方案的优越性。 结果 低级别组(81.16%)、高级别组(86.21%)、宫颈癌组(100.00%)HR-HPV E6/E7 mRNA阳性率均高于正常组(11.63%),且HR-HPV E6/E7 mRNA阳性率随着病变的级别升高而递增,呈显著正相关(r=0.736,P<0.05)。同时,低级别组(36.23%)、高级别组(31.03%)、宫颈癌组(11.11%)HPVL1蛋白阳性率均低于正常组(74.42%),发现HPVL1蛋白阳性率随着病变级别升高而递减,呈显著负相关(r=-0.521,P<0.05)。统计并分析液基细胞学、HR-HPV E6/E7 mRNA、HPVL1蛋白检测方法及联合检测在宫颈病变中的诊断价值。发现联合检测特异度最高(93.02%),且敏感度较高(74.76%)。 结论 HR-HPV E6/E7 mRNA检测是宫颈癌筛查的有效措施之一,HPVL1蛋白检测在宫颈癌筛查中有重要意义。比较HR-HPV E6/E7 mRNA和HPVL1蛋白检测结果在宫颈癌筛查中有重要的指导作用,可避免过度治疗。
[关键词] 乳头状瘤病毒科;宫颈肿瘤;HPVL1蛋白;HR-HPV E6/E7 mRNA
[中图分类号] R737.33 [文献标识码] B [文章编号] 1673-9701(2021)36-0128-05
Investigation of the detection value of HR-HPV E6/E7 mRNA and HPVL1 protein in diagnosis of early cervical cancer
SHEN Xiaobin WANG Ning HOU Mingsheng ZHAN Ying
Department of Pathology, Shaoxing Hospital of Traditional Chinese Medicine in Zhejiang Province, Shaoxing 312000, China
[Abstract] Objective To investigate the clinical significance of HR-HPV E6/E7 mRNA and HPVL1 protein in early cervical cancer and cervical epithelial lesions. Methods The data of 150 patients in our hospital from June 2018 to May 2019 were collected and divided into the low-grade group (n=69), the high-grade group (n=29), the cervical cancer group (n=9) and the normal group (n=43) according to the degree of cervical lesions. At the same time, the patients′ expressions of HR-HPV E6/E7 mRNA and HPVL1 protein were detected, and the correlation between them was observed, and the advantages of various screening schemes were compared. Results The positive rates of HR-HPV E6/E7 mRNA in the low-grade group (81.16%), the high-grade group (86.21%) and the cervical cancer group (100.00%) were higher than that in the normal group (11.63%), and the positive rate of HR-HPV E6/E7 mRNA increased with the increase of pathological grade, showing a significant positive correlation (r=0.736, P<0.05). Meanwhile, the positive rate of HPVL1 protein in the low-grade group (36.23%), the high-grade group (31.03%) and the cervical cancer group (11.11%) was all lower than that in the normal group (74.42%). It was found that the positive rate of HPVL1 protein decreased with the increase of pathological grade, showing a significant negative correlation (r=-0.521, P<0.05). The diagnostic value of liquid-based cytology, HR-HPV E6/E7 mRNA, HPVL1 protein detection method and combined detection in cervical lesions was counted and analyzed. It was found that the combined detection had the highest specificity (93.02%) and higher sensitivity (74.76%). Conclusion Detection of HR-HPV E6/E7 mRNA is one of the effective measures in cervical cancer screening, and detection of HPVL1 protein is of great significance in cervical cancer screening. Comparing the detection results of HR-HPV E6/E7 mRNA and HPVL1 protein plays an important guiding role in cervical cancer screening, which can avoid over-treatment.
[Key words] Papillomaviridae; Cervical cancer; HPVL1 protein; HR-HPV E6/E7 mRNA
宫颈癌仍然是当代发展中国家女性的第三大常见恶性肿瘤,居女性癌症死因第4位,85%以上新发及死亡病例出现在发展中国家。近年来,我国的临床宫颈癌发病率呈现上升趋势,其发病的年龄也愈发趋于年轻化。我国占全球宫颈年度发病率的14%,死亡率的12%[1-3]。2015年,全国城市平均宫颈癌筛查率仅为31.5%,其中沿海经济发达地区约为35.9%[4]。HPV感染是全球最常见的性传播疾病,高危型HPV的持续性感染是宫颈癌的主要病因[5-6]。目前HPV检测的方法众多,不同检测方法在宫颈癌前病变中的表达存在一定的差异[7]。本研究主要探讨HR-HPV E6/E7 mRNA检测、HPVL1蛋白检测在早期宫颈癌筛查中的临床价值及其重要意义,现报道如下。
1 资料与方法
1.1 一般资料
收集绍兴市中医院2018年6月至2019年5月因患宫颈疾病来院进行阴道镜下宫颈活检检查的150例患者资料,根据病理活检结果[8]分为四组,低级别宫颈上皮内瘤变患者69例(低级别组),年龄19~65岁,平均(33.5±9.5)岁;高级别宫颈上皮内瘤变患者29例(高级别组),年龄21~60岁,平均(39.3±8.9)岁;宫颈浸润癌患者9例(宫颈癌组),年龄29~64岁,平均(44.6±7.8)岁;黏膜慢性炎患者43例患者(正常组),年龄24~69岁,平均(34.3±9.3)岁。四组患者年龄比较,差异无统计学意义(F=1.336,P>0.05),具有可比性。
1.2 实验试剂及实验仪器
1.2.1 妇科宫颈液基细胞学(Liquid-basedcytologytest,LBP)检查 使用美国豪洛捷液基细胞学(Thinprep cytologic test,TCT)试剂耗材及配套仪器进行细胞学检查,采用世界卫生组织(World Health Organization,WHO)(2017版)规范TBS(The Bethesda System)诊断报告,其结果判断为无上皮内病变或恶性病变(NILM)时定义为阴性,当判读为无明确意义的非典型鳞状上皮细胞(ASC-US)及以上时定义为阳性。
1.2.2 HPVL1蛋白检测 采用核酸和免疫水平双重检测法检测传染病原体HPVL1蛋白抗体。采用试剂主要为美国爱迪旺斯医疗科技有限公司生产的赛泰HPVL1蛋白检测试剂盒。具体操作步骤严格按照说明书进行。
1.2.3 HR-HPV E6/E7 mRNA检测 采用转录介导扩增(Transcription-mediated amplification,TMA)的靶扩增法检测14种高危型HPV的E6、E7mRNA片段。检测试劑主要为美国豪洛捷公司生产的Aptima HPV E6/E7 mRNA检测试剂盒。具体操作步骤严格按照说明书进行。
1.3病理学诊断
阴道镜检查与病理学诊断:由有经验的妇科医生操作,于病变典型处多点取材活检,病理组织学诊断[8]按WHO诊断标准分类为正常、低级别上皮内瘤变、高级别上皮内瘤变和宫颈癌,病理细胞学诊断[8]按WHO诊断标准分类为正常(NILM)、无明确意义的非典型鳞状上皮细胞(ASC-US)、非典型鳞状上皮细胞倾向于高级别上皮内瘤变(ASCU-H)、低级别上皮内瘤变(LSIL)、高级别上皮内瘤变(HSIL)和宫颈癌(SCC)。所有诊断均有两名以上高年资主治以上医生判别。
1.4标本采集及方法
使用豪洛捷液基细胞学(TCT)检测专用采集刷收集宫颈口及宫颈管的脱落上皮细胞,拧断刷头放入专用保存液瓶中待检。
1.4.1 宫颈液基细胞学(LBP)涂片制作 取保存液标本5 mL加入豪洛捷超薄层液基细胞制片机中,制成液基细胞涂片后进行巴氏染色,仪器、试剂耗材均购自美国豪洛捷公司。
1.4.2 标本筛取 采取对照有宫颈病理活检结果的病例进行下一步实验,病理活检检查分类按WHO(2017版)规范化诊断分类[8]。
1.4.3 HPVL1蛋白检测 取TCT检查制片后的剩余标本5 mL再做一张白片,采用核酸和免疫水平双重检测传染病原体HPVL1蛋白抗体的方法进行HPVL1蛋白检测,采用HPVL1蛋白检测试剂盒。具体操作步骤严格按照说明书进行。
1.4.4 HR-HPV E6/E7 mRNA检测 取上述处理后剩余的TCT检查标本进行,采用转录介导扩增的靶扩增法检测14种高危型HPV的E6、E7mRNA片段(TMA)的技术,具体操作为:①先提取高危型HPV E6/E7 mRNA,然后在逆转录酶的作用下,利用一对靶序列特异性引物与靶序列结合后,进行逆转录反应,形成RNA DNA的杂交分子。②逆转录酶水解RNA DNA杂交分子,形成单链DNA,含有T7 RNA聚合酶的识别启动子序列。③单链DNA和引物2结合,通过逆转录方式合成双链DNA分子。T7 RNA聚合酶在启动子上聚合,然后以DNA分子为模板进行转录,作为TMA检测的起始模板,重复以上步骤。④反应完成后,可应用杂交保护试验(Hybridization protection assay,HPA)对生成的RNA产物进行检测[9]。首先检测HPV 16/18 的E6/E7 mRNA,然后若阴性再检测其他12种高危型HPV E6/E7 mRNA。
1.5 统计学方法
采用SPSS 21.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,组间比较调整采用方差分析,计数资料采用[n(%)]表示,使用χ2检验,两变量的相关分析用Pearson直线相关分析法,P<0.05为差异有统计学意义。
2 结果
2.1 各组不同检测分布情况
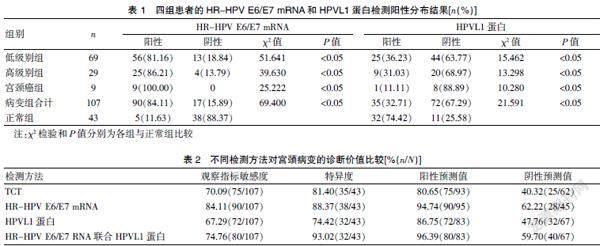
低级别组、高级别组及宫颈癌组HR-HPV E6/E7 mRNA阳性率均高于正常组,HPVL1蛋白检测阳性率均低于正常组,且后两组HR-HPV E6/E7 mRNA阳性率均高于低级别组和正常组,HPVL1蛋白检测阳性率均低于低级别组和正常组;低级别组、高级别组和宫颈癌组HR-HPV E6/E7 mRNA阳性率随着病变级别升高而递增,呈显著正相关(r=0.736,P<0.05),HPVL1蛋白检测阳性率随着病变级别升高而递减,呈显著负相关(r=-0.521,P<0.05)。见表1。
正常组HR-HPV E6/E7 mRNA检测结果阳性率分别低于低级别组、高级别组、宫颈癌组,差异均有统计学意义(低级别组χ2=51.641,P<0.05;高级别组χ2=39.630,P<0.05;宫颈癌组χ2=25.222,P<0.05)。表明HR-HPV E6/E7 mRNA在宫颈上皮不同病变中的表达存在差异。
正常组HPVL1蛋白检测结果阳性率分别高于低级别组、高级别组、宫颈癌组,差异均有统计学意义(低级别组χ2=15.462,P<0.05;高级别组χ2=13.298,P<0.05;宫颈癌组χ2=10.280,P<0.05)。表明HPVL1蛋白在宫颈上皮病变中存在差异性,HPVL1检测显示细胞核染色阳性见封三图16A、B。
2.2各组不同检测方法在宫颈上皮病变中的结果比较
各种检测方法敏感度、特异度比较,差异有统计学意义(均P<0.05),其中HR-HPV E6/E7 mRNA和HPVL1蛋白联合检测特异度最高。各种检测方法阳性预测值和阴性预测值比较,差异无统计学意义(均P>0.05)。见表2。其中联合检测特异度最高(93.02%)。HR-HPV E6/E7 mRNA和HPVL1蛋白检测在高级别及以上宫颈病变中的ROC曲线分析见图1。
3讨论
3.1 目前宫颈癌筛查国内外现状
美国等发达国家由于人们对自身健康的重视、完善的宫颈癌前筛查体系及宫颈癌疫苗的研发普及,患宫颈癌及因宫颈癌死亡的病例每年呈下降趋势[10]。中国等发展中国家,近年来宫颈癌的发病率及死亡率都呈现了上升趋势,且年龄愈发趋向年轻化[11]。在欧美等发达国家,HPV疫苗已经进入普及状态,但HPV疫苗的结果显现尚需时间,其临床效用尚待有效数据验证,而在中国等发展中国家,HPV疫苗刚进入推广状态,其临床效用更是需要时间。且注射疫苗后不等于不用进行宫颈癌筛查。中国医疗资源分布差异较大,目前国内HPV的检测产品数量众多,因生产厂家不同,原理不同,质量也参差不齐,且缺乏统一的判定标准和充分的临床数据验证支持,必然导致检测結果的差异。目前HPV检测在妇科临床应用主要为单独筛查宫颈癌、与细胞学联合筛查宫颈癌、细胞学筛查后结果异常的分流、治疗后的随访、筛查异常后的随访等[12]。
细胞学检查具有较高的特异性,是诊断宫颈癌前病变的金标准之一。但由于细胞学病理诊断医师培养周期长,导致医生资源匮乏、诊断水平参差不齐。且各实验室的基础条件不同,实验室间的结果也会存在较大的差异。在临床实际操作中,受限于标本取样,镜下观察主观性强等原因,存在了许多现实问题,如细胞学敏感性较低,重复性较差,对腺上皮病变不敏感,无明确意义的非典型鳞状上皮细胞(ASC-US)在异常细胞学检查中占50%以上,不能明确是癌前病变还是反应性细胞改变。有文献报道,在大样本人群筛查中ASC-US为5%~10%[13]。有研究显示,ASC-US病例中最终被明确诊断为高级别上皮内瘤变<10%,被确诊为浸润性癌的仅为0.1%左右[14]。腺上皮病变有隐匿性,约有60%的子宫颈原位腺癌为不典型病变,极易漏诊,大约有37%的子宫颈原位腺癌是在手术治疗HSIL时意外发现的。
由此,选择一种较为合理的检查方案,既能在不失其高敏感性的同时,提高其特异性,又能不增加患者的医疗负担,同时避免过度检查,减少医疗资源的浪费,显得十分重要。
3.2 HR-HPV E6/E7 mRNA、HPVL1蛋白检测与宫颈癌的相关性
Ou等[15-16]在研究HR-HPV DNA时发现,宫颈病变上皮细胞中致癌基因E6、E7蛋白存在异常表达,可以促进细胞病变的进展。有研究证实,高危型HPV E6/E7 mRNA相对于HR-HPV DNA对高级别及以上病变有更高的特异性,认为其为病毒持续性感染和持续复制的生物标志物,提示病毒癌基因已经转录表达,主要用于评估宫颈癌变的风险与预后[17]。本研究结果显示,与宫颈正常组织病例比较,存在宫颈病变病例有较高的HR-HPV E6/E7 mRNA 阳性表达率。相关数据表明,组织细胞学诊断病变级别越高,HR-HPV E6 /E7 mRNA表达阳性率越高。
HPV分子结构为双链环状DNA分子,包括了6个与DNA复制、细胞转化有关的基因(E1、E2、E4、E5、E6、E7)和 2个编码病毒衣壳蛋白的基因(L1、L2),其中病毒衣壳蛋白基因表达的病毒衣壳蛋白L1为病毒主衣壳蛋白。HPVL1蛋白在宫颈病变上皮细胞中异常表达。有研究证实,HPVL1蛋白表达水平能够反映细胞中病毒的复制状态、宫颈病变的进展程度[18]。HPVL1蛋白检测阳性说明存在一过性HPV感染阶段,HPVL1蛋白的缺失说明HPV感染持续存在或已发生显著病变[19]。本研究发现,组织细胞学诊断病变级别与HPVL1蛋白表达阳性率呈显著负相关(P<0.05),组织细胞学诊断病变级别越高,HPVL1蛋白表达阳性率越低。由于受限于本课题研究内容,尚不能阐述本研究中正常对照组HPVL1蛋白阳性率表达较高的原因,此问题尚有待进一步探讨。
3.3 HPV E6/E7 mRNA和HPVL1蛋白检测有良好的临床应用前景
HR-HPV检测的特点是敏感性高,可达90.8%,但缺点是特异度低,其检出高级别上皮内病变的特异度约为44.8%[20]。目前,高危型HPV的检测更多应用于高收入国家,而我国目前的高危型HPV检测相关试剂多达70余种,多数产品缺乏子宫颈癌筛查的临床数据及随访数据的支持,且缺乏严格的室内、室间质量控制,这必然影响其筛查结果的准确性。赵雪莲等[12]研究显示,高危型HPV分型检测敏感度为96.4%,特异度为86.2%,阳性预测值为18.6%,阴性预测值为99.9%。本研究中分别统计了TCT、HR-HPV E6/E7 RNA、HPVL1蛋白检测方法及联合检测在宫颈病变中的诊断价值。结果发现,各种检测方法敏感度、特异度比较,差异有统计学意义(P<0.05),其中联合检测特异度最高(93.02%),且敏感度较高(74.46%),明显优于单独应用高危型HPV分型检测结果。各种检测方法阳性预测值和阴性预测值比较,差异无统计学意义(P>0.05),表明联合检测方法在鉴别宫颈病变,尤其是针对HPV持续感染导致宫颈癌高风险预期,有较高的特异度。
HPVL1蛋白检测属于病原学检测,可显示HPV感染后的不同阶段。HPVL1蛋白检测阳性说明存在或曾经存在过一过性HPV感染,HPVL1蛋白阴性说明HPV的感染持续存在;HR-HPV E6/E7 mRNA是新一代HR-HPV检测方法,为病毒持续性感染和持续复制的生物标志物,是评估宫颈病变严重程度并预测其预后的重要因素。比较HPVL1蛋白检测与HR-HPV E6/E7 mRNA检测结果具有十分重要的临床意义。
在欧美等发达国家,HPV疫苗已经普及覆盖,随着时间的推移,在疫苗作用下HPV的型别,致病亚型均已发生极大的变化,如宫颈癌发生率降低,死亡率降低,16/18型HPV感染者大大减少等[21]。我国HPV疫苗自2018年开始使用,但即使所有12岁以下的女孩都注射了疫苗,最乐观的讲也要30年才能单靠接种预防宫颈癌,且疫苗只覆盖部分高危型HPV,因此现在的几十年中仍主要靠筛查预防宫颈癌。从另一方面来说,注射HPV疫苗不等于不需要进行宫颈癌筛查,注射HPV疫苗后,筛查可成为宫颈癌的第二道防线,进一步降低宫颈癌发病风险。并且,在宫颈癌后疫苗时代下,对各种HPV亚型的检测及致病性有必要进行重新评估论证,如16/18型HPV感染者大大减少导致其他12种高危型HPV 检出比率会相对增多,对原来14种高危型HPV 的依次重要性必然会有一个重新排序的过程。HR-HPV E6/E7 mRNA检测对比HPVL1蛋白检测可在病原学基础上重新排序14种高危型HPV 的依从性,在后疫苗时代下有十分重要的临床研究意义。
综上所述,HR-HPV E6/E7 mRNA检测和HPVL1蛋白检测具有高特异性和高敏感性的特点,在临床有十分重要的意义。可有效地避免过度检查、治疗,节约宝贵的医疗资源,可以减轻患者的心理负担,并具有极大的社会经济学效益。两者有机结合,更有利于综合评估患者发生宫颈病变的风险,具有良好的临床应用前景。
[参考文献]
[1] Chen WQ,Zheng RS,Baade PD,et al.Cancer statics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Wang N,Hou MS,Zhan Y,et al.MALAT1 promotes cisplatin resistance in cervical cancer by activating the PI3K/AKT pathway[J].Eur Rev Med Pharmacol Sci,2018, 22(11):7653-7659.
[3] 沈曉斌,包磊,詹莹.HPV检测在宫颈癌前病变筛查策略中的作用探讨[J].中国妇幼健康研究,2018,29(10):1345-1348.
[4] 许惠惠,石卫武,徐玖飞,等.HPV基因分型在宫颈癌筛查风险分层管理中的价值[J].中华实验和临床病毒学杂志,2016,30(1):14-18.
[5] 王庆华,赵方辉,赵昀,等.子宫颈癌等人乳头瘤病毒相关疾病免疫预防专家共识[J]. 中华预防医学杂志,2019, 53(8):761-803.
[6] Depuydt CE,Thys S,Beert J,et al.Linear viral load increase of a single HPV-type in women with multiple HPV infections predicts progression to cervical cancer [J].Int J Cancer,2016,139(9):2021-2032.
[7] Arbyn M,Snijders PJ,Meijer CJ,et al.Which high-risk HPV assays fulfil criteria for use in primary cervical cancerscreening?[J].Clin Microbiol Infect,2015,21(9):817-826.
[8] 杨光华.病理学[M].8版.北京:人民卫生出版社,2013:312-313.
[9] Al-Shabanh OA,Hafez MM,Hassan ZK,et al.Human papillomavirus genotyping and integration in overian cancer saudipatients[J].Virology Journal,2013,10(10):343.
[10] 冯瑞梅,陈汶,乔友林.高危型人乳头瘤病毒核酸体外检测试剂盒临床功能验证的中美指导原则解读[J].中华肿瘤杂志,2017,39(7):553-557.
[11] 田亚宾,张春涛.人乳头状瘤病毒核酸分型检测试剂的研究进展[J].中国肿瘤杂志,2018,40(10):729-735.
[12] 赵雪莲,热米拉·热扎克,胡尚英,等.高危型HPV DNA单独检测及与薄层液基细胞联合筛查宫颈癌及宫颈高度病变的筛查效果比较[J].中华预防医学杂志,2018, 52(5):469-473.
[13] Wright TC,Stoler MH,Behrens CM,et al.Primary cervical cancer screening with human papillomavirus:end of study results from the A-THENA study using HPV as the first-line screening test[J]. Obstet Gynecol,2015,136(2):189-197.
[14] Waxman AG,Chelmow D,Darragh TM,et al.Revised terminology for cervical histopathology and its implications for management of high-grade squamous intraepithelial lesion of the cervix[J].Obstet Gynecol,2012,120(6):1465-1471.
[15] Ou D,Garberis I,Adam J,et al.Prognostic value of tissue necrosis,hypoxia-related markers and correlation with HPV status in head and neck cancer patients treated with bio- or chemo-radiotherapy[J]. Radiother Oncol,2018, 126 (1):116-124.
[16] Tomaic V.Functional roles of E6 and E7 oncoproteins in HPV-induced malignancies at diverse anatomical sites[J].Cancers(Basel),2016,8(10):E95.
[17] Shi W J,Liu H,Wu D,et al. E6/E7 proteins are potential markers for the screening and diagnosis of cervical pre-cancerous lesions and cervical cancer in a Chinese population[J]. Oncol Lett,2017,14(5):6251-6258.
[18] Carow K,Read C,H?覿fner N,et al. A comparative study of digital PCR and real-time qPCR for the detection and quantification of HPV mRNA in sentinel lymph nodes of cervical cancer patients[J]. BMC Res Notes,2017,10(1):532.
[19] Hsu YW,Huang RL,Su PH,et al.Genotype-specific methylation of HPV in cervical intraepithelial neoplasia[J]. J Gynecol Oncol,2017,28(4):e56.
[20] Tao X,Zheng B,Yin F,et al.Polymerase chain reaction human papillomavirus(HPV) detectionand HPV genotyping in invasive cervical cancers with prior negative HC2 test results[J].Am J Clin Pathol,2017,15(3):477-483.
[21] 李芹,劉春容,李静,等.世界范围内9~26岁女性对HPV的认知现状及预防性HPV疫苗的应用现况[J].中国肿瘤,2017,26(3):161-169.
(收稿日期:2021-03-06)
