青鳉抗病毒感染过程的负调控因子jun的鉴定
2021-02-11王志潘启华陆可罗君志夏必琳姜正正申萍刘红陈天圣
王志,潘启华,2,陆可,罗君志,夏必琳,姜正正,申萍,刘红,陈天圣,2
1.华中农业大学水产学院/农业农村部淡水生物繁育重点实验室,武汉 430070;2.集美大学水产学院/农业农村部东海海水健康养殖重点实验室,厦门 361021
宿主的原癌基因jun(Jun proto-oncogene,AP-1 transcription factor subunit)是一类表达广泛、多功能的转录调节因子,不仅和癌症、血管生成息息相关,也参与了机体的免疫调节和病毒的感染过程[1-2]。Jun属于转录因子激活剂蛋白Ⅰ(activated protein 1,AP-1)的亚族[1],包含3个重要的蛋白结构域:Delta结构域、反式激活结构域和DNA结合与二聚化结构域[2]。研究发现JUN能被JNK(c-Jun N-terminal kinase)磷酸化激活,并与JUND(JunD proto-oncogene,AP-1 transcription factor subunit)在肾上腺髓质素反应中二聚化形成AP-1参与到肿瘤的进程中[3]。
研究表明Jun参与病毒相关的免疫调节通路[4-6]。例如,在牛痘病毒(vaccinia virus,VACV)侵染鼠胚胎纤维母细胞的实验中,病毒激活Jun的表达,从而促进病毒早期复制,加速病毒的扩散[7]。凡纳滨对虾(Litopenaeusvannamei)jun对具有先天性免疫功能的血蓝蛋白的转录调节至关重要[8];此外,Jun能结合到凡纳滨对虾基质金属蛋白酶mmp-2(matrix metalloproteinase-2)启动子上,激活mmp-2的表达,而mmp-2又与许多的抗菌肽活性相关[9]。在红唇胭脂鱼(Lizahaematocheila)中,jun和fos都能调节ap-1的启动子进而对免疫反应发挥重要作用[10]。在斜带石斑鱼(Epinepheluscoioides)的GS细胞实验中,过表达突变型jun后,病毒的转录水平降低的同时细胞病变效应出现延迟[11]。在禽类成纤维母细胞中,宿主和病毒编码的高致癌性蛋白JUN(V-JUN)因具备分子的同源性,成为病毒复制过程中的重要媒介[12]。以上文献表明,jun是宿主抗病毒信号通路中潜在的负反馈因子,可能是鱼类分子抗病育种中的一个候选因子,需要进一步进行验证。
日本青鳉(Oryziaslatipes)是一种生殖周期短、便于实验室养殖、具有公开的基因组、容易开展基因编辑育种的模式鱼类,对其基因的功能分析有助于养殖鱼类的基因功能验证[13]。为了进一步了解jun基因在鱼类抗病毒天然免疫方面的功能,本研究以日本青鳉为研究对象,采用CRISPR/Cas9介导的基因编辑技术获得jun缺失的纯合子突变体品系,并对其在神经坏死病毒(nervous necrosis virus,NNV)感染过程中的特征展开研究,以期为养殖鱼类的抗病育种提供理论依据。
1 材料与方法
1.1 材 料
日本青鳉为华中农业大学水产学院模式鱼类繁育实验室饲养的HdrR品系,养殖在水温28 ℃、光照周期明∶暗为14 h∶10 h的循环水系统中[14]。性成熟的青鳉通过自然繁殖的方式获得后代,胚胎放置于培养液中,在28 ℃培养箱孵育[13]。实验动物处理按照华中农业大学科学伦理委员会批准的规程进行。
1.2 jun编码序列的鉴定
在NCBI上下载预测的青鳉juncDNA序列(gene ID:LOC101173011),设计扩增编码区(coding sequence,CDS)的引物(表1)。选择表达量高的性腺,采用RNAiso Plus试剂盒提取总RNA,使用PrimeScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa,日本)经过反转录获得cDNA。采用Q5高保真的DNA聚合酶(BioLabs,美国)进行PCR扩增获得jun的CDS序列,反应条件为94 ℃ 3 min;35 个循环:94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s;最后72 ℃延伸10 min。随后将扩增的PCR产物进行1%琼脂糖凝胶电泳,确定大小正确后,回收目的片段连接到pMD18-T(TaKaRa,日本)载体,连接产物转化到DH5α感受态细胞中,送阳性克隆至武汉擎科生物有限公司测序。
1.3 Jun系统进化树的构建
在NCBI网站下载人、鼠、猪、斑马鱼和青鳉的Jun和同家族Junb、Jund的序列,通过MEGA7中的ClustalW方法进行蛋白的多序列比对,使用Neighbor-joining方法构建系统进化树,Bootstrap method参数设置为1 000。
1.4 jun的表达模式分析
提取野生型青鳉成鱼的眼、脑、鳃、心脏、头肾、卵巢、精巢、肝脏、脾脏9个组织的总RNA,反转录获得各个组织的cDNA。设计引物junRT-F/RT-R(表1),通过半定量PCR检测基因在各个组织表达,以β-actin基因作为内参。PCR反应条件为:95 ℃变性30 s,60 ℃退火30 s,72 ℃,25个循环,延伸10 s,25个循环。PCR产物在2%琼脂糖凝胶上分离。
1.5 jun突变体的构建
根据NCBI上的日本青鳉jun基因序列,在网站https://cctop.cos.uni-heidelberg.de:8043/上设计合适的敲除靶位点,选择分值高且脱靶风险小的靶点junsg1/sg2F(表 1)。在靶序列5′端前加T7启动子序列,在3′端加sgRNA scaffold引物扩增序列,具体的sgRNA(single guide RNA)的上游引物为:5′TGTAATACGACTCACTATAGG-(gRNA 20 nt)-GTTTTAGAGCTAGAAAT 3′,下游引物为来自模板pMD19T-sgRNA的通用引物gRNA-R(表 1)[14],引物由武汉擎科生物技术有限公司合成。以pMD19T-sgRNA为模板用PCR扩增出双链的sgRNA,反应条件如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 10 s,34个循环,然后使用T7转录试剂盒(mMESSAGE mMACHINETMT7 transcription kit,Thermofisher)转录出sgRNA,并使用氯化锂沉淀法纯化回收sgRNA。Cas9 mRNA按照文献纯化制备,将Cas9(300 ng/μL)和sgRNA(50 ng/μL)的混合液注射到1细胞期的青鳉胚胎[15]。在胚胎发育4 d后提取注射的部分胚胎DNA,使用检测引物junDF/DR(表1)PCR扩增jun的靶位点片段,突变型的PCR产物与野生型的相比明显变短。将注射的F0胚胎养至成鱼。然后通过尾鳍检测PCR产物来筛选F0突变成鱼,将突变体F0代成鱼与野生型杂交,获得F1代突变体。将F1代养至成鱼,再通过单克隆测序筛选出F1代中突变一致的类型进行自交得到的F2代并养至成鱼,通过PCR筛选出F2代中的纯合子突变体,并将突变的纯合子繁殖扩大以供后续实验使用。

表1 实验所用引物 Table 1 Primers used in the experiment
1.6 突变体jun—/—Δ124仔鱼和成鱼NNV攻毒实验和病毒定量分析
收取野生型青鳉胚胎,待仔鱼孵化出膜3 d后,每组15尾放入35 mm培养皿中加入总体积为4 mL的胚胎培养液。设置0、2、10、50、100、200 μL神经坏死病毒进行病毒浓度梯度的预实验,以确定半致死病毒剂量。实验中的NNV是笔者所在实验室从患病石斑鱼分离获得的,采用RGNNV的保守引物经过PCR扩增全长后测序,序列确定为RGNNV,其包含2条RNA链,分别为RNA1(2.9 kb,NCBI序列号MZ053461)和RNA2(1.4 kb,NCBI序列号 MN105076.1),将病毒在石斑鱼GE细胞中扩增后保存于-80 ℃(未发表)。
参考预实验数据对仔鱼进行病毒感染实验。试验设置空白对照组(野生青鳉仔鱼不加NNV)、对照组(野生青鳉仔鱼加NNV)和实验组(jun-/-Δ124突变体仔鱼加NNV)。对照组和实验组均加入100 μL NNV,每隔12 h观察记录每组的死亡数,实验共重复7次,最后绘制对照组和处理组的死亡曲线。
对成鱼进行病毒感染实验时,使用微量注射器从野生型(对照组)和突变体成鱼(实验组)的泄殖孔向腹腔内注射25 μL NNV,每组注射10尾,感染2周后取样。由于NNV主要攻击神经组织密集的脑和眼组织,提取脑、眼、鳃和肌肉4个组织RNA,通过qRT-PCR检测jun-/-Δ124和野生型各组织中NNV病毒的相对复制量(表 1)。
1.7 jun—/—Δ124相对于野生型在不同条件下干扰素相关基因的表达
设计与干扰素通路相关的4个基因jun、fosl1(FOS-like antigen 1)、tbk1(TANK-binding kinase 1)、irf3(interferon regulatory factor 3)的qRT-PCR引物(表1),检测在NNV病毒诱导下,jun-/-Δ124和野生型的个体中各基因的表达。实验对象为孵化出膜3 d的仔鱼,共设置4组。即野生对照组(野生青鳉仔鱼不加NNV诱导)、野生实验组(野生青鳉仔鱼加NNV诱导)、突变体对照组(突变体青鳉仔鱼不加NNV诱导)和突变体实验组(突变体青鳉仔鱼加NNV诱导)。每组10尾鱼,NNV诱导剂量为100 μL。病毒诱导4 d后取样,用qRT-PCR检测4组样品中各基因的表达。
每组各取3尾鱼进行检测,同时设置阴性空白对照。使用β-actin作为内参基因,基因的相对表达量采用2-△△Ct法进行计算。
1.8 统计学分析
试验数据均用“平均值±标准差”表示,并用GraphPad Prism 5软件t-tests中的Two-tailed对实验结果进行统计学分析,显著性差异设为*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2 结果与分析
2.1 青鳉jun基因的CDS序列
采用高保真DNA聚合酶,使用表1中的引物,PCR扩增后得到目的条带约为1 000 bp的junCDS片段,克隆到T载体后,对目的条带进行测序。测序获得的青鳉jun的CDS由起始密码(ATG)到终止子(TAG)全长为921 bp,共编码306个氨基酸(amino acid,aa),包括N端(5~209 aa)的Jun超家族结构域和C端(230~290 aa)的bZIP超家族结构域(图1)。

jun CDS序列和对应的蛋白序列,扩增引物用下划线标注,红色碱基为gRNA序列,灰色为Jun超家族结构域;黄色为bZIP结构域。The jun CDS sequence and the deduced protein sequences:underline:amplified primers; red bases:gRNA sequences; gray:Jun-like transcription factor domain; yellow:bZIP domain.
2.2 Jun的系统进化关系
通过系统进化分析可以看出,Jun、Junb和Jund在各支内都表现为硬骨鱼纲的青鳉和斑马鱼亲缘关系更近,而哺乳纲的人、鼠、猪亲缘关系更近(图2)。
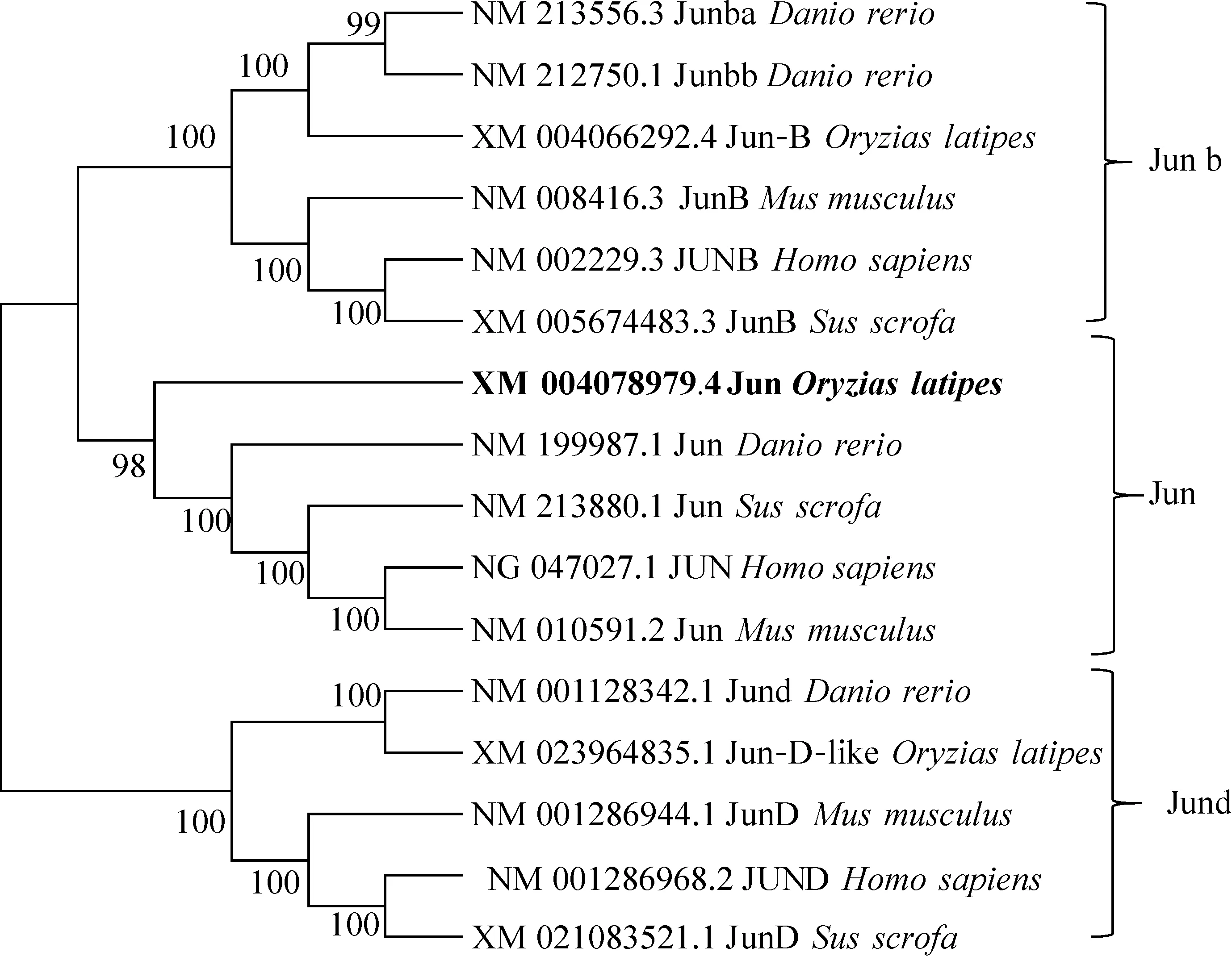
图2 3个Jun家族的系统进化树Fig.2 Phylogenetic tree analysis of three Jun families
2.3 jun表达模式
以β-actin为内参,对眼、脑、鳃、心脏、头肾、卵巢、精巢、肝脏、脾脏9个组织内jun的基因表达进行半定量PCR检测,发现其在所检测的9个组织中都表现出较高的表达水平,检测结果如图3所示。

图3 青鳉组织中jun的表达模式Fig.3 Expression pattern of jun in various medaka tissues
2.4 jun突变体品系构建
通过显微注射将合成好的靶点sgRNA1(5′ ATCCTGACGTCGCCCGATGT3′)/sgRNA2(5′ GGACAGACAGTTGCTACCGG3′)和Cas9 mRNA共注射到早期胚胎,经过F0代突变体亲本筛选、F1代同种突变类型杂合子单克隆筛选和F2代纯合子突变体筛选,获得了jun缺失124个碱基的纯合子的突变体品系(MT:jun-/-Δ124)。对该突变体品系的DNA和蛋白结构进行预测(图4),发现突变体蛋白缺失了Jun家族结构域和bZIP结构域,在第59个氨基酸处出现翻译终止,为有效的突变类型。
2.5 jun—/—Δ124仔鱼和成鱼的NNV病毒攻毒结果
根据最终获得的死亡曲线(图5A)可以看出jun-/-Δ124突变体品系相对于野生型具有明显的抗病毒效果。仔鱼死亡的判别依据:躯体明显腐坏呈骨架状或肿大,仔鱼眼睛明显肿大且眼间距增大,仔鱼的尾部明显弯曲,鳔点消失(图5B)。另外,在成鱼的病毒感染实验中,在突变体的眼(图5C)、脑(图5D)、鳃(图5E)和肌肉(图5F)中NNV的RNA2基因的表达明显低于野生对照组。这说明jun-/-Δ124突变体的NNV病毒量较少,因此突变体相较于野生型对NNV更为耐受。
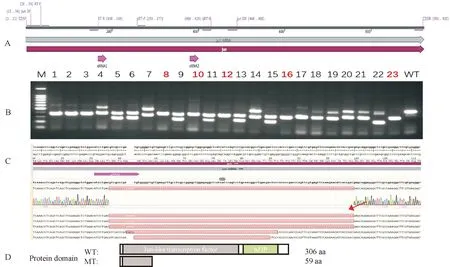
A.青鳉jun;B.突变体jun-/-Δ124的筛选过程,红色为纯合子突变体;C.突变体的序列对比,红色为缺失124 bp突变体;D.青鳉野生型和突变型jun-/- Δ124的蛋白结构域。A.The medaka jun gene; B.PCR screening result of mutant jun-/-Δ124,-124 bp mutant were labeled by red color; C.Sequence comparison of WT and mutants,jun-/-Δ124 as indicated by red arrow; D.The protein domain of wild-type (WT) and jun-/-Δ124 (MT).
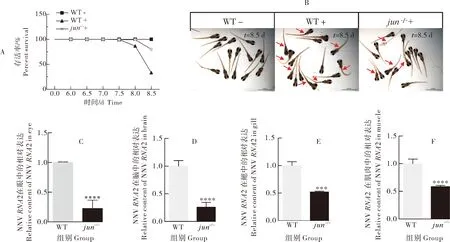
A.攻毒期间仔鱼的存活率;B.从NNV处理开始经历8.5 d三组仔鱼的存活情况,死亡的仔鱼用红色箭头标出;C-F.NNV病毒RNA2基因在眼、脑、鳃和肌肉中的表达。误差线表示平均值±标准偏差,****P<0.000 1。A.Survival rate of larvae during challenge; B.After 8.5 d from NNV treatment,the survival of larvae in the three groups,dead larvae were marked with red arrows; C-F.Expression of RNA2 gene of NNV virus in eye,brain,gill and muscle.The error line represents the mean ± standard deviation,****P<0.0001.
2.6 jun—/—Δ124干扰素相关基因的表达
通过qRT-PCR检测干扰素相关基因jun、fosl1、tbk1、irf3在NNV诱导下的野生型和突变体内的表达情况,发现在病毒诱导后,野生型内的相关基因表达都有不同程度的上调,说明这些基因参与了抗病毒免疫反应。jun在jun-/-Δ124突变体中的表达极显著降低(P<0.000 1)(图6A),说明jun的表达在突变体内受阻;在无病毒诱导情况下,jun-/-Δ124突变体中fosl1的表达相对于野生型有极显著增高(P<0.001),但在病毒诱导下相对于野生型的表达极显著降低(P<0.000 1),而在jun-/-Δ124突变体中fosl1的表达在病毒诱导或不诱导下均没有显著差异(图6B);在无病毒诱导下,tbk1在jun-/-Δ124突变体中的表达相对于野生型没有显著差异,但在病毒诱导下相对于野生型也有降低(P<0.05),同时在jun-/-Δ124突变体中tbk1的表达在有无病毒诱导下两者也没有显著差异(图6C);irf3在不诱导的条件下,在jun-/-Δ124突变体中相对野生型没有显著差异,但是在病毒诱导的突变体内irf3的表达水平有极显著的上调(P<0.000 1),同时在突变体jun-/-Δ124中病毒诱导之后的表达量极显著升高(P<0.000 1)(图6D)。
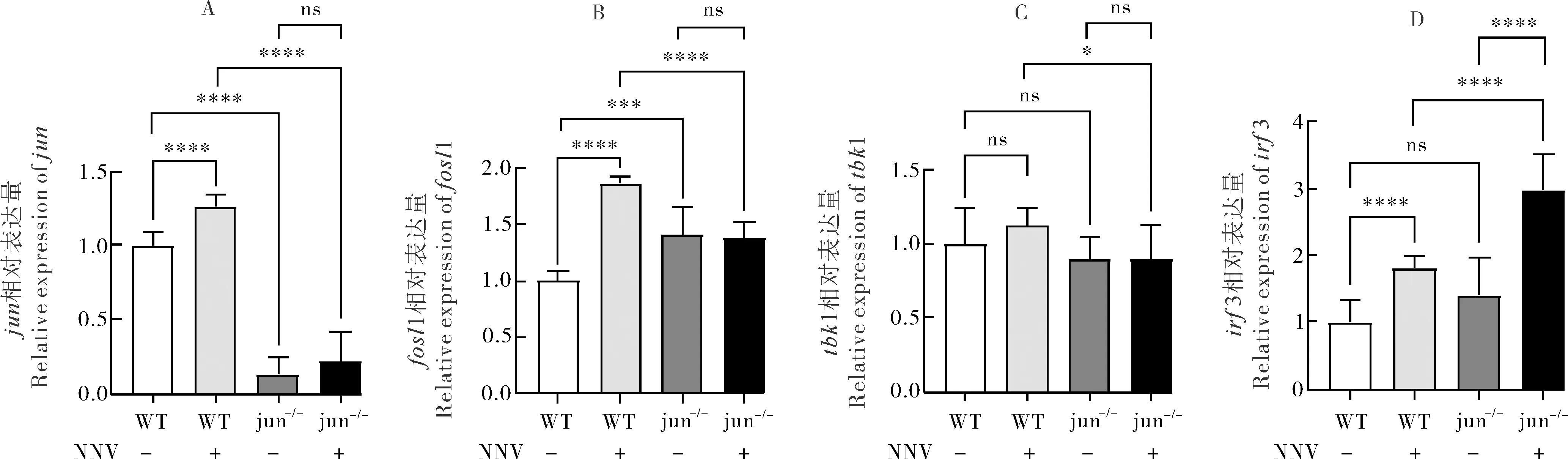
A-D.NNV诱导下jun、fols1、tbk1、irf3在jun-/-Δ124和野生型中的相对表达。误差线表示平均值±标准偏差,* P<0.05,***P<0.001,****P<0.0001。A-D.Relative expression of jun、fosl1、tbk1、irf3 in jun-/-Δ124 and WT induced by NNV.Error bars represent mean±SD.* P<0.05,***P<0.001,****P<0.0001.
3 讨 论
宿主的jun是机体参与病毒感染和免疫调节的一个重要因子。本研究克隆了青鳉的jun基因,并通过基因编辑技术构建了突变体,初步研究发现其具有明显的抗病毒效果,而且突变体成鱼体内的病毒相对含量要比对照组显著降低,因此认为青鳉的jun是病毒感染过程中的负反馈因子。
转录因子AP-1由许多的同源或异源的二聚体结合形成,包含bZIP(basic region leucine zipper,bZIP)转录因子家族结构域的成员,比如Jun、Fos、Atf[16]。研究发现,很多致癌性的病毒通过编码病毒bZIP转录因子来影响宿主细胞的免疫反应,使得病毒的复制更为有利[17]。在本研究中鉴定的青鳉jun基因,其蛋白结构含有经典的Jun超家族结构域和bZIP结构域,其蛋白序列进化关系和泛表达模式也符合jun基因的特性。在突变体青鳉中,在59 aa处Jun蛋白翻译终止,导致其完全缺失bZIP蛋白结构域,这可能是突变体具有抗病毒效果的重要原因。
干扰素相关基因fosl1、tbk1、irf3也都与病毒的感染有关。三磷酸腺苷依赖解旋酶DDX3(DEAD-box RNA helicase)是一种熟知的能够抑制乙肝病毒的宿主因子,它能够通过TBK1/IKKε(Inhibitor of kappa B kinase ε)/IRF[18]和干扰素β启动子刺激因子增强机体的先天性免疫。人参皂苷能够通过Akt(又称PKB,Protein kinase B)/p53(Interleukin-12A)通路刺激DDX3的启动子活性进而激活TBK1/IKKε/IRF信号并增强先天性免疫应答[19]。研究还发现人参皂苷能够通过抑制JNK/AP-1通路进而阻滞乙肝病毒的复制[20]。此外,研究表明JNK能够磷酸化激活Jun,进而促进AP-1的合成[3]。因此,TBK1和c-Jun/AP-1在功能上可能存在拮抗关系,当jun敲除之后,机体内的jun表现为低水平的状态,所以在jun突变体中的tbk1的表达水平也处在一个相对低的水平。fosl1能够通过阻滞TBK1和TRAF3/TRIF(TIR-domain-containing adaptor-inducing interferon β)的互作抑制Ⅰ型干扰素的表达[21]。本研究通过qRT-PCR结果分析发现,fosl1本身能被病毒诱导而表达增高,但在突变体中,在缺少了jun的抑制作用后,干扰素表现为高水平状态。而tbk1在突变体或者NNV病毒诱导下表达都显著降低,因此,fosl1也处于较低水平,但fosl1并不能直接抑制干扰素的表达。且在突变体内有无病毒的诱导,fosl1和tbk1的表达都没有显著变化,说明fosl1和tbk1的表达可能与jun无直接的联系。此外,irf3是调节I型干扰素合成的转录因子,能诱导IFNβ的表达,是机体病毒免疫应答的关键调控因子[22]。在免疫细胞中普遍表达的赖氨酸乙酰转移酶Kat8能够乙酰化irf3进而降低irf3的转录活性,导致ifn-Ⅰ的表达降低。同时,Kat8敲除的小鼠对病毒的耐受力获得增强[23]。在鲫(CarassiusauratusL.)中,irf3的过表达会激活Ifn的产生,而过表达突变irf3则因为抑制了IFN的产生,破坏了poly-IC激活干扰素刺激基因的反应[24]。以上多个研究都表明,irf3能够直接参与干扰素的产生,缺失irf3的突变体中的病毒耐受能力明显变差。在本研究中,敲除jun基因后,受到病毒感染后机体irf3的表达相对于野生型极显著上调,同时在突变体内irf3的表达量在病毒诱导的条件下相对于无病毒诱导组也极显著地上调。这说明jun的缺失可能直接导致了irf3的上调,Jun可以通过抑制Irf3/Ifn通路抑制干扰素的表达。因此,突变体病毒耐受能力的提高可能是通过Irf3调控的信号通路增强了干扰素表达的结果。
综上所述,本研究推断青鳉jun基因可能是宿主在抗病毒感染过程中的负调控因子,可作为抗病毒育种改良的候选基因。
