高通量测序和数字PCR应用于无创产前检测胎儿非整倍体研究进展
2021-02-11陈桂芳杨佳怡高运华王志栋吴枭
陈桂芳 杨佳怡 高运华 王志栋 吴枭
(1.沈阳化工大学,辽宁沈阳 110142;2.中国计量科学研究院,北京 100029)
胎儿染色体非整倍体是产前筛查检测的主要内容,进行早期产前筛查和诊断有利于优生优育。非整倍体产前检测是采用无创、微创或有创的技术方法,在一定时间窗口期对孕妇进行检查,以评估胎儿罹患染色体非整倍体疾病的风险或进一步确诊[1]。传统产前诊断方法具有侵入性,通过羊膜穿刺、绒毛取样以及脐静脉穿刺取样进行染色体核型分析,有潜在的胎儿流产或感染风险[2],早孕期、中孕期常规产前筛查通过超声检查联合血清学标记分析,同时结合孕妇年龄、孕周、体重以及是否存在糖尿病等多项临床信息,以软件计算风险值进行评估,但敏感度和特异性有限[3,4]。Lo等[5]于1997年在孕妇外周血中发现胎儿游离DNA(cell-free fetal DNA,cff-DNA),为胎儿染色体非整倍体无创产前检测(noninvasive prenatal testing,NIPT)奠定了基础。
2008 年,Lo等[6]验证了基于孕妇血浆中的cff-DNA和大规模基因组测序进行胎儿染色体非整倍体检测的可行性。目前,基于高通量测序技术的无创产前检测已用于临床筛查胎儿21-三体、18-三体以及13-三体综合征,在高风险孕妇中表现出很高的灵敏度、特异性以及检出率[7]。高通量测序无创产前检测会受到源于胎儿、母体、测序过程以及数据分析等多种因素的影响,可能出现假阳性或假阴性结果[8]。早期,Lo等[9]和Fan等[10]先后证明单分子定量检测技术可以用于无创产前检测胎儿染色体非整倍体,但为可靠地检测低丰度的cff-DNA,需要大量的PCR反应。随着微流控技术的引入,数字PCR(digital PCR,d PCR)技术表现出更高的检测效率和灵敏度。已有研究表示,d PCR在染色体非整倍体无创产前检测应用中具有更直接、更快速和更具成本效益的发展潜力[11-13]。
本文将简要介绍基于孕妇外周血游离DNA进行胎儿染色体非整倍体无创DNA产前检测的研究进展,分析影响高通量测序无创DNA产前检测结果准确性的可能因素以及现有用于质量控制的核酸标准物质,并讨论d PCR技术应用于无创DNA产前检测胎儿染色体非整倍体的原理和优势和最新研究进展。
1 染色体非整倍体检测与无创产前检测的研究与发展
染色体非整倍体被定义为正常染色体的“重复”或“缺失”,可能导致早孕期胎儿流产,或者导致新生儿先天性缺陷、发育不良以及多器官功能异常,进行早期产前筛查和诊断有利于优生优育[1]。其中,21-三体综合征、18-三体综合征以及13-三体综合征是最常见常染色体非整倍体疾病,是孕妇妊娠期间主要的筛查目标。在临床上传统方法仍然流行,早孕期和中孕期常规筛查项目包括胎儿颈项透明层厚度(nuchal translucency,NT)以及多项血清学指标,包括妊娠相关血浆蛋白-A(pregnancy-associated plasma protein-A,PAPP-A)、人绒毛膜促性腺激素(human choionic gonadotophin,hCG)、甲胎蛋白(alpha-fetoprotein,AFP)、游离雌三醇(u E3)、血清抑制素A(nhibin-A)等[14,15]。同时,结合孕妇情况和预产期有多种组合方案可选择,包括二联筛查(hCG、PAPP-A)、三联筛查(AFP、uE3、hCG)、四联筛查(AFP、u E3、h CG、nhibin-A)等。产前筛查旨在评估胎儿罹患染色体非整倍体疾病的风险,有利于减少不必要的侵入性操作[1]。目前,通过羊水穿刺进行核型分析仍是胎儿染色体非整倍体高风险人群进一步确诊的“金标准”。传统筛查方法的检出率不高,侵入性检测对孕妇和胎儿存在一定的风险,人们一直在寻求一种更可靠、更敏感、更安全的方法。表1总结了产前检测胎儿染色体非整倍体的常规筛查方法和确诊手段。
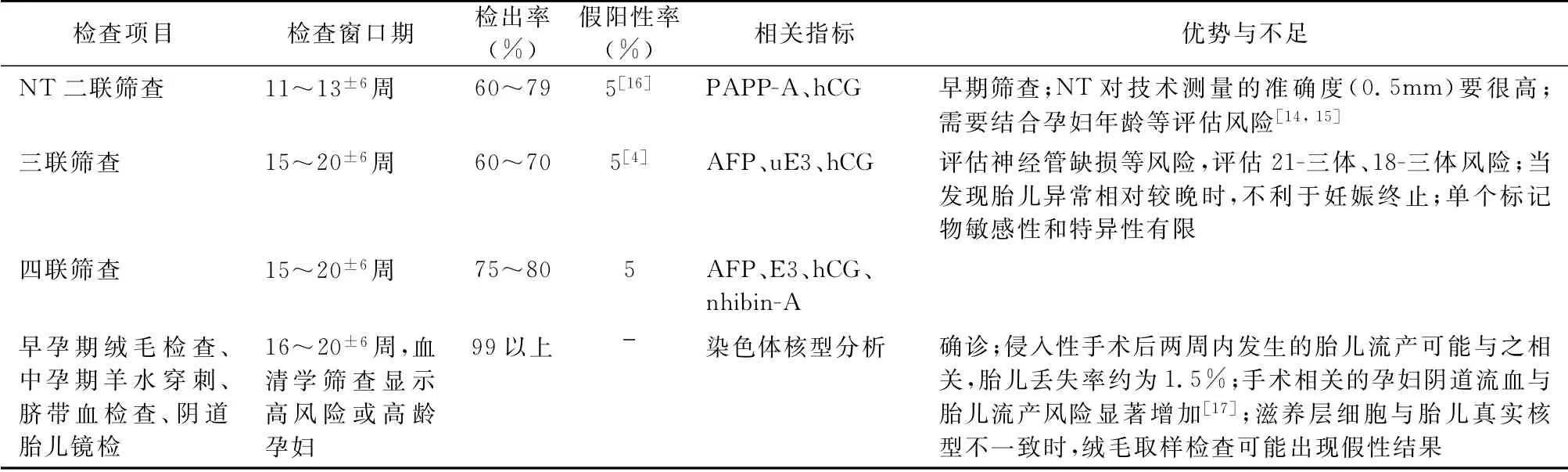
表1 产前筛查和诊断胎儿染色体非整倍体的方法
孕妇外周血中cff-DNA的发现促进了无创产前检测的发展。无创产前检查也称非侵入性产前筛查,是通过采集孕妇外周血,提取血浆中的游离DNA(包含cff-DNA)进行检测和分析。cff-DNA主要来源于胎盘滋养层细胞,研究表明母体血浆的cff-DNA含量受多项母婴特征影响,其占母体血浆总游离DNA的比例会随着孕周增加而增加,随孕妇的BMI指数增加而减小,但存在个体差异性[18-20]。在妊娠10~21周之间,cff-DNA约占母体血浆总游离DNA的10%~20%[21]。利用游离DNA进行检测分析是困难的:低丰度的cff-DNA要求高灵敏度和特异性的检测方法,同时直接获取cff-DNA需要克服母体游离DNA的“干扰”[22,23]。
为此,研究者开发出特异性识别孕妇血浆中胎儿DNA/m RNA的方法:①表观遗传学染色体相对剂量法。DNA甲基化是一种重要的表观遗传修饰,利用胎儿DNA和母体DNA存在明显的甲基化差异,Tong等[24]在位于胎儿18号染色体上的特异性低甲基化的SERPINB5基因位点进行标记,通过在该位点上的等位基因比率检测到18-三体情况。②单核苷酸多态性(single nucleotide polymorphism,SNP)等位基因比率法。在母体血浆中胎儿胎盘特异性基因PLAC4存在单核苷酸多态性,对于杂合的整倍体胎儿,SNP的A/G等位基因应在胎儿基因组中相等地表达1∶1的A/G,而在21-三体胎儿中,SNP等位基因之一的拷贝异常(A/GG),将产生2∶1或1∶2的比率关系。基于此,Lo等[25,26]通过位于PLAC4 mRNA上SNP位点的等位基因比例关系检测21-三体胎儿,但该方法只适用于2个不同等位基因构成的杂合子检测;cff-DNA/m RNA的特异性标记能针对少数的SNP位点或DNA甲基化差异位点进行检测,Y染色体特异性靶位点只能应用于男性胎儿,且只能分析杂合SNP[27]。高通量测序和dPCR的使用促进了无创产前检测胎儿染色体非整倍体的发展。
2 高通量测序无创产前检测胎儿染色体非整倍体
高通量测序无创产前检测胎儿染色体非整倍体是基于母体血浆中的cff-DNA进行大规模平行基因组测序,并结合生物信息学工具,分析胎儿染色体数目异常时相应的游离DNA数量的微小差异,进而评估胎儿的染色体非整倍体情况[6,28]。常用的高通量测序技术包括全基因组大规模平行测序和靶向测序。前者为全基因组的低深度测序,随机地测序游离DNA片段,读段序列被映射到人类全基因组参考序列图谱上定位到染色体;后者选择性地对染色体基因组上某特定区域扩增后测序,能够增加通量并降低测序成本[29]。基于高通量测序的检测平台包括BGISEQ-100(1000)、Illumina HiSeq 2000、BioElectronSeq4000、MaterniT21 PLUS、NextSeq CN500等,通过结合生物信息学工具以评估胎儿染色体非整倍体情况。常见的评估标准是基于Z检验的方法。Z检验是利用大量的测序数据符合正态分布,进而比较某2个染色体的有效测序数据平均数的差异是否显著[30]。根据统计学原理计算得到Z值(Z-score)并拟设评估胎儿染色体非整倍体风险的参考阈值,以判断非整倍体高风险或低风险,基于不同测序平台的Z值可能不同。
2.1 高通量测序无创产前检测的影响因素 高通量测序无创产前胎儿染色体非整倍体作为一项筛查测试,可能会出现假性结果(与染色体核型分析结果或与胎儿出生后随访结果不一致)。影响因素可能来自母体或胎儿的生物学因素,同时,高通量测序无创产前检测的流程复杂,在标本处理、文库制备、测序以及生物信息学分析等环节的多种因素均可能导致检测失败或检测结果不准确[31,32]。
2.1.1 cff-DNA分数和生物学影响因素 孕妇血浆中cff-DNA含量是影响无创产前检测准确性的关键因素。cff-DNA占母体血浆总游离DNA比例被称为胎儿分数或胎儿比例,以百分比表示。高通量测序无创产前检测要求的最小胎儿分数因不同的方法而异,但随着胎儿分数降低,检出率下降[33]。目前建议用于高通量测序检测的孕妇血浆中的胎儿分数大于4%[34]。研究表明,当孕妇外周血胎儿分数低于4%时,测序可能无结果或会出现假阴性结果[35]。胎儿分数受孕周、孕妇肥胖等影响,是一个重要的质控指标[18,19]。在无创产前检测中,富集cff-DNA有利于减少母体游离DNA的背景干扰,已有研究者开发了基于凝胶电泳的方法来富集cff-DNA,以提高胎儿非整倍体无创产前检测的准确性[36]。
其他内在的生物因素包括:①限制性胎盘嵌合体(confined placental mosaicism,CPM),是指胎盘与胎儿之间存在核型差异。由于母体血浆中的cff-DNA主要来自于胎盘滋养层细胞,当胎儿与胎盘染色体表现不一致,造成胎儿非整倍体检出结果为假阳性或假阴性,即检测结果未显示胎儿的真实情况[37]。②双胞胎的游离DNA含量无法估算,当出现双胎之一存在染色体非整倍体的现象时,无法估算孕妇血浆中的cff-DNA含量或估算值比实际单胎的大,导致检出结果与被“遮盖”的胎儿情况不符[38]。③母体染色体嵌合现象即母体的非整倍体性低比例嵌合[39],以及母体拷贝数失衡[40]。实际上,基于全基因组测序的无创产前检测能检测21-三体、18-三体、13-三体综合征外,其他染色体数目异常和部分染色体缺失重复的信息也可能检测到,如性染色体非整倍体(sex chromosome aneuploidies,SCAs)、基因组拷贝数变异(copy number variations,CNVs)等。但测序检测是基于总的游离DNA进行,无法区分母体游离DNA与cff-DNA,当出现母体非整倍体低比例嵌合以及母体拷贝数失衡情况时,均可能引起胎儿染色体非整倍体检测的假阳性结果,即与胎儿核型分析结果不一致。④其他可能,如母体恶性肿瘤等[41]。高通量测序无创产前检测胎儿染色体非整倍体可能会出现一定假阴性率和假阳性率,其阴性结果(低风险)不能总是保证胎儿正常,对于阳性结果(高风险)需要通过有创产前诊断进行验证[8]。
2.1.2 测序以及数据分析影响因素 对孕妇血浆标本的分析前处理是成功进行游离DNA测序分析是关键的步骤,包括血液采集、血浆制备、血浆质量控制(游离DNA的均匀性和纯度)以及储存和运输等[42-44]。基于高通量测序平台的主要流程包括游离DNA提取、文库构建、上机测序以及生物信息学分析,每一个环节的质量控制均会影响后续操作以及测序结果的精确度,如DNA提取效率,测序DNA文库浓度等[7,30]。为降低在不同的实验平台进行游离DNA提取定量、文库的定量和质量控制时出错的风险,研究人员开发了可直接在检测中定量cff-DNA分数的工具,包括Seq FF、SANEFALCON、BAYINDIR、DEFRAG等。其中,DEFRAG和BAYINDIR是基于Y染色体的方法,仅适用于怀有男胎的孕妇[45]。高通量测序的核心是把测序所得的序列比对到人类参考基因组,通过计数每个染色体的唯一对应的序列数量来获取全染色体拷贝数情况。因此,测序有效数据量、唯一比对序列数等也是控制数据质量的重要元素[30]。
GC含量是指样本有效序列中鸟嘌呤(Guanine,G)和胞嘧啶(Cytosine,C)碱基对所占的比率。测序文库构建通常需要进行PCR扩增,PCR扩增过度会导致产生重复序列。同时,GC含量对PCR扩增也会产生影响,GC含量过高或者过低的基因组区域扩增较困难,导致测序数据出现偏差[46]。测序过程中,GC含量为40%~50%时测序读取覆盖度较高,GC含量过高或者过低时覆盖度降低,这一性质称为GC偏倚[47]。GC偏倚是影响数据分析质量的关键因素,在文库制备(接头连接,PCR扩增)以及测序过程均可能引入GC偏倚。Dineika等[32]描述了通过减少GC偏倚和更好地处理基因组重复序列来改善测序数据质量的方法。Strom等[48]证明通过GC偏倚校正和统计学处理可以提高高通量测序无创产前检测的阳性预测值。
2.2 高通量测序无创产前检测的质量控制 孕妇血浆中cff-DNA低丰度性质、影响cff-DNA含量变化因素的个体性和复杂性,以及在样品制备、测序和分析过程中引入的技术误差,这些不确定性使得对高通量测序的假阴性和假阳性结果的解释具有挑战性。通过建立和使用高通量测序无创产前检测胎儿染色体非整倍体的参考物质进行质量控制,有助于校准测序数据和评估检测性能[49]。理想的参考物质应可能地模拟孕妇血浆中游离DNA的组成和片段长度、分布等特征,为高通量测序无创产前检测胎儿染色体非整倍体的标准化提供物质基础[50,51]。现有参考物质主要有2种形式:临床样本来源的母体血浆参考品以及人工制备的片段化基因组DNA参考品。
临床样本来源的天然母体血浆是理想的参考物质,但来源有限。实现体外制备模拟人体血浆中游离DNA的参考物质的方法主要有2种:超声打断和酶切消化。临床检验中心采用超声打断21-三体、18-三体以及13-三体的人基因组DNA与正常非妊娠女性的血浆混合,制备了模拟游离DNA的参考物质,用于高通量测序无创产前检测染色体非整倍体的室间质量评价[52]。与完整的基因组DNA不同,在孕妇血浆中的游离DNA是短片段分子,其中cff-DNA主要来自于胎盘滋养层细胞凋亡末期的DNA片段,母体血浆中的游离DNA长度分布主峰为166bp,并具有以10bp递减的分布规律[53]。超声打断的方法获得片段化DNA与天然血浆中的游离DNA的长度(约100~200bp)、组成、分布等特征不完全一致;此外,一些测序检测平台进行生物信息学分析时是基于游离DNA片段大小分布来计算cff-DNA分数,超声打断的片段化DNA参考物质不适用于此类原理测序平台的评估[51,54]。2018年,美国病理学家学会使用临床收集的怀有2l-三体、18-三体、13-三体胎儿的孕妇血浆样本进行室间质量评价,但由于来自于同一孕妇的血浆样本有限,无法保证给参与实验室提供相同的参考物质,同时,他们也采用了人工制造的参考物质进行室间质量评价,实验室测试结果显示该参考物质样本的性能不如常规临床样本,且不适用于所有实验室;他们表示临床样本来源的母体血浆是现有参考物质的最好选择[51]。
利用核酸酶消化细胞核所得DNA片段与真实的血浆样本游离DNA特征更符合[50,55]。最近,Zhang等利用酶消化细胞核的方法制备了血浆游离DNA参考物质:首先进行细胞系的培养,包括母亲为正常染色体的细胞、胎儿为21-三体、18-三体、13-三体以及正常染色体的细胞,然后提取细胞核,利用酶消化得到产物,按梯度分数进行混合即完成片段化DNA混合物的制备,随后为模拟真实孕妇血浆中的游离DNA环境,依据真实血浆组成成分制备了人工血浆,将两者混合,建立了模拟血浆游离DNA的参考物质[50]。其中,采用核酸酶(DFF和MNase)分别消化母系细胞核和胎儿细胞核以产生大小为160bp和140~150bp的DNA片段,以尽可能的模拟天然母体血浆中cff-DNA和母体游离DNA的大小分布特征。类似的,Jonatan等[55]使用具有亲缘关系的女性及其21-三体后代的永生化细胞系(EBV病毒诱导永生化的人B淋巴细胞),通过提取DNA,酶消化处理(150~200bp),再与人工血浆混合,制备了无创产前检测参考物质。酶消化处理DNA片段化与人工血浆混合所得的模拟天然血浆与母体血浆环境仍有差别。目前还未完全清楚游离DNA如何产生,这与体内复杂的酶作用有关联,体外酶消化和生理环境中复杂酶作用也不一致[56]。
为高通量测序无创产前检测胎儿染色体非整倍体提供合适的参考物质的主要挑战和问题包括:使用孕妇血浆制备参考物质受临床来源所限;人工制备参考物质需要考虑是否具有与真实游离DNA相似的特征,同时尽可能多的适应不同的测序平台;人工血浆与母体血浆基质具有一定差异;酶消化细胞核的DNA片段产物需要考虑碱基序列组成的GC含量是否与孕妇血浆中游离DNA相似,以避免在测序过程中受GC偏倚的影响。
3 数字PCR无创产前检测胎儿染色体非整倍体
数字PCR是检测和定量核酸的新技术[57]。其工作原理在于通过有限稀释,使单个PCR反应微室中包含或不包含单个模板DNA分子,结合特异性的荧光探针,进行平行扩增反应,通过阳性反应(显示荧光信号)的数量和泊松分布统计即可测定原始样本中DNA模板分子的数量。在无创产前检测胎儿染色体非整倍体应用中,利用数字PCR具有单分子灵敏度和绝对定量的能力,通过直接定量目标染色体和参考染色体,计算两者拷贝数比值即可判断非整倍体情况[9,10]。整倍体胎儿和非整倍体胎儿的比值应分别为1和高于1,这一程度取决于母体血浆中cff-DNA分数,例如当母体血浆中21-三体胎儿的游离DNA分数为10%时,理论比值约为1.05。数字PCR检测非整倍体实验原理和主要操作参考图1。

图1 数字PCR检测染色体非整倍体实验原理和主要操作说明图,改编自参考文献[11]
3.1 数字PCR无创产前检测的优势 数字PCR无创产前检测胎儿非整倍体流程简单,可直接获取数据:提取游离DNA与数字PCR反应试剂混合(包含用于目标染色体和参考染色体中的靶DNA分子的引物和探针),随后进行PCR扩增,读取发出荧光信号的单元数进一步确定靶DNA分子的拷贝数,通过泊松分布结合cff-DNA分数计算比值并判断[11]。数字PCR基于“分而治之”,将单分子通过稀释分离并独自扩增,这样先分离后放大的效果有利于降低本底信号(母体游离DNA)的影响,从而提高了对低丰度靶DNA分子(cff-DNA)的检测灵敏度。高通量测序无创产前检测胎儿染色体非整倍体在临床上的普遍筛查应用存在一定限制:如测序成本较高,采样和获得结果之间需要1~2周的检测周期等。与之相比,数字PCR无创产前检测具有流程简单,对设备的要求相对较低,检测耗时短,所需的设备和试剂的成本低的优势。目前的研究工作证明数字PCR能实现准确、快速、简便的无创产前检测胎儿染色体非整倍体[11-13]。林文楚[58]等开发了基于数字PCR的检测试剂盒,使用孕妇外周血,约5h完成对1个样本无创产前检测,其成本约为高通量测序无创产前检测的1/5。
3.2 数字PCR无创产前检测的研究进展 在早期研究中,Fan等[10]证明利用数字PCR定量检测可以判断21号染色体非整倍体异常:使用21-三体细胞系基因组DNA和人细胞系基因组DNA的混合物,结合特异性荧光探针标记21号染色体和12号染色体(参考染色体)进行扩增反应,结果显示两者拷贝数比值大于1(正常为1。随后的研究表示为在临床上可靠的检测母体血浆中低丰度的cff-DNA,需要进行数千至数万PCR反应[9,10,13]。随着微控流技术的引入,数字PCR实现了高通量,自动化的快速发展,在无创产前检测中表现出优良的技术性能[59,60]。
基于微滴式数字PCR(droplet digital polymerase chain reaction,dd PCR),可以实现自动化反应混合物的制备和液滴的产生,可以进一步提高测试的效率和通量。同时,在多重数字PCR中,通过设计不同引物,即可在一次PCR反应同时对多个靶基因进行特异性扩增,提升检测效率。El Khattabi等的[13]建立微滴式数字PCR无创产前检测21-三体,采用水解探针对4个靶基因标记,对213例孕妇血浆游离DNA进行定量检测,结果显示特异性为98%,敏感性为94%。Lee等[12]利用大小分级的方法来提高cff-DNA分数,并设计数字PCR无创产前检测胎儿21-三体,共测试877名孕妇血浆样品,结果显示其灵敏度为100%,特异性为99.64%,准确度为99.66%。随着PCR反应数增加,多重数字PCR的引物和探针设计也更加复杂。考虑到大量特异性探针会产生高背景荧光,影响阳性反应信号的检测,Tan等[11]建立了基于锁核酸通用型探针(locked nucleic acid-Taq Man,LNA-Taq Man)的多重微滴式数字PCR,用于无创产前检测胎儿染色体非整倍体(21-三体),成功鉴定了30份临床血浆标本的三倍体情况,检测结果与高通量测序完全一致,每个样本约4.5h完成测试。其中,锁核酸(locked nucleic acid,LNA)是一种核酸类似物,与DNA有很好的亲和活性,将LNA参入到探针中可以提高对目的序列的亲和力同时可以提高探针的Tm值,进而使探针设计的更短,有利于检测短的DNA片段,提高检测的灵敏度。表2总结了上述3个基于微滴式数字PCR进行无创产前检测胎儿染色体非整倍体的实验设计信息。

表2 基于数字PCR进行无创产前检测胎儿染色体非整倍体
基于现有研究提示,可以得出以下经验:为提高数字PCR无创产前检测的准确度和可靠性,在游离DNA的量确定的情况下,可以增加引物对的数量,以增加数字PCR检测到的目标DNA分子的量;引物选择应避免引物对之间的相互作用[11]。对于较低cff-DNA分数的样品,可以富集cff-DNA[12]。通过建立灰度区(在检测中考虑为数据波动导致无法给出明确的高风险或者低风险结果建立的阈值范围),灰区内的样本结果通过再测试来获得准确的结果[11,13]。引物和探针的设计可以选择目标染色体和参考染色体上的保守序列,在此基础上筛选易于扩增、稳定性好,GC含量适中的序列[58]。
4 总结与展望
2016 年,我国出行了孕妇外周血胎儿游离DNA产前筛查与诊断相关规定,临床已经开始使用基于高通量测序的无创产前胎儿染色体非整倍体筛查检测项目。随着大规模平行测序技术的应用逐步进入临床,无创产前检测的质量控制和标准化也越来越重要。基于cff-DNA的研究主要集中在各种检测方法和测试的发展方面,对质量控制和标准化的研究关注较少。制定参考标准有助于提高临床诊断的准确性、可靠性以及标准化。数字PCR是检测和定量核酸的新技术,近期的研究表明数字PCR无创产前检测胎儿染色体非整倍体可以实现高灵敏度的实时检测且更具成本效益,随进一步研究发展有望用于常规临床检测。
