侵染广西红宝石青柚的柑橘褪绿矮化相关病毒遗传进化分析
2021-02-09李战彪刘丽辉崔丽贤陈锦清朱英芝李霁轩谢慧婷秦碧霞蔡健和
李战彪 刘丽辉 崔丽贤 陈锦清 朱英芝 李霁轩 谢慧婷 秦碧霞 蔡健和


摘要:【目的】明确引起广西多地泰国红宝石青柚产生叶片变形、扭曲、皱缩、褪绿花叶和矮化症状的病原,为有效防治该病害提供理论依据。【方法】从广西多地采集疑似发病的红宝石青柚叶片样品,利用柑橘褪绿矮化相关病毒(Citrus chlorotic dwarf-associated virus,CCDaV)特异引物进行PCR检测,通过分段扩增、克隆等方法对样品进行鉴定并获取全长基因序列,運用RDP5和MEGA 7.0对所获得的全长基因序列进行重组及遗传多样性分析。【结果】PCR检测结果显示采集的红宝石青柚叶片样品可扩增出642 bp的目的条带,证实红宝石青柚受到CCDaV感染;采用分段克隆的方法获得LA-1、LA-2、WM-1、GG-1、GG-2、WZ-1和WZ-2等7个各地代表分离物的全长序列,序列长度分别为3641、3642、3642、3640、3642、3644和3644 bp;核苷酸相似性比对发现,7个分离物间的核苷酸相似性在98%以上,与GenBank已登录的CCDaV各分离物间的核苷酸相似性在99%以上,说明研究获得的病毒分离物为CCDaV的分离物;重组分析发现,7个分离物未发生重组。系统发育进化树分析结果显示,研究获得的WZ-1和WZ-2分离物分别与Tha1-19、Tha30处于同一个小分支,说明这2个分离物与Tha1-19和Tha30具有较近的亲缘关系;其余几个分离物则分处不同的小分支,说明CCDaV广西分离物间仍有一定的进化多样性。【结论】引起广西红宝石青柚叶片呈V字型、皱缩、卷曲、褪绿花叶和植株严重矮化等症状的病原为CCDaV,部分地区分离物存在地域多样性。
关键词: 柑橘褪绿矮化相关病毒;红宝石青柚;遗传进化;广西
中图分类号: S432.1 文献标志码: A 文章编号:2095-1191(2021)10-2758-07
Abstract:【Objective】To clarify the pathogen of the Ruby green pomelo showing symptoms of leaf deformation, curling, shrinking,chlorotic and dwarfing, and provide a theoretical basis for effective prevention and treatment of the disease.【Method】 Several leaf samples were collected from suspected Ruby green pomelo in some cities of Guangxi, and two pairs of specific primers of Citrus chlorotic dwarf-associated virus(CCDaV) were designed and used for detected the suspected samples, the full-length of genome sequence were obtained by segmented amplification and gene cloning. RDP5 and MEGA 7.0 softwares were applied for analyze the recombination and the genetic diversity of the full length genome. 【Result】PCR with expected size of 642 bp were obtained from all of the collected Ruby green pomelo samples, which confirmed that all of the samples were infected by CCDaV. The full-length genome sequences of seven locations representing isolates LA-1, LA-2, WM-1, GG-1, GG-2, WZ-1 and WZ-2 were obtained by using segmented amplification and gene cloning, and the full-length sequences of the seven isolates were 3641, 3642, 3642,3640, 3642, 3644 and 3644 bp, respectively. The nucleotide sequence identities between the seven isolates were over 98%, and the identities against other CCDaV isolates available in GenBank were over 99%, this results showed that the seven isolates obtained in this research were CCDaV isolates. Recombination analysis showed that no recombination occurred in the seven isolates. Phylogenetic analysis showed that two CCDaV Guangxi isolates(WZ-1 and WZ-2) clustered with Tha1-19 and Tha30 in a sub-clade, indicating their close relation. The other isolates of Guangxi were distributed in different sub-clade, indicating that there were evolutionary diversity among the CCDaV Guangxi isolates. 【Conclusion】 CCDaV is the pathogen that infects the Ruby green pomeloshowing symptoms of V shape, shrinking, curling, chlorotic and dwarfing, and there is regional diversity of the isolates among different regions.
Key words:Citrus chlorotic dwarf-associated virus; Ruby green pomelo; genetic and evolutionary; Guangxi
Foundation item:Guangxi Innovation Driven Development Special Fund Project(GuikeAA18118046-1,GuikeAA18 118046-5); Basic Research Project of Guangxi Academy of Agricultural Sciences(Guinongke 2021YT071)
0 引言
【研究意義】近年来,我国柑橘产业发展迅猛,特别是在广西,柑橘产业已成为带动地区脱贫、农村就业的支柱产业。但柑橘产业快速发展也带来了诸多问题,病虫害的区域间发生流行已成为不可忽视的问题。随着柑橘种植面积不断扩大和新品种引进种植,区域间种苗调运频繁,由于难于监管,导致多种病虫害通过种苗携带传播流行,并造成严重危害,其中,病毒病害尤其突出。本研究团队2019年发现新引种的红宝石青柚上发生一种疑似新的病毒病害,对广西柑橘产业存在潜在威胁,而明确该病害的病原可为该病害流行规律及防控技术研究提供指导。【前人研究进展】柑橘病毒病是一类严重影响柑橘产量及质量的重要病害。目前世界上已报道的柑橘病毒及类病毒有30余种(吴佳星,2020);在我国,柑橘生产上主要的病毒有11种:柑橘衰退病毒(Citrus tristeza virus,CTV)、柑橘碎叶病毒(Citrus tatter leaf virus,CTLV)、温州蜜柑萎缩病毒(Satsuma dwarf virus,SDV)、柑橘裂皮病毒(Citrus exocortis viroid,CEVd)、柑橘黄脉病毒(Citrus yellow vein clearing virus,CYVCV)、柑橘褪绿矮化相关病毒(Citrus chlorotic dwarf-associated virus,CCDaV)、柑橘叶斑驳病毒(Citrus leaf blotch virus,CLBV)、柑橘树皮裂纹类病毒(Citrus bark cracking viroid,CBCVd)、柑橘鳞皮病毒(Citrus psorosis virus,CPsV)、柑橘类病毒V(Citrus viroid V,CVdV)和柑橘类病毒VI(Citrus viroid V,CVdVI)(张艳慧等,2017)。其中,柑橘褪绿矮缩病是近年来新发生的柑橘病毒性病害,其病原是柑橘褪绿矮化相关病毒(Korkmaz et al.,1995; Kersting et al.,1996; Loconsole et al.,2012)。CCDaV基因组为单链DNA,属于双生病毒科(Geminiviridae),主要通过嫁接、刀割和杨梅粉虱(Parabemisia myricae Kuwana)进行传播;该病毒可侵染大多数的柑橘类作物,早期症状出现在春季的嫩叶上,主要症状特征包括叶片呈现V字型,同时伴随有叶片变形、扭曲、花叶和节间变短等症状,严重影响柑橘产量和质量(Korkmaz et al.,1995; Richard et al.,2008; Loconsole et al.,2012)。20世纪80年代末期,该病害最早发生于土耳其的地中海区域,给土耳其柑橘产业造成极大危害,特别是葡萄柚,产量损失超过50%以上(Korkmaz et al.,1995; Kersting et al.,1996; Loconsole et al.,2012)。2008年,在我国云南瑞丽一个酸橙果园上首次发现该病害,但发病率较低,未引起广泛关注(Guo et al.,2015)。2017年,Zhou等对该病在我国的分布进行调查,结果发现CCDaV仍只发生在我国的云南省。2020年,Yang等在泰国也发现并报道了该病。前人的研究结果证实,柑橘褪绿矮化病正在向全世界的柑橘产区扩散蔓延,应引起重视。【本研究切入点】近年来,广西柑橘产业发展迅猛,新品种泰国红宝石青柚在广西得到迅速推广种植。2019—2020年,本研究团队在广西南宁、贵港等多地柑橘育苗场和果场走访、调查,发现泰国红宝石青柚存在叶片变形、扭曲皱缩、褪绿花叶和矮化等疑似CCDaV病毒感染症状,发病率高达10%~15%,但引发该类症状的病原尚未明确。【拟解决的关键问题】利用分子生物学手段对疑似柑橘褪绿矮缩病病样进行检测、鉴定,明确引发该类症状的病害病原,并通过分段克隆的方法获取相关病毒病原的全序列基因组,运用RDP和MEGA等软件分析该病毒病原的来源和进化规律,为红宝石青柚上柑橘褪绿矮缩病的防控打下理论基础。
1 材料与方法
1. 1 试验材料
2019年11月—2020年11月,分别从广西梧州市藤县太平镇(东经23°39′14″,北纬110°42′37″)(6个叶片样品)、南宁市隆安县那桐镇浪湾农场(东经23°05′06″,北纬107°54′19″)(10个叶片样品)、贵港市覃塘区大岭镇(东经22°53′38",北纬109°32′45″)(4个叶片样品)和港南区木格镇(东经22°47′45″,北纬109°44′)(5个叶片样品)、南宁市武鸣区府城镇(东经23°15′06″,北纬108°07′57″)(10个叶片样品)和太平镇(东经23°08′02″,北纬108°22′34″(6个叶片样品)等地采集疑似感染CCDaV的红宝石青柚叶片样品,叶片样品保存于-20 ℃备用。
1. 2 DNA提取
取柚子叶片样品100 mg,用Ezup柱式植物基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司]提取叶片总DNA。具体操作按照试剂盒说明书进行。最后将DNA沉淀溶解于50 μL ddH2O中, -20 ℃保存备用。
1. 3 PCR检测
参考NCBI中已登录的CCDaV全基因序列(登录号NC_018151、MN509442.1、MG566055.1和KX840470.1等),设计可扩增CCDaV部分基因序列的特异PCR引物,CCDaV-F:5'-GGACAATATGGG ACAAGCCGTG-3'/CCDaV-R:5'-GGATCGTATGG GCCACAGACC-3',目的条带大小约为642 bp;以健康柚子叶片总DNA为阴性对照进行PCR扩增。反应体系20.0 μL:总DNA 1.0 μL,10 μmol/L上、下游引物各0.5 μL,2×Taq Master Mix (Dye)(康为世纪生物科技有限公司)10.0 μL,ddH2O 8.0 μL。菌落PCR反应体系10.0 μL:10 μmol/L上、下游引物CCDaV-F/CCDaV-1047R(CCDaV-1047R:5'-AACACAAATC TAACGGCCTCAGG-3')或CCDaV-1047F(CCDaV-1047F:5'-CAGTGCGTGGTCGTTGTAGTCG-3')/CCDaV-R各0.5 μL,2×Taq Master Mix (Dye)(康为世纪生物科技有限公司)5.0 μL,ddH2O 4.0 μL,灭菌牙签挑取菌落作为模板溶解于PCR反应体系中。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,54 ℃ 45 s,72 ℃ 30 s或72 ℃ 3 min,进行35个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测。
1. 4 全基因序列扩增
以PCR检测为阳性的柚子叶片总DNA为模板,利用CCDaV-F/CCDaV-1047R或CCDaV-1047F/CC DaV-R分段扩增CCDaV各分离物的全基因序列,反应体系20.0 μL:总DNA 1.0 μL,10 μmol/L上、下游引物各0.5 μL,2×Phanta Max Master Mix(Dye Plus)(南京诺唯赞生物科技股份有限公司)10.0 μL,ddH2O 8.0 μL。所得PCR产物经1%琼脂糖凝胶电泳检测后进行切胶纯化。
1. 5 基因克隆及序列分析
利用SanPrep柱式DNA胶回收试剂盒(生工生物工程(上海)股份有限公司)回收PCR产物,将经回收纯化的PCR产物连接至pEASY-Blunt Cloning Kit(北京全式金生物技术有限公司)中的克隆载体上;连接产物转化大肠杆菌DH5α感受态细胞,采用菌落PCR的方法筛选3个阳性克隆委托生工生物工程(上海)股份有限公司进行序列测定。所得序列经Vector NTI 11.0进行拼接后,使用NCBI的ORF Finder程序进行开放读码框(Open reading frames,ORF)预测;利用MEGA 7.0的最大似然法(Maximum likelihood,ML)构建系统发育进化树,步值设置为1000;利用RDP5中的RDP、GENECONV、Chimaera和MaxChi进行重组分析。
2 结果与分析
2. 1 泰国红宝石青柚病样症状及PCR检测结果
2019—2020年,本课题组在广西南宁、贵港等多地柑橘育苗场和果场走访、调查,发现泰国红宝石青柚的叶片呈V字型、皱缩、卷曲、褪绿花叶、植株严重矮化等,疑似CCDaV病毒感染症状(图1),发病率高达10%~15%。采集疑似病毒感染的柚子叶片样品,利用柑橘褪绿矮化相关病毒特异引物CCDaV-F/CCDaV-R对青柚叶片总DNA进行PCR检测,结果发现,广西梧州市藤县(6个叶片样品)、南宁市隆安县(10个叶片样品)、贵港市(8个叶片样品)、南宁市武鸣区府城镇(10个叶片样品)和太平镇(4个叶片样品)等地的柚子叶片样品均可扩增出642 bp的目的条带(部分检测结果见图2),而健康柚子叶片对照则无相应扩增;将PCR产物回收纯化后直接测序,所得序列在NCBI中进行BLASTn分析,结果发现本研究所得序列与NCBI已报道的CCDaV各分离物序列核苷酸相似性均在99%以上,说明所采集的青柚叶片感染了CCDaV病毒。
2. 2 病毒分离物基因组全序列克隆及分析结果
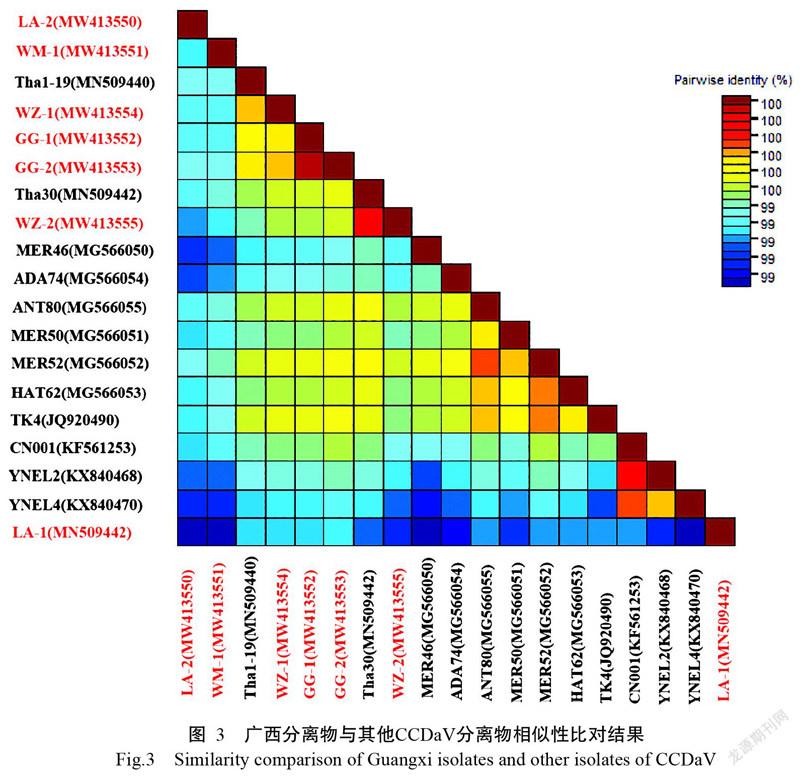
前期尝试利用RCA试剂盒扩增病毒的全序列,但常用的内切酶进行酶切后电泳均得不到目的片段为3.6 kb的电泳条带,遂采用分段扩增的方法对所采集的柚子叶片总DNA进行扩增,以期能获得CCDaV各分离物的全基因序列。挑选7个有代表性的柚子DNA利用CCDaV-F/CCDaV-1047R和CCDaV-1047F/CCDaV-R两对引物组合进行扩增,产物经电泳、回收纯化后连接至pEASY-Blunt Cloning Kit中的克隆载体上,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆子进行序列测定。所得序列经拼接比对后发现,共获得LA-1、LA-2、WM-1、GG-1、GG-2、WZ-1和WZ-2等7个各地代表分离物的全长序列分别为3641、3642、3642、3640、3642、3644和3644 bp(GenBank登录号分别为:MW413549、MW413550、MW413551、MW413552、MW413553、MW413554和MW413555),两两序列间的核苷酸相似性均在98%以上,可认定为同一病毒的不同分离物。
进一步分析7个分离物的分子特征,发现7个分离物中的3个分离物(LA-1、LA-2和WM-1)编码5个ORF,而其余4个分离物则编码4个ORF。其中LA-1、LA-2、WM-1、GG-1、GG-2、WZ-1和WZ-2等7个分离物正链均编码V2蛋白[运动蛋白(Movement protein,MP),LA-1:195~614 nt、LA-2:195~614 nt、WM-1:194~613 nt、GG-1:195~614 nt、GG-2:195~614 nt、WZ-1:195~614 nt和WZ-2:197~616 nt]、V1蛋白[外壳蛋白(Coat protein,CP),LA-1:418~1182 nt、LA-2:418~1182 nt、WM-1:417~1181 nt、GG-1:418~1182 nt、GG-2:418~1182 nt、WZ-1:418~1182 nt和WZ-2:420~1184 nt]和V3蛋白(運动蛋白,LA-1:1212~2132 nt、LA-2:1213~2133 nt、WM-1:1213~2133 nt、GG-1:1213~2133 nt、GG-2:1213~2133 nt、WZ-1:1214~2134 nt和WZ-2:1215~2135 nt),互补链均编码类Rep蛋白[(RepA-like protein),LA-1:2612~3421 nt、LA-2:2613~3422 nt、WM-1:2613~3422 nt、GG-1:2611~3420 nt、GG-2:2613~3422 nt、WZ-1:2614~3423 nt和WZ-2:2615~3424 nt];LA-1、LA-2和WM-1的互补链编码1个类C1:C2蛋白[(C1:C2 like protein),LA-1:2301~2708 nt、LA-2:2302~2709 nt、WM-1:2302~2709 nt],而GG-1、GG-2、WZ-1和WZ-2在其相应编码区域存在多个终止密码子,无法形成完整的ORF。
将本研究获得的基因序列利用NCBI中BLASTn工具与GenBank已报道的病毒序列进行比对分析,发现广西的7个分离物与GenBank中已报道的各CCDaV分离物序列具有较高的核苷酸相似性。进一步利用SDT软件进行比对分析,发现广西分离物的核苷酸序列与用于分析的各CCDaV分离物的核苷酸相似性均在99%以上(图3)。
2. 3 CCDaV广西分离物的重组及进化分析结果
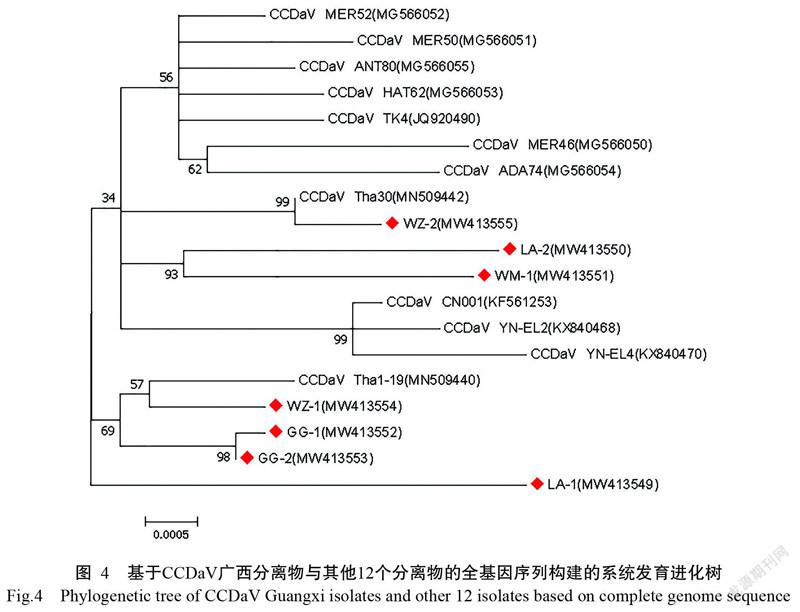
为分析CCDaV是否存在重组,挑选TK4和CN001作为参考基因序列利用RDP5中的RDP、GENECONV、Chimaera和MaxChi进行重组分析,结果发现CCDaV尚未有重组事件发生。
为分析CCDaV广西分离物与已报道的CCDaV各分离物的亲缘关系,利用MEGA 7.0将广西分离物与12个CCDaV分离物构建系统发育进化树,最大似然法构建的进化树为最优树(图4)。从图中可看出,广西各分离物处于不同的分支,其中WZ-2与泰国分离物Tha30处于同一分支,说明其与Tha30亲缘关系较近;WZ-1、GG-1、GG-2和Tha1-19同处于一个大分支,说明与Tha1-19亲缘关系较近,而WZ-1与泰国分离物Tha1-19又处于一个小分支,说明WZ-1与Tha1-19的亲缘关系更近;LA-2与WM-1处于同一分支,说明二者间亲缘关系较近;而LA-1则独立处于一个小分支,进化来源可能与其他分离物存在差异,说明CCDaV广西分离物间仍有一定的进化多样性。
3 讨论
柑橘褪绿矮缩病是一种危险性柑橘病毒病害,已给土耳其柑橘产业带来极大危害,且可能对全世界柑橘产业产生潜在威胁(Kersting et al.,1996; Richard et al.,2008)。在我国,该病害最早于2008年在云南瑞丽被发现并报道,但多年间并未扩展蔓延。本研究利用分子生物学技术获得侵染广西红宝石青柚的病毒基因组序列,通过分析其分子特征及进化关系,发现广西分离物具有CCDaV病毒基因组的典型分子特征,且与其他已报道的CCDaV分离物的核苷酸相似性均在99%以上,可认定为CCDaV的分离物(Loconsole et al.,2012)。研究也发现,广西分离物进化较保守,且存在一定的地域分布特征,与Karanfil和Korkmaz(2019)、Yang等(2020)的研究结果一致。调查发现广西区内的红宝石青柚均为泰国引种,而广西分离物呈现的地域分布特征可能与引种地不同相关,具体原因有待进一步探究。
Loconsole等(2012)通过小RNA测序证实CCDaV是单链DNA病毒,并且认为其编码5个ORF。而本研究中GG-1和GG-2在2302~2708 nt,WZ-1、WZ-2在2303~2709 nt和2304~2710 nt区域则存在多个终止密码子,无法形成完整的ORF。通过将上述序列与GenBank已登录的相应序列进行比对分析,发现这些序列在该区域的相似性高达99%以上(数据未显示),且均存在多个终止密码子,因此,该区域是否编码完整的ORF仍有待进一步证实。如果该区域无法完整编码ORF,那么CCDaV是否仍然是双生病毒科成员也是一个需要探讨的科学问题,仍需进一步研究证实。
柑橘褪绿矮缩病是一种较新的柑橘病毒病害,各方面研究仍不完善,前人研究表明该病可借助嫁接、刀割以及杨梅粉虱通过半持久或持久方式进行传播(Korkmaz et al.,1995),但Zhou等(2017)、Karanfil和Korkmaz(2019)分别就CCDaV在我国及土耳其的分布进行调查,发现该病害并未广泛传播;不同的是,杨梅粉虱在云南的种群较庞大,而在土耳其的种群较小,但无论种群大小,该病的传播流行并未呈现明显差别(刘曼等,2010;Zhou et al.,2017;Karanfil and Korkmaz,2019)。同时,Zhou等(2017)采集云南的杨梅粉虱进行分子鉴定,发现杨梅粉虱体内并未携带CCDaV,因此,杨梅粉虱是否能够传播CCDaV,其传播CCDaV的效率仍有待进一步研究,而是否存在其他潜在的传播介体也需要进一步研究证实。在我国江西、广东、浙江、四川和上海等地的柑橘产区均有杨梅粉虱分布(王向东和罗林军,2007;王炎,2007;沈颖等,2017;闫凤鸣和白润娥,2017),广西尚未有杨梅粉虱的相关报道;根据前期调查研究及分析推测,该病极有可能通过泰国红宝石青柚带病苗木在广西等地扩散蔓延,而广西是否存在杨梅粉虱、CCDaV是否会通过杨梅粉虱传播危害其他柚类等柑橘品种、是否存在其他潜在的传播介体帮助CCDaV在广西传播流行、是否对柑橘产业造成严重经济损失等问题都值得进一步关注及监测研究。
柑橘褪绿矮缩病危害较大,可侵染多数的柑橘类作物,仅甜橙具有一定抗性(Korkmaz et al.,1995),给柑橘产业带来极大的潜在威胁,因此,针对目前该病的防控,建议抓好如下几点:(1)严格苗木检测,培育健康苗木,严禁带病种苗出圃;(2)加強苗木调运检疫监管,防止带病苗木调运;(3)及时防治传播介体杨梅粉虱,切断传播途径。
4 结论
侵染广西红宝石青柚引起叶片呈V字型、皱缩、卷曲、褪绿花叶和植株严重矮化等症状的病原为柑橘褪绿矮化相关病毒;通过分析部分分离物的全基因序列,发现CCDaV广西分离物进化相对保守,但仍存在一定的地域多样性。
参考文献:
刘曼,王济红,任春光,向准,姚松林. 2010. 西南地区主要粉虱害虫的分布与危害[J]. 西南农业学报,23(3):728-734. [Liu M,Wang J H,Ren C G,Xiang Z,Yao S L. 2010. Distribution and damage of major whitefly pests in Southwest China[J]. Southwest China Journal of Agricultural Sciences,23(3):728-734.] doi:10.16213/j.cnki.scjas.2010.03.008.
沈颖,王华弟,汪恩国,黄茜斌,徐志宏. 2017. 杨梅粉虱的发生监测与防控技术[J]. 上海农业科技,(2):125-127. [Shen Y,Wang H D,Wang E G,Huang Q B,Xu Z H. 2017. Occurrence and control techniques of Parabemisia myricae (Kuwana)[J]. Shanghai Agricultural Science and Technology,(2):125-127.] doi:10.3969/j.issn.1001-0106. 2017.02.078.
王向东,罗林军. 2007. 攀西桑粉虱的形态研究[J]. 西南师范大学学报(自然科学版),32(3):121-125. [Wang X D,Luo L J. 2007. Study of the shape of Pealius mori (Takahashi) in Panxi area of Sichuan[J]. Journal of Southwest China Normal University(Natural Science Edition),32(3):121-125.] doi:10.13718/j.cnki.xsxb.2007.03.020.
王焱. 2007. 上海林業病虫[M]. 上海:上海科学技术出版社. [Wang Y. 2007.Forest pests and diseases in Shanghai[M]. Shanghai:Shanghai Scientific and Technical Publishers.]
吴佳星. 2020. 侵染柑橘的一种Mandarivirus属新病毒的鉴定及特性研究[D]. 重庆:西南大学. [Wu J X. 2020. Identification and characterization of a novel Mandarivirus in citrus[D]. Chongqing:Southwest University.] doi:10.27684/ d.cnki.gxndx.2020.002847.
闫凤鸣,白润娥. 2017. 中国粉虱志[M]. 郑州:河南科技出版社. [Yan F M,Bai R E. 2017. Whitefly fauna of China[M]. Zhengzhou:Henan Science and Technology Press.]
张艳慧,刘莹洁,金鑫,周彦. 2017. 我国柑橘近年新发生的病毒及类似病害研究进展[J]. 果树学报,34(9):1213-1221. [Zhang Y H,Liu Y J,Jin X,Zhou Y. 2017. Progress in study of new Citrus viruses and viroids diseases in China[J]. Journal of Fruit Science,34(9):1213-1221.] doi:10. 13925/j.cnki.gsxb.20170054.
Guo J,Lai X,Li J,Yue J,Zhang S,Li Y,Gao J,Wang Z,Duan H,Yang J. 2015. First report on Citrus chlorotic dwarf associated virus on lemon in Dehong prefecture,Yunnan,China[J]. Plant Disease,99(9):1287. doi:10.1094/ PDIS-01-15-0011-PDN.
Karanfil A,Korkmaz S. 2019. Geographic distribution and molecular characterization of Turkish isolates of the Ci-trus chlorotic dwarf-associated virus[J]. Journal of Plant Pathology,101(3):621-628. doi:10.1007/s42161-019-00250-5.
Kersting U,Korkmaz S,Cinar A,Ertuaul B,Nelge N,Garnsey S M. 1996. Citrus chlorotic dwarf,a new whitefly-transmitted disease in the eastern Mediterranean region of Turkey[J]. International Organization of Citrus Virologists Conference Proceedings,13(13):220-225.
Korkmaz S I A,Kersting U,Garnsey S. 1995. Citrus chlorotic dwarf:A new whitefly-transmitted virus like disease of citrus in Turkey[J]. Plant Disease,79:1074. doi:10.1094/PD-79-1074C.
Loconsole G,Saldarelli P,Doddapaneni H,Savino V,Martelli G P,Saponari M. 2012. Identification of a single-stranded DNA virus associated with citrus chlorotic dwarf disease,a new member in the family Geminiviridae[J]. Virology,432(1):162-172. doi:10.1016/j.virol.2012.06.005.
Richard B,David C,James William C,Patrick D C,Erzsébet D,Bärbel G,Olia Evtimova K,Gábor L,Alfons Oude L,David M,Charles M,Luisa M,Dionyssios P,Angelo Porta P,Jan S,Gritta S,Robert S,Anita S,Kari T,Johan Coert Van L,Irene V. 2008. Pest risk assessment made by France on Citrus chlorotic dwarf virus considered by France as harmful in the French overseas departments of French Guiana,Guadeloupe,Martinique and Réunion-Scientific opinion of the panel on plant health[J]. EFSA Journal,684:1-17. doi:10.2903/j.efsa.2008.684.
Yang Z,Zhang L,Zhao J F,Li T S,Liu Q Y,Cao M J,Zhou Y. 2020. First report of Citrus chlorotic dwarf-associated virus on pomelo in Nakhon,Thailand[J]. Plant Disease,104(4):2093. doi:10.1094/PDIS-10-19-2093-PDN.
Zhou Y,Zhang Y H,Liu Y J,Chen H M,Li T S,Zhou C Y. 2017. Distribution and molecular characterization of Citrus chlorotic dwarf-associated virus in China[J]. Australa-sian Plant Pathology,46(3):227-229. doi:10.1007/s13313-017-0480-5.
(責任编辑 麻小燕)
