“模型法”在化学中的应用及教学启示
2021-02-07陈廷俊
陈廷俊

关键词:模型法;化学模型;碰撞理论;自由基反应;原子结构;苯
化学模型可以帮助人们更好地从微观视角认识宏观物质,揭示物质结构和性质的内在联系,实现物质的转化和应用。纵观化学发展历程,正是化学家通过科学实验和理论计算,持续不断地建构与修正模型,才使得人们对物质形成与转化的内在规律认识得越来越清晰,也越来越接近科学本质。
1模型法对化学研究非常重要
模型(model)的拉丁文——modulus,指“样本、尺寸、标准”。吉尔伯特认为,除了物理模型之外,模型还包括思想、事件、概念、过程或系统等的表示”。。科学模型既是科学研究的产物,也是科学家赖以进行思维和探索未知的重要工具。从本体论来说模型是关于客观世界实体或者思想的表征,它通过对客观实体或思想的简化、抽象和理想化,进行科学解释和预测。从认识论来看,科学家不仅能够根据模型发现研究对象和系统的属性;而且还能把模型的相关知识转化为目标系统的知识。
模型法对化学研究非常重要。首先,它是化学知识的重要组成部分。揭示物质结构、化学原理和反应机理的各种化学模型,本身就是化学知识本质特征的抽象与简化,是人们认识和解释化学问题的重要工具。其次,它为人们学习和研究化学提供了较好的认知方式。人们通过模型法可以更加形象地认识物质的结构、性质及其规律,让复杂抽象的化学问题变得简单直观。第三,它促进了化学理论的形成与发展。化学理论是化学家在分析客观事实,猜想和假设基础上建立的理论模型,然后通过科学实验验证。化学家在解释客观事实的过程中检验模型的科学性,并根据新的证据来加以修正与完善,使化学模型无限可能地接近原型。现代化学研究越来越注重分子、原子等微观层面的变化,这就更需要运用模型法来研究物质所存在的复杂系统中的微观结构与变化规律。
2模型法在化学学科中的应用
2.1模拟与表征物质结构
经典化学结构模型是用元素符号和短线来表示物质的结构式,这种科学抽象的结构式通过原子价键来表现原子问的相互作用,比较直观形象地反映了分子的本质属性,成为代替分子原型来研究和预测物质性质非常适用的化学模型。然而,这种经典结构式在解释共轭分子、分子立体结构、配位理论等方面却遇到了困难,解决这些困难和挑战促进了经典结构理论的发展。如,范霍夫提出碳的四面体结构模型并运用它成功发现对映异构体,从而打破了价键只能反映原子空间连接顺序的局限性,成功地解释了分子存在立体结构的微观本质。
玻恩、朗德等人根据离子键模型计算出品格能的理论值与实验值比较接近,计算结果很好地证明了离子晶体的化学键本质。刘易斯提出“八隅体状态”,认为原子问通过共用电子对形成稳定结构,并用电子式表示甲烷、乙烯、乙炔等有机化合物。朗缪尔通过共价键理论成功地解释了含氧酸根中存在的配位键(特殊的共价键),并运用“等电子原理”解释了N2、CO、CN-等的结构和性质。
运用量子力学对物质结构进行理论计算而发展起来的现代结构化学理论模型,在传承经典结构模型和电子理论模型优点的基础上;利用价键理论、分子轨道理论和配位场理论,很好地解释了分子(晶体)的电子运动规律与分子(晶体)结构和性质之间的关系。如,使用价层电子对互斥模型(VSEPR)来预测共价分子CH4、NH3H20的空间构型:它们的中心原子是sp3杂化,但CH4的碳原子上没有孤对电子,而NH,和H20的氮、氧原子上分别有1对和2对孤对电子,电子对问的排斥使得CH4、NH3、H20的分子结构分别呈正四面体、三角锥和V形。
可见,从经典化学结构模型一化学键电子理论模型一现代结构化学理论模型,人们通过不断建立物质结构的理想化模型,让那些难以观察和描述的物质微观结构变得直观形象、通俗易懂,更好地揭示了微观粒子的运动特征,理论模型越来越接近物质的真实结构。
2.2抽象与建立化学理论
用来解释化学反应速率快慢的碰撞理论,以及揭示化学反应历程的过渡态理论是化学动力学中非常经典的理论模型。前者是运用气体分子运动论建立的,后者则是在量子力学与统计力学中发展形成的。碰撞理论认为,能够发生反应的分子所具有的能量必须等于或高于该反应的活化能,即分子必须成为活化分子且采用合适的碰撞取向才能发生化学反应。碰撞理论模型的基本假设为:反应物分子是硬球,反应分子必须进行碰撞,具有足够能量的分子取向合适才能发生有效碰撞,反应体系能量分布符合玻尔兹曼能量分布律。碰撞理论对于小分子反应的速率计算值与实验值吻合度较好,但对于溶液中的反应与稍复杂的气相反应则出现了偏差,需要引入校正偏差的经验概率因子。
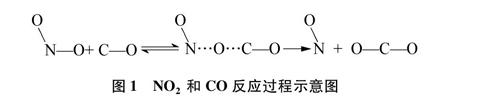
过渡态理论认为化学反应过程并不是反应物分子直接有效碰撞形成产物,而是反应物要先吸收能量形成能量较高的活化配合物;活化配合物具有更高的勢能,并且可以快速分解成新的低能量和更稳定的产物。过渡态理论在碰撞理论的基础上,运用活化能来解释化学反应中化学键的断裂和形成,提出化学反应速率不同是因为各种化学反应的活化能不同。如,反应NO:+CO=NO+CO2,CO和NO2首先吸收能量成为活化分子,再通过有效碰撞形成活化配合物[0-N…0…C-0];然后,断裂部分N…0键,形成部分0…C键。当反应完成时,生成NO和CO2。具体过程表示如图1。
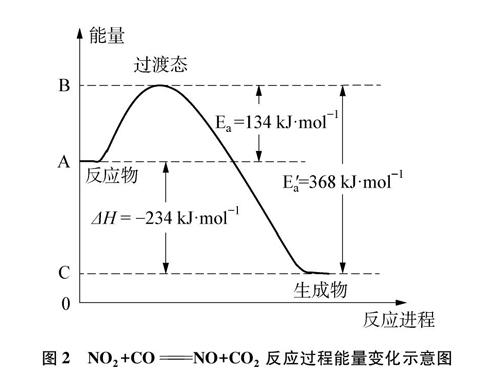
反应NO2+CO=NO+CO:过渡态的能量变化表示如图2,A代表CO与NO,的平均能量,B代表过渡态[0-N…0…C-0]的平均能量,c表示C02与NO的平均能量。当发生反应时,CO与NO,先吸收134kJ·mo的能量(正反应的活化能E2)变成过渡态的活化配合物,然后生成CO2与NO并放出368 kJ·molq的能量(逆反应的活化能E),整个反应过程中的AH=E-E=-234 kJ·mol。
2.3解释与揭示化学反应机理
共价键断裂和生成方式不同,是自由基反应、离子型反应和协同反应的本质区别。自由基反应包括“链引发、链转移和链终止”三个阶段。当化学键断裂时,键合电子对均匀地分布到键合原子或基团,带有孤电子的原子或基团(用黑点表示)是活性较强的中间体,它会攻击其他分子,产生新的自由基,实现链转移。如,在紫外光或热(250-400℃)作用下,甲烷与氯气反应得到CH3C]、CH2C12、CHC]3、CC]4和HCl的反应机理可以表示为:
引导学生沿着这样的历史足迹去探索原子结构,不仅能够帮助学生认识原子模型的动态发展过程,而且还能帮助学生学会辩证地看待科学和科学发展。明白每一次修正后的原子模型,离原子的真实结构又进了一步。
3.3要努力提升学生的化学模型认知能力
模型法让人们学会了建构模型来解决化学问题,不仅能够让抽象的微观结构变得具体直观,而且还训练了人们解决问题的思维方法。因此,教师必须将学生的知识,经验和认知规律与教学有机融合,以提高学生的化学模型认知能力。首先,要让学生认识常见的化学模型,了解各种化学模型的内涵与功能,学会选择合适的化学模型来解释或解决化学问题。其次,指导学生辨析理论模型和研究对象之间的异同,厘清化学模型和原型的关系,准确把握模型的使用条件和适用范围。第三,在学生正确理解、描述和表示常见化学模型的基础上,引导学生运用理论模型解释或推测物质的组成、结构、性质与变化。最后,帮助学生建构分析复杂化学问题的认知模型,并能通过探寻证据来完善和优化模型。
如,按照“苯的科学史→猜测苯的结构和性质→实验探究和推理”的思路来探究苯的分子结构,让学生大胆猜想,搭建模型加以检验和解释。学生活动任务:(1)根据法拉第的“氢的重碳化合物”,猜测并探究其密度、水溶性、可燃性、熔点、沸点等。(2)根据米希尔里希制苯原理与日拉尔测出的分子式(C6H6),猜测并探究苯分子中是否含有C=C、C=C,分子是环状还是链状?(3)凯库勒基于苯和H:的加成反應、苯与液溴的取代反应等实验事实,给出了单双键交替环状结构模型。学生设计实验证实,根据苯不能使溴水和KMn04酸性溶液褪色等实验现象,证明苯分子中不存在C=C,激发认知冲突。(4)凯库勒发现苯的单双键环状结构存在问题,又提出了苯的“共振假说”来进行解释。你如何评价?(5)实验测得:只有一种邻二溴苯,苯和H,能按物质量之比1:3加成。请你确定苯的结构式。(6)现代技术捕获到苯的平面正六边形结构和苯的环形图像,对你认识有机物的结构有何启发?
这样,学生通过对苯的结构探究,不仅理解了苯的分子结构的本质,而且还能够运用苯的分子模型解释或推测苯的性质,建构了“分子式=结构式=性质”的有机物认知模型。
随着科学技术的不断发展,人们对物质微观结构的认识越来越深入,已经建立的化学模型随着人们认知能力的提升,有的被抛弃,有的在日臻完善。这就需要教师指导学生运用批判性思维去研究化学模型,深刻理解各种化学模型的功能和应用,不仅要正确运用化学模型来解决问题,而且还要通过不断探寻证据来改造、优化和深化已有的化学模型,让化学模型能够更形象、更直观、更贴切地解释原型。