慢性寒冷应激对绵羊体增重、血清免疫和抗氧化机能的影响
2021-02-07石璐璐王哲奇徐元庆毛晨羽郭世伟史彬林
石璐璐 王哲奇 徐元庆 毛晨羽 郭世伟 金 晓 史彬林
(内蒙古农业大学动物科学学院,呼和浩特010018)
环境温度是影响畜禽生产的重要外部因素。低温是一种常见的应激源,能增加动物的应激水平,动物为维持体温恒定,机体会通过改变行为、生理、代谢、内分泌等一系列反应增加产热,从而对畜体的正常生理活动和生产性能产生影响。动物长期处于寒冷刺激下的应激反应会破坏机体的生理平衡,导致其生产性能下降、免疫和抗氧化功能受损、抗病力降低、死亡率升高[1-4]。这严重制约了高寒地区动物生产力的发展,降低了畜牧养殖业的经济效益。研究发现,荷斯坦奶牛在冬季慢性寒冷应激(-20~-4 ℃)条件下CD3+T淋巴细胞和CD21+B淋巴细胞比例下降,奶牛的特异性免疫功能受到抑制[3]。Thompson等[5]研究指出,将弗里斯兰绵羊在1 ℃条件下冷暴露48 h后,其泌乳量显著降低。彭孝坤等[6]研究表明,绵羊在舍外冷暴露(-23.8~-16.5 ℃)12 h后,血清白细胞介素(IL)-4和免疫球蛋白(Ig)G含量显著下降,表明在急性冷应激条件下绵羊的免疫功能受损。
绵羊具有较宽的等热区(5~25 ℃),因其具备抗旱耐寒的特性,一直以来在畜牧生产中都占据极为重要的地位[7]。但在极端气候条件下,它们的生理功能和生产性能仍会受到负面影响。2008—2018年内蒙古羊存栏量为5 125.3万~6 001.9万只,占全国羊养殖总量的18.25%~20.20%,而内蒙古地区属温带大陆性季风气候,冬季严寒漫长且昼夜温差极大,极端最低气温可达-37.4 ℃,因此,绵羊过冬这一无法回避的生产环节会严重限制该地区养羊业的可持续发展[8]。目前关于畜禽寒冷应激的研究较为匮乏,有关寒冷应激对绵羊体增重、血清免疫和抗氧化机能影响的研究鲜见报道。因此,本试验拟通过测定冬季不同温度条件下绵羊生长性能指标、血清免疫和抗氧化指标及相关基因表达的变化,探究慢性寒冷应激对其体增重、血清免疫和抗氧化机能的影响,为科学健康养殖绵羊提供理论依据。
1 材料与方法
1.1 试验设计
本试验于2016年12月31日至2017年1月27日在内蒙古农业大学试验牧场开展。选取体重为(55.50±0.80) kg、毛丛长度为(11.60±1.47) cm的3岁健康杜蒙杂交母羊18只,随机分为3组,每组6只。不同组的试验羊饲养于不同羊舍,且各试验羊单栏饲喂。其中舍内加热组(对照组)绵羊舍内安置电暖气,调节舍内温度处于舒适范围;舍内组绵羊处于舍内自然温度条件下;舍外组绵羊处于舍外接受冷暴露。试验共28 d,第1~14天为试验前期,第15~28天为试验后期。试验羊自由饮水,由于舍外环境温度较低,因此每隔2 h换水1次,保证舍外组绵羊饮水自由。每天于08:00和15:00饲喂全混合日粮颗粒料1次,每次保证有5%的剩余料量,按照NRC(2007)饲养标准配制基础饲粮,其组成及营养水平见表1。
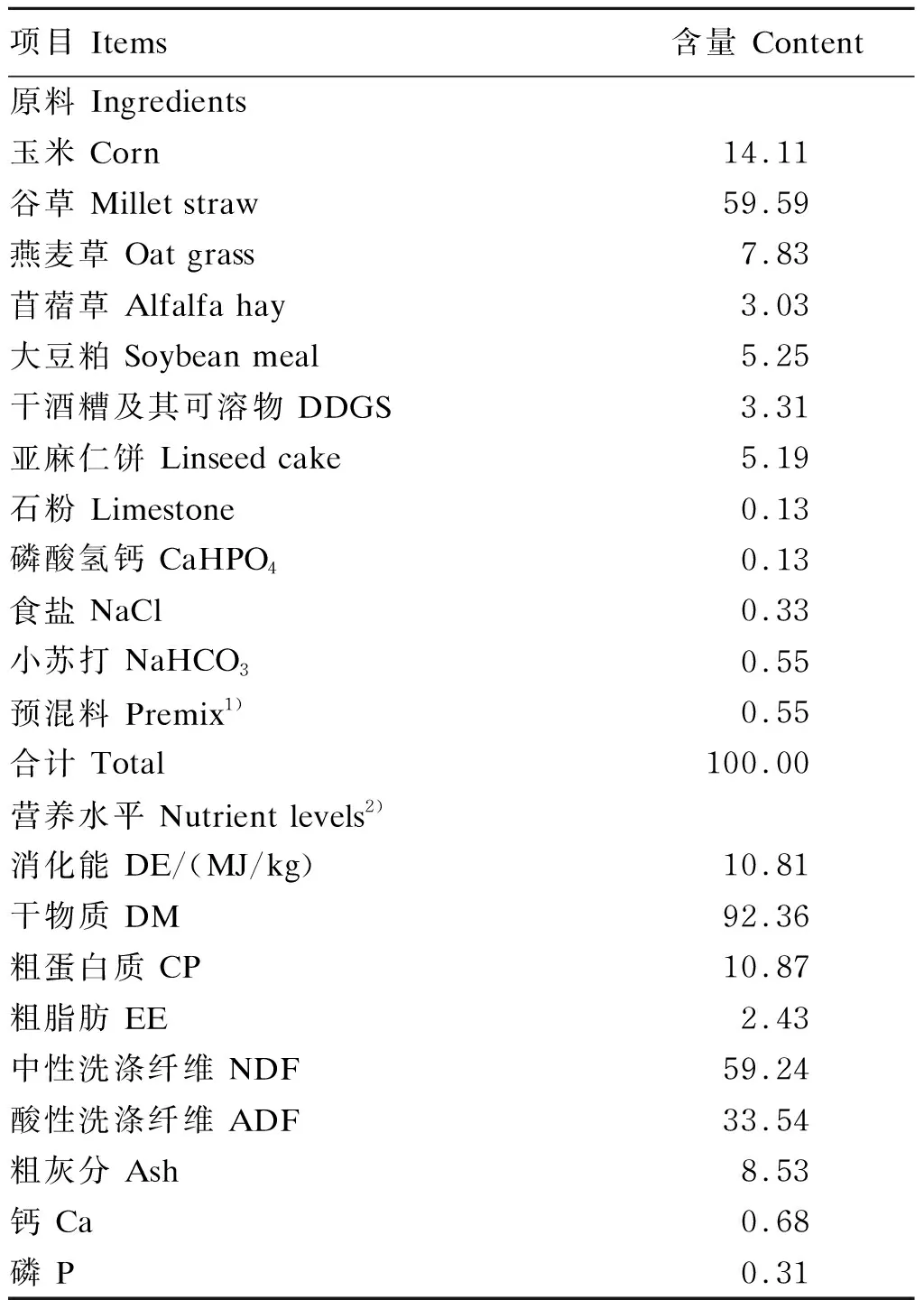
表1 基础饲粮组成及营养水平(干物质基础)
1.2 样品采集
分别于试验第14和28天08:00空腹采集颈静脉血样于非抗凝采血管和含乙二胺四乙酸(EDTA)的抗凝采血管中,3 000×g离心20 min后分别收集血清和白细胞。血清-20 ℃保存,白细胞中加入Trizol(TaKaRa)混匀并存于-80 ℃,用于总RNA的提取和后续指标的测定。
1.3 测定指标及方法
1.3.1 环境温度的测定
试验期间,于羊舍中部和羊舍外距地面1 m处(畜体高度)悬挂日记型自记式温度记录仪(ZJI-2A型,上海隆拓仪器设备有限公司),避免试验羊触碰。分别监测并计算3组试验前期(第1~14天)和试验后期(第15~28天)的整点平均环境温度。在试验前期(图1),对照组的温度为5.57~10.51 ℃,全天平均温度为6.84 ℃;舍内组的温度为0.94~6.53 ℃,全天平均温度为2.79 ℃;舍外组的温度为-18.81~2.64 ℃,全天平均温度为-10.62 ℃。在试验后期(图2),对照组的温度为5.51~10.25 ℃,全天平均温度为7.18 ℃;舍内组的温度为0.53~4.83 ℃,全天平均温度为2.05 ℃;舍外组的温度为-25.60~-0.45 ℃,全天平均温度为-15.49 ℃。
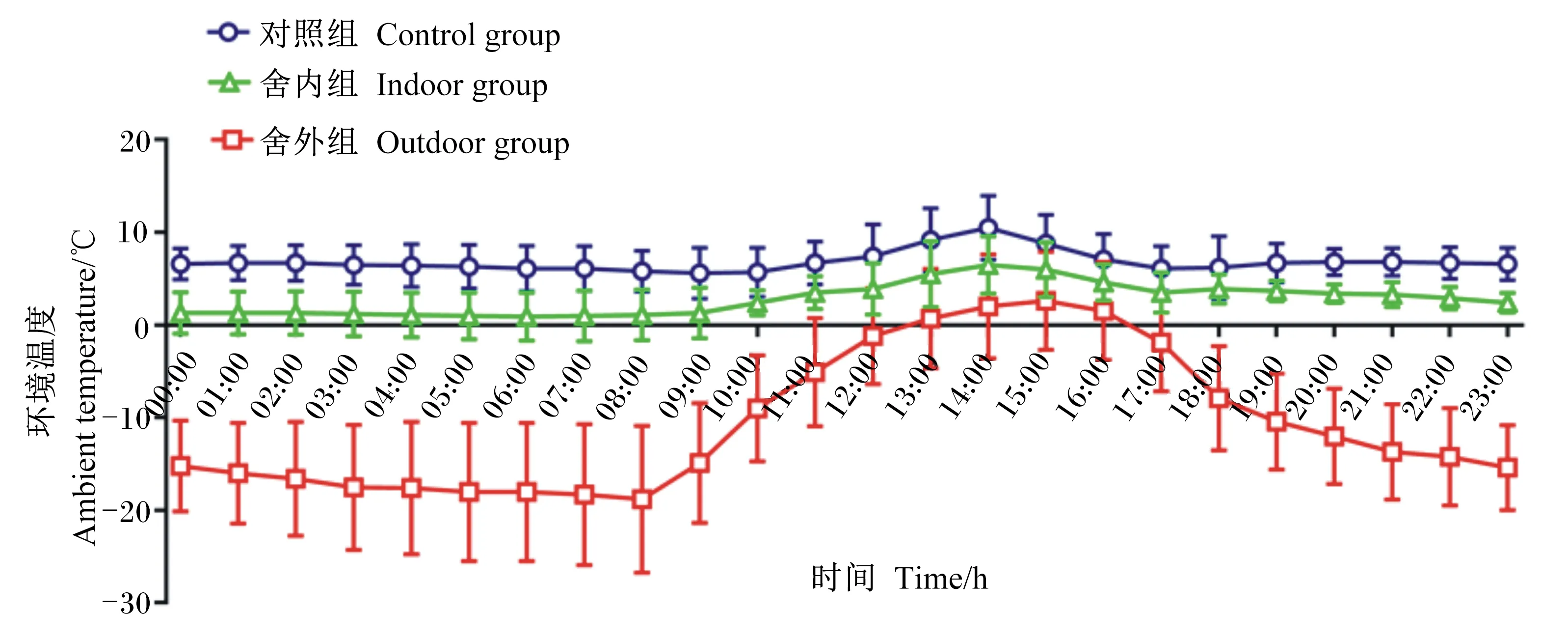
图1 试验前期(第1~14天)不同羊舍环境温度日变化曲线
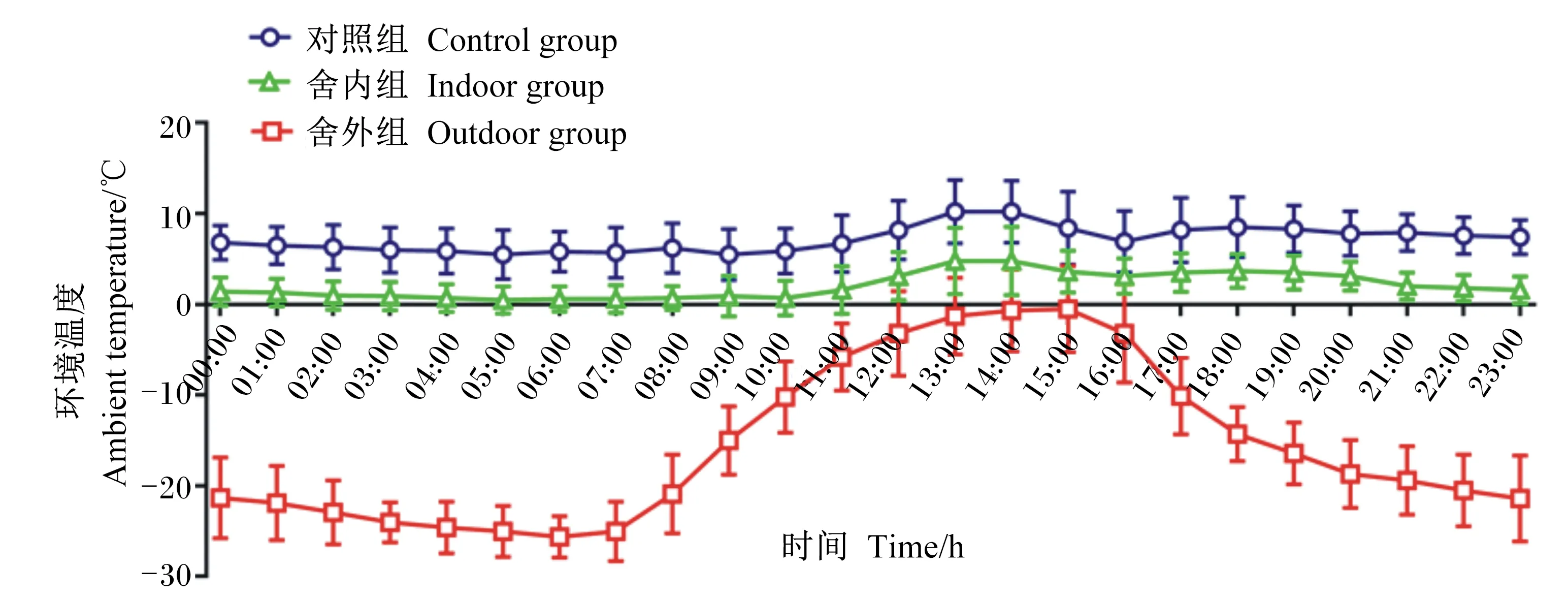
图2 试验后期(第15~28天)不同羊舍环境温度日变化曲线
1.3.2 生长性能的测定
每次饲喂前称取给料量,第2天晨饲前称量并记录料槽中剩余量,计算各组试验羊的平均日采食量(ADFI)。试验第1、14和28天晨饲前对所有试验羊空腹称重,计算平均日增重(ADG)。
1.3.3 血清免疫指标的测定
血清中IgA、IgG、IgM、IL-1、IL-12及肿瘤坏死因子-α(TNF-α)含量采用酶联免疫吸附试验(ELISA)试剂盒(瑞星生物科技有限公司)测定,按照制造商说明书要求进行。
1.3.4 血清抗氧化指标的测定
血清中总抗氧化能力(T-AOC)与过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、总超氧化物歧化酶(T-SOD)活性以及脂质过氧化产物丙二醛(MDA)含量采用比色法通过南京建成生物工程研究所的试剂盒测定。
1.3.5 总RNA提取、反转录和实时荧光定量PCR反应
采用Trizol法从白细胞中提取总RNA,紫外分光光度法测定总RNA的浓度和纯度。按照Prime ScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)说明书进行反转录,采用TB GreenTMPremix Ex TaqTM试剂盒(TaKaRa)进行实时荧光定量PCR反应,程序如下:95 ℃预变性30 s;95 ℃变性5 s,退火60 s,72 ℃延伸20 s,40个循环。绵羊IL-1β、IL-2、TNF-α、CAT、GPx、超氧化物歧化酶1(SOD1)、超氧化物歧化酶2(SOD2)、核转录因子2(Nrf2)和内参β-肌动蛋白(β-actin)引物序列及参数如表2所示,由北京六合华大基因科技有限公司合成,各目的基因的相对表达量根据2-△△Ct法计算。
1.4 统计分析
试验数据采用SAS 9.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,P<0.05表示差异显著。结果以平均值±标准差表示。
2 结果与分析
2.1 慢性寒冷应激对绵羊生长性能的影响
由表3可知,试验前期各组绵羊的ADG均为负值。试验后期各组绵羊的ADG为正值,且与对照组相比,舍外组绵羊的ADG下降45.73%(P<0.05)。从试验全期来看,舍外组绵羊的ADG与对照组相比降低189.81%(P<0.05),且舍外组绵羊的ADG为负值。各组间绵羊的体重和ADFI在试验各阶段差异均不显著(P>0.05)。
2.2 慢性寒冷应激对绵羊血清免疫指标及白细胞中相关基因表达的影响
由表4可知,在试验第14天,舍内组和舍外组绵羊血清IL-1含量较对照组分别降低42.04%和47.78%(P<0.05),而各组间其他血清免疫指标差异不显著(P>0.05)。在试验第28天,舍外组绵羊血清IgG含量较对照组下降27.63%(P<0.05),而血清TNF-α含量较对照组升高89.72%(P<0.05)。此外,与对照组相比,舍内组和舍外组绵羊血清IL-2含量分别降低25.73%和45.13%(P<0.05)。
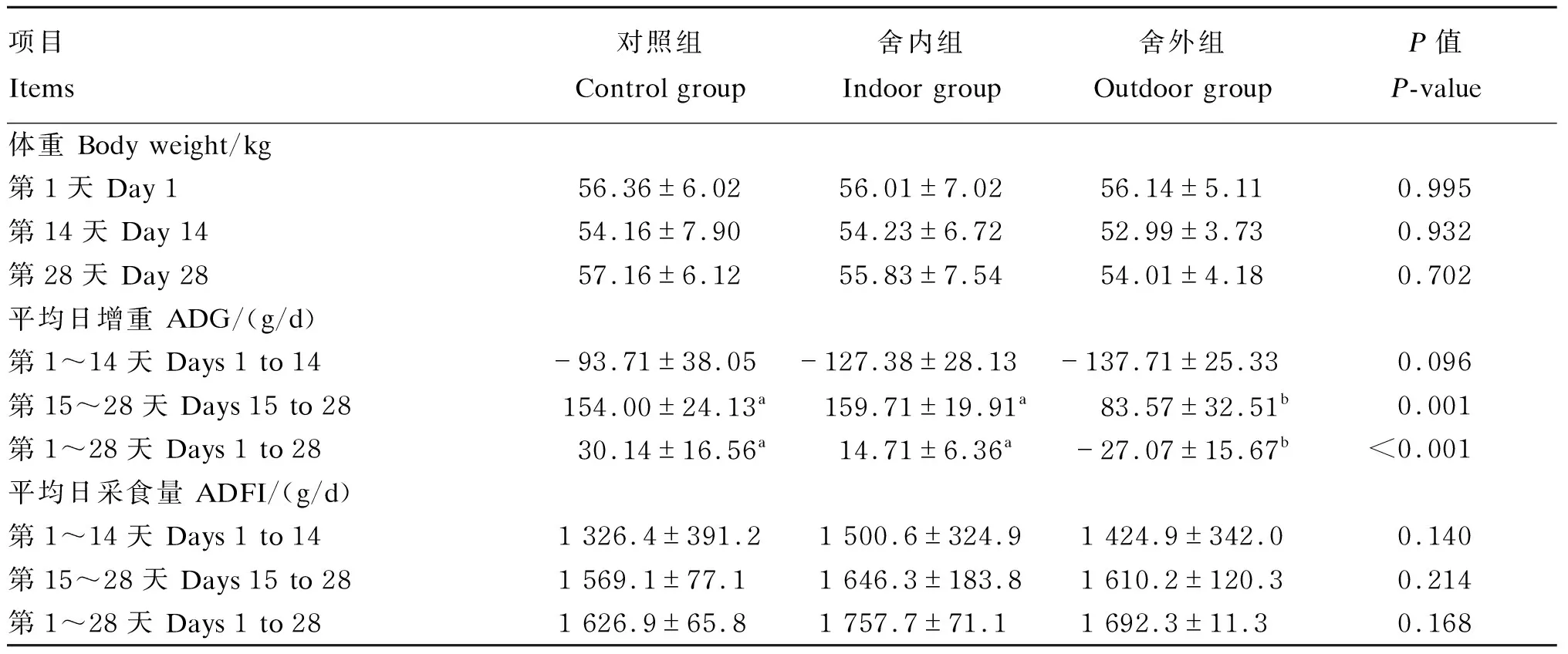
表3 慢性寒冷应激对绵羊生长性能的影响

表4 慢性寒冷应激对绵羊血清免疫指标的影响
由表5可知,在试验第14天,与对照组相比,舍内组和舍外组绵羊白细胞中IL-1β基因相对表达量分别下调25.00%和33.00%(P<0.05),且舍外组绵羊白细胞中IL-2基因相对表达量下调52.00%(P<0.05)。在试验第28天,舍外组绵羊白细胞中IL-2基因相对表达量较对照组下调24.00%(P<0.05),而白细胞中TNF-α基因相对表达量上调25.00%(P<0.05);各组间白细胞中IL-1β基因相对表达量差异不显著(P>0.05)。
2.3 慢性寒冷应激对绵羊血清抗氧化指标及白细胞中相关基因表达的影响
由表6可知,在试验第14天,舍外组绵羊血清GPx和T-SOD活性较对照组分别下降28.82%和25.97%(P<0.05);舍内组和舍外组绵羊血清MDA含量较对照组分别升高64.38%和91.78%(P<0.05)。在试验第28天,舍内组和舍外组绵羊血清CAT活性较对照组分别降低31.91%和48.09%(P<0.05),而舍外组较舍内组降低23.75%(P<0.05);舍内组和舍外组绵羊血清T-AOC较对照组分别下降12.00%和38.00%(P<0.05),而舍外组较舍内组降低29.55%(P<0.05);此外,与对照组相比,舍外组绵羊血清GPx和T-SOD活性分别下降43.85%和41.94%(P<0.05),而血清MDA含量升高51.28%(P<0.05)。
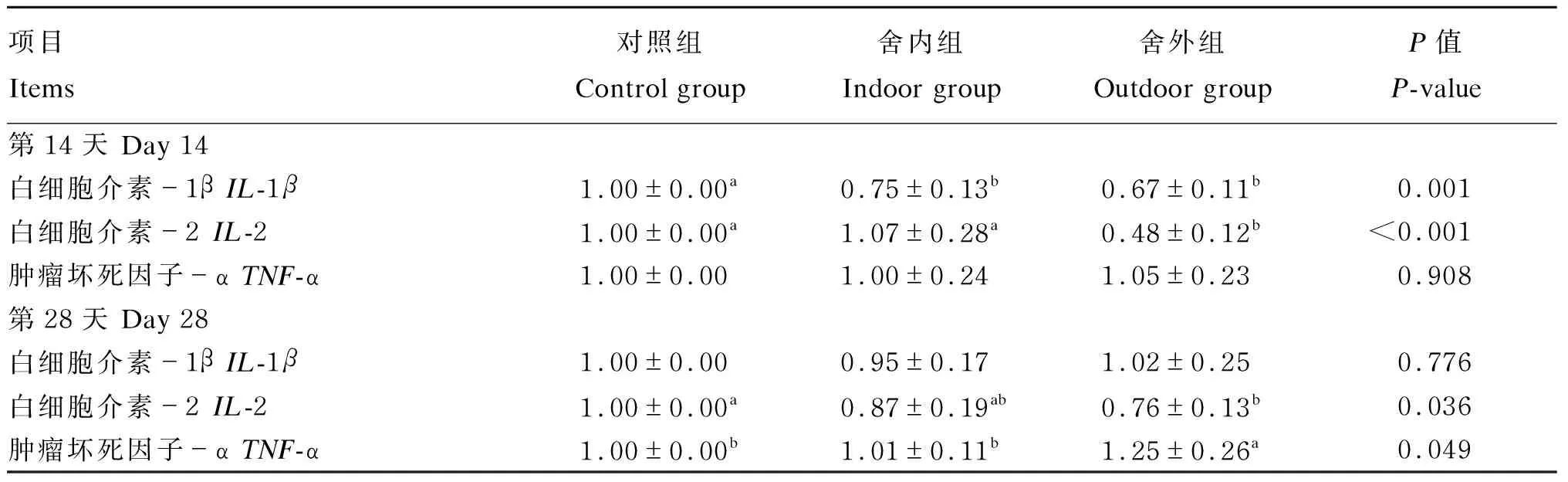
表5 慢性寒冷应激对绵羊白细胞中IL-1β、IL-2和TNF-α基因相对表达量的影响
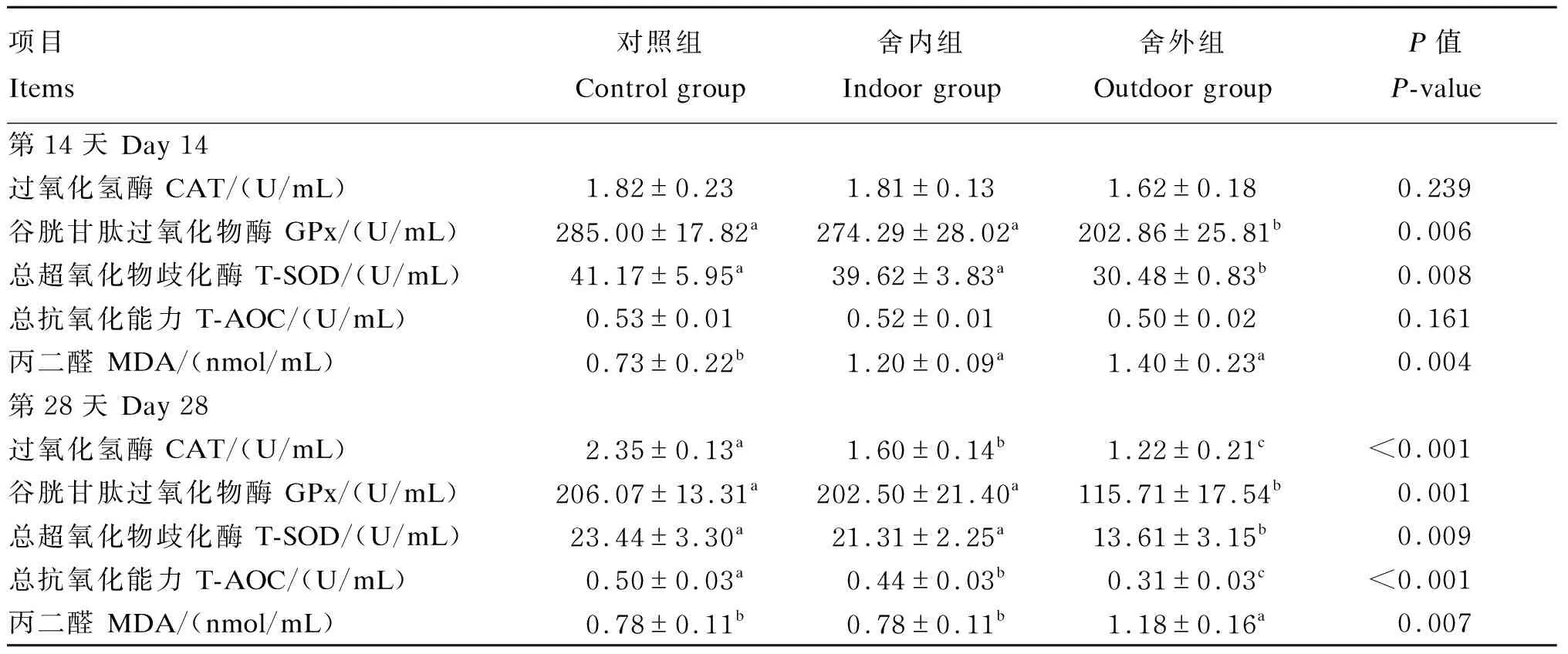
表6 慢性寒冷应激对绵羊血清抗氧化指标的影响
由表7可知,在试验第14天,舍外组绵羊白细胞中GPx和SOD1基因相对表达量较对照组分别下调26.00%和25.00%(P<0.05)。在试验第28天,与对照组相比,舍外组绵羊白细胞中Nrf2基因相对表达量上调68.00%(P<0.05),而白细胞中GPx和SOD2基因相对表达量分别下调27.00%和39.00%(P<0.05)。此外,舍内组绵羊白细胞中CAT基因相对表达量下调31.00%(P<0.05),而舍外组绵羊白细胞中CAT基因相对表达量上调34.00%(P<0.05)。
3 讨 论
我国北方高寒地区冬季气温普遍较低,且寒冷期普遍偏长。这种长期的寒冷刺激或者突降大雪、寒潮突袭等短暂性强降温对动物的正常生长和机体健康都有很大影响,会降低家畜的生产力和抗病力。不同畜禽的等热区或适宜温度范围不同,其中绵羊的等热区为5~25 ℃,最适温度为-3~23 ℃[7,14]。此外,羊的最适环境温度范围受其被毛性状的影响。Acharya等[15]研究表明,相较于长毛羊,暴露在太阳辐射下的短毛羊直肠温度、皮肤温度和呼吸频率会大幅升高,采食量则会降低。而在寒冷的冬季,被毛作为绵羊的保温绝热层,在减少体热散失、维持冬季正常体温方面发挥较大作用。本试验中各组的环境温度均较稳定,其中对照组试验全期平均温度为7.01 ℃,舍内组试验全期平均温度为2.42 ℃。而舍外组试验全期平均温度为-13.05 ℃,且试验后期平均温度为-15.49 ℃,较试验前期-10.62 ℃下降4.87 ℃,这表明舍外组绵羊遭受寒冷应激的程度最为严重。
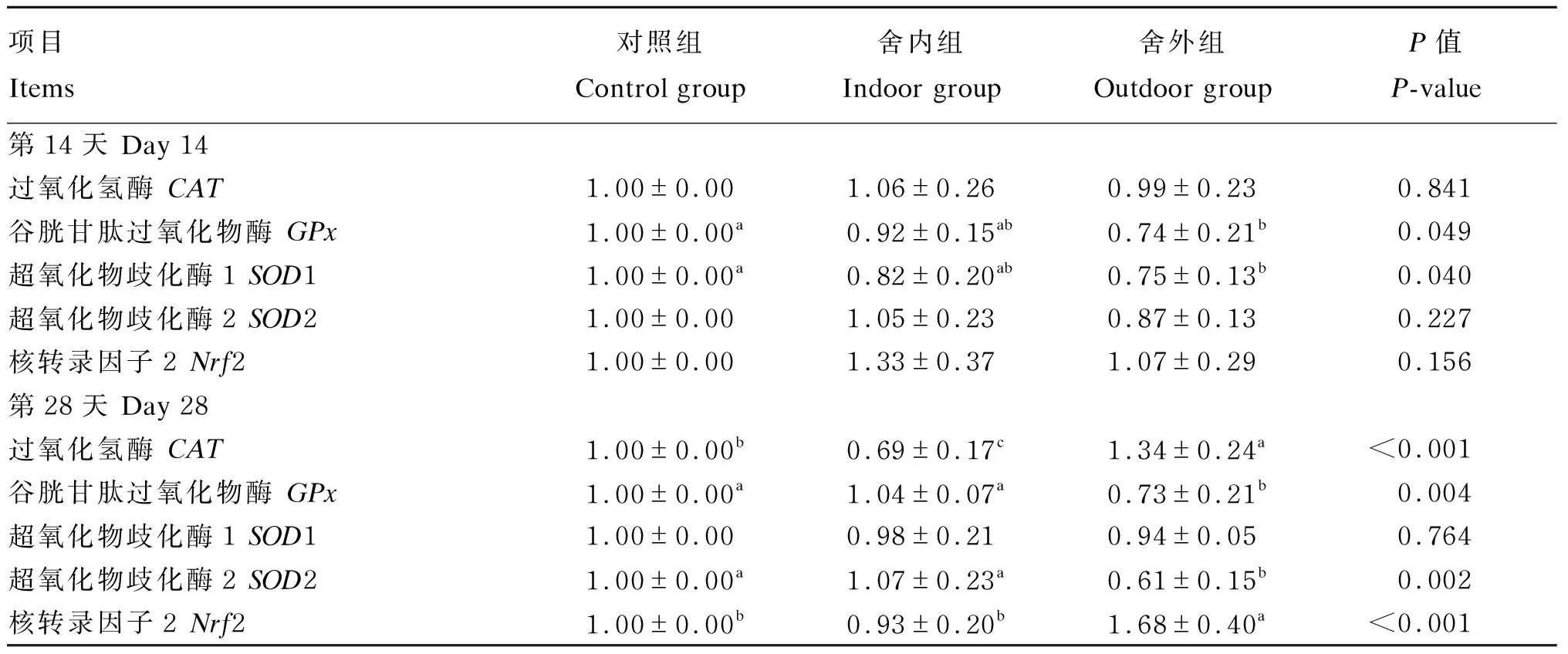
表7 慢性寒冷应激对绵羊白细胞中CAT、GPx、SOD1、SOD2和Nrf2基因相对表达量的影响
3.1 慢性寒冷应激对绵羊生长性能的影响
研究表明,动物在寒冷应激条件下为维持自身体温恒定和正常的生命活动,需要消耗更多的饲粮能量。如果摄入的营养少于消耗部分,那么将消耗部分体脂,最终导致发育缓慢、体重下降。谷英等[16]研究表明,鄂尔多斯细毛羊冬季体重会出现负增长。张士军[17]研究发现,-17 ℃冷暴露组羔羊(6月龄)相较于5 ℃对照组羔羊ADG显著下降。本试验结果与前人研究结果相似,试验前期各组绵羊均处于减重状态,试验后期虽有所回升,但舍外组绵羊的ADG显著下降,且从试验全期来看,舍外组绵羊的体重并未恢复到试验开始水平,处于减重状态,而对照组和舍内组绵羊的体重均有所升高。这可能是由于绵羊在舍外寒冷应激条件下需要消耗更多的能量,甚至消耗部分体脂来保证体温恒定,从而减少了脂肪的沉积。值得注意的是,在本试验中,寒冷应激虽然降低了绵羊的ADG,但各组绵羊的体重并无显著差异,这可能是由于个体差异大或样本数少而没有达到差异显著水平。此外,De等[18]研究表明,Malpura羔羊(3~5月龄)在寒冷应激条件下干物质采食量增加,而在本试验中各组绵羊的ADFI差异不显著。这可能是由于寒冷应激对成年动物采食量的影响要小于幼年动物。郭春华等[19]的试验结果,20~40 kg的小猪在低温时的采食量增加要高于60~80 kg的大猪,也印证了这一推测。
3.2 慢性寒冷应激对绵羊血清免疫指标及白细胞中相关基因相对表达量的影响
由于机体免疫系统和应激系统的复杂性,关于寒冷应激对畜禽免疫功能影响的研究结论不一而足,这可能与动物种属、刺激强度和持续时间等因素有关。但一般认为短期急性寒冷应激能够增强机体的免疫应答能力,而长期慢性寒冷应激则会抑制机体免疫功能,且多数研究表明冷刺激对畜体免疫功能的影响主要呈免疫抑制作用[2,20-22]。血清免疫球蛋白能够与抗原特异性结合,刺激抗体的产生,发挥特异性免疫效应,其含量是反映机体体液免疫功能的重要指标之一[23]。IgG作为Ig的主要组成部分,在促进免疫细胞吞噬病原体、中和病毒和细菌毒素等过程中发挥重要作用[24]。高静雯等[25]将阿勒泰公羔羊置于2个不同的温度组,即常温对照组(15~20 ℃)和低温冷应激组(-35~-30 ℃),发现冷应激4 d时羔羊血清IgG含量相较常温对照组显著下降。与前人研究结果相似,本试验发现舍外组绵羊血清IgG含量显著低于对照组,这表明在寒冷应激条件下绵羊的Ig含量下降,机体体液免疫功能受到抑制。
细胞因子水平是衡量机体免疫功能的重要指标。其中IL-1能够刺激T细胞和抗原呈递细胞(APC)活化,IL-2可以促进T细胞生长、刺激B细胞增殖分化并产生抗体,二者均在反刍动物免疫调节过程中发挥重要作用[26-27]。在本试验中,寒冷应激显著降低了试验前期绵羊血清IL-1含量和白细胞中IL-1β、IL-2基因相对表达量,以及试验后期绵羊血清IL-2含量和白细胞中其基因相对表达量,该结果与魏殿华等[26]、杨莉等[21]研究结果相似。魏殿华等[26]研究表明,阿勒泰羔羊在-20~-10 ℃条件下,外周血白细胞中IL-1 mRNA的表达量低于常温对照组(10~20 ℃);杨莉等[21]研究发现,阿勒泰羊在-30~-15 ℃条件下,血清IL-2含量呈下降趋势,IL-4含量显著下降。这表明寒冷应激可能通过降低IL-1β和IL-2的基因相对表达量来减少二者的分泌量,抑制机体免疫功能。此外,TNF-α作为炎症早期反应的主要前炎性因子,能够与多种免疫细胞上的受体结合,发挥免疫调控作用,但随着其分泌量的增加,机体的炎症反应会加剧,最终造成组织损伤,降低机体免疫功能。本研究结果表明,试验后期舍外组绵羊在寒冷应激条件下血清TNF-α含量和白细胞中其基因相对表达量显著升高,这与Shini等[28]的研究结果一致。该结果可能是由于应激条件下过量生成的活性氧(ROS)作为第二信使,通过泛素化和磷酸化核因子-κB(NF-κB)的抑制蛋白IκB,释放细胞质的NF-κB二聚体到细胞核中,从而促进了下游TNF-α等相关基因的转录,加速了机体的炎症反应[29]。值得注意的是,本试验舍内组绵羊试验前期血清IL-2、试验后期血清TNF-α和试验全期血清IgG含量与对照组绵羊相比差异不显著,这可能与寒冷应激的强度较低且机体本身具有一定抵抗或适应不利环境的能力有关。
3.3 慢性寒冷应激对绵羊血清抗氧化指标及白细胞中相关基因相对表达量的影响
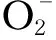
Kelch样环氧氯丙烷相关蛋白1-核因子E2相关因子2-抗氧化反应元件(Keap1-Nrf2-ARE)信号通路是机体抵抗氧化应激关键的防御性转导通路[36]。但也有研究表明,持续的Nrf2激活反而会加重组织细胞的氧化损伤[37]。本研究测定了寒冷应激期间绵羊白细胞中Nrf2基因相对表达量,结果表明在试验第28天,舍外组绵羊白细胞中Nrf2基因相对表达量显著升高。此外,本研究发现试验后期舍外组绵羊白细胞中CAT基因相对表达量显著高于其他2个组,而血清CAT活性显著低于其他各组,这可能是由于ROS通过修饰Keap1上的半胱氨酸残基,激活Nrf2入核并与ARE结合,进而启动了下游CAT基因的表达,但随着寒冷应激严重程度和持续时间的增加,大量CAT、GPx和SOD被堆积的ROS消耗,最终导致抗氧化酶活性下降。
4 结 论
在本研究中,与对照组相比,舍外组绵羊的体增重下降,且舍外组和舍内组绵羊血清IL-1和IL-2的含量降低,白细胞中IL-1β基因相对表达量下调,血清CAT活性以及白细胞中CAT基因相对表达量降低,血清T-AOC降低,而MDA含量升高。这表明慢性寒冷应激能够降低绵羊的体增重,抑制其血清免疫和抗氧化水平,而安置供暖设备的保温圈舍可以显著缓解这种负面影响。
