不同产蛋水平肉种鸡繁殖性能、肠道组织形态、卵巢功能和盲肠微生物区系差异研究
2021-02-07杨曾乔丁雪梅白世平曾秋凤张克英王建萍
杨曾乔 丁雪梅 白世平 曾秋凤 张克英 王建萍
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,动物抗病营养与饲料农业部重点实验室,动物抗病营养四川省重点实验室,成都611130)
肉种鸡的繁殖性能受到遗传、营养、饲养管理等因素的影响。家禽的肠道是营养物质消化与吸收的关键部位,同时也是机体最大的免疫器官,肠道内寄生的微生物更是在营养、代谢、生理和免疫过程中都起着重要的作用[1-2]。近20年的研究表明,肠道微生物能够通过影响宿主肠道绒毛隐窝的形态、食物消化和营养吸收、肠道免疫系统的发育、短链脂肪酸的生成、维生素、激素的合成,产生消化酶以及影响肠道病原微生物的增殖[3-5],从而影响宿主的生理功能、消化功能、营养吸收功能和免疫功能[6]。有研究表明,肠道微生物能够影响宿主对营养的吸收与能量的利用,Bäckhed等[7]研究指出无菌小鼠降低了肥胖症,以及增加了葡萄糖和胰岛素耐受。Turnbaugh等[8]研究指出,将肥胖症小鼠的肠道粪便移植到无菌小鼠肠道中,导致了无菌小鼠的肥胖。肠道微生物还能够导致糖尿病和代谢综合征[9]。Insenser等[10]对人肠道微生物与多囊卵巢综合征研究发现,肠道微生物的多样性以及组成能被性激素浓度、肥胖影响,并且肠道微生物如Paraprevotella与睾酮(TTE)、雌二醇(E2)呈显著相关关系,说明微生物有可能对调节宿主类固醇激素[11]以及性激素起着重要的作用[12],推测微生物可能会影响宿主繁殖性能。在家禽生产上,张亚楠[13]研究指出,高产、低产、极低产蛋水平蛋鸡肠道微生物结构存在差异,并且在将低产蛋鸡肠道微生物移植至高产蛋鸡肠道中后,高产蛋鸡产蛋率显著下降。另外卵巢作为家禽的主要繁殖器官,其功能是影响家禽繁殖性能的最直接的因素。然而目前肠道微生物与繁殖性能和卵巢功能的直接联系还不清楚,关于肠道微生物对家禽影响的研究相较哺乳动物而言还较少,尤其是在种禽上的研究更加缺乏。
鉴于此,本研究旨在比较分析高、平均产蛋水平肉种鸡繁殖性能、肠道组织形态、卵巢功能和肠道微生物区系的差异,为更好地认识繁殖与肠道微生物的关系提供科学依据。
1 材料与方法
1.1 试验设计
试验从5 000只肉种鸡中分别筛选出高和平均产蛋水平的肉种鸡(41周龄)各90只,共180只,设为平均产蛋率组[AR组,产蛋率(79.34±0.49)%,与饲养手册推荐产蛋率无显著差异(P>0.05)]和高产蛋率组[HR组,产蛋率(90.03±0.34)%],每组10个重复,每个重复9只鸡。正试期为6周。试验开始前进行4周的预试期,其中记录5 000只同栋舍、同日龄(37周龄)的爱拔益加(AA)父母代肉种鸡的产蛋率、受精率、孵化率数据,为期2周;之后,根据每只肉种鸡产蛋率,筛选出健康的180只体重[AR组,90只,(4.08±0.12) kg;HR组,90只,(4.15±0.06) kg]无显著差异(P=0.59)的2组肉种鸡,随即在同栋舍中分配进新笼子,进入2周的环境适应期。预试期和正试期所有肉种鸡饲喂统一的玉米-豆粕型饲粮,参考NRC(1994)和AA肉种鸡营养需求手册配制,基础饲粮组成及营养水平见表1。试验全程采用粉料,限制饲喂,每天饲喂160 g饲粮。

表1 基础饲粮组成及营养水平(风干基础)
1.2 饲养管理
试验在四川省遂宁市射洪县瞿河乡玉太种鸡场进行。所有试验肉种鸡均采用2层阶梯式笼养,每笼2只鸡,不同组每个笼子间隔放置,均匀分布在鸡舍内。每天采用光照16 h、黑暗8 h,舍内温度23 ℃左右,自由饮水,每天饲喂1次(04:00),每次饲喂定量饲粮,并观察鸡有无异常情况,每天10:00、14:00和15:00拣蛋并记录称重,每隔4 d人工授精1次,定期打扫鸡舍卫生。
1.3 样品采集
在试验第6周结束时,每个重复随机挑选1只健康的鸡,禁食12 h,称重后,从翅静脉抽取15 mL血液,分离血清,-20 ℃保存。将采血后的鸡采用颈部脱臼法进行屠宰,取十二指肠、空肠、回肠肠段中部2~3 cm大小的组织样固定(4%、pH=7.2的多聚甲醛溶液)。取盲肠食糜,-80 ℃保存。取鸡的全部腹部脂肪,并称重。采集部分卵巢组织样放入固定液(4%、pH=7.2的多聚甲醛溶液)以及取部分剥离了卵泡和结缔组织的卵巢组织,-80 ℃保存。
1.4 测定指标与方法
1.4.1 繁殖性能
生产性能:试验期间每天记录各重复总产蛋数、总蛋重,每周统计1次采食量,计算产蛋率、平均蛋重、料蛋比和合格蛋率。
孵化性能:在试验第6周,连续收集5 d的全部合格种蛋进行孵化。孵化时每7 d翻1次蛋,在孵化第19天进行照蛋工作,挑选出未受精蛋和死胚蛋,入孵第21天出雏,记录合格种蛋、受精蛋、死胚蛋和出雏数,计算入孵蛋孵化率=出雏数/合格种蛋数。
1.4.2 血清生化指标
血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量和谷草转氨酶(AST)、乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)活性以及葡萄糖(GLU)、钙(Ca)、磷(P)的含量用试剂盒(购自南京建成生物工程研究所)测定。
1.4.3 血清激素含量
血清E2、卵泡刺激素(FSH)、促肾上腺皮质激素(ACTH)、TTE、抗缪勒氏管激素(AMH)、皮质酮(CORT)和黄体酮(PROG)含量采用酶联免疫吸附试验(ELISA)试剂盒(购自江苏酶免实业有限公司),使用酶标仪(MS-352)测定。
1.4.4 肠道组织形态
肠道组织样经脱水、浸蜡、包埋、切片、苏木精-伊红染色,在光学显微镜40倍下进行观察,选择随机视野,拍照,分析并测量小肠绒毛高度和隐窝深度并计算绒隐比(绒隐比=绒毛高度/隐窝深度)。
1.4.5 卵巢组织形态
经过Tunel(Roche,瑞士)试剂盒(Insitucell death detection kit-POD法)测定,在光学显微镜40倍下进行观察,选择随机视野,拍照,分析。阳性表达为浅黄色或棕黄色,阴性为蓝色。
1.4.6 卵巢功能相关基因表达
增殖细胞核抗原(PCNA)、半胱氨酸天冬氨酸蛋白酶(caspase)家族成员(caspase 3、caspase 8、caspase 9)、B细胞淋巴瘤2关联X蛋白(Bax)、B细胞淋巴瘤2蛋白(Bcl2)、过氧化物酶体增殖物激活受体γ(PPARγ)、叉头框转录因子L2(FOXL2)、骨形态发生蛋白15(BMP15)、骨形态发生蛋白受体2(BMPR2)、骨形态发生蛋白受体1B(BMPR1B)、转录因子家族(GATA4、GATA6)、闭合蛋白(OCLN)、细胞色素P450家族(CYP)成员(CYP11A1、CYP19A1)、类固醇生成急性调节蛋白(StAR)、雄性激素受体(AR)、雌激素受体1(ESR1)、卵泡刺激素受体(FSHR)、孕激素受体(PGR)、激活素受体1(ACVR1)、AMH、家鸡新型类催乳素(PRL-L)基因表达水平采用试剂盒(购自TaKaRa-Bio公司),使用荧光定量PCR仪(ABI 7900HT)进行测定,引物序列见表2。

表2 引物序列
1.4.7 微生物区系16S rRNA序列分析

根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后使用FLASH(V1.2.7)对每个样本的reads进行拼接,得到原始Tags数据(Raw Tags);再用Qiime(V1.9.1)的Tags质量控制流程过滤处理得到高质量Tags数据(Clean Tags)。将处理后得到的Tags序列通过(UCHIME Algorithm)与物种注释数据库进行比对检测去除嵌合体序列,得到有效数据(Effective Tags)。用Uparse软件(v7.0.1001)对Effective Tags进行聚类,以97%的一致性(identity)将序列聚类成为分类操作单元(OTU),并选取代表性的OTU的序列。对OTU代表序列进行物种注释,用Mothur方法与SILVA的SSU rRNA数据库进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息并分别在各个分类水平:界、门、纲、目、科、属、种统计各样本的群落组成。使用MUSCLE(Version 3.8.31)软件进行快速多序列比对,得到所有OTU代表序列的系统发生关系。最后对以样本中数据量最少的为标准进行均一化处理,alpha多样性分析是基于均一化处理后的数据。使用R软件(Version 2.15.3)对alpha多样性进行分析,使用R语言软件的psych包进行环境因子关联的Spearman分析。
1.5 数据处理
采用SPSS 25.0对繁殖性能及相关数据进行独立样本t检验,结果用平均值和均值标准误(SEM)表示,以P<0.05为差异显著性水平,P<0.01为差异极显著水平。
2 结 果
2.1 不同产蛋水平肉种鸡繁殖性能差异
由表3可知,与AR组相比,HR组肉种鸡产蛋率和入孵蛋孵化率显著提高(P<0.05),料蛋比显著降低(P<0.05),而平均蛋重、合格蛋率和受精率无显著差异(P>0.05)。这表明HR组肉种鸡饲料转化效率显著高于AR组。

表3 不同产蛋水平肉种鸡繁殖性能差异
2.2 不同产蛋水平肉种鸡血清生化指标差异
由图1可知,HR组肉种鸡血清ALT活性显著低于AR组(P<0.05),而2种不同产蛋水平肉种鸡之间血清脂代谢相关指标(血清TG、TC、HDL-C、LDL-C和GLU含量)、血清代谢相关酶活性(血清AST、LDH和ALP活性)以及血清Ca、P含量无显著差异(P>0.05)。
2.3 不同产蛋水平肉种鸡血清激素含量差异
由表4可知,HR组肉种鸡的血清激素含量与AR组无显著差异(P>0.05)。
2.4 不同产蛋水平肉种鸡肠道组织形态差异
由图2可知,HR组肉种鸡十二指肠绒毛高度显著高于AR组(P<0.05),而空肠绒毛高度显著低于AR组(P<0.05),回肠隐窝深度显著高于AR组(P<0.05),而绒隐比2组之间无显著差异(P>0.05)。

数据柱标记*表示差异显著(P<0.05),标记**表示差异极显著(P<0.01)。下图同。

表4 不同产蛋水平肉种鸡血清激素含量差异
2.5 不同产蛋水平肉种鸡腹脂率差异
由图3可知,HR组肉仔鸡腹脂率(腹脂重/活重)显著低于AR组(P<0.05)。
2.6 不同产蛋水平肉种鸡卵巢细胞凋亡率差异
由图4可知,HR组肉种鸡卵巢细胞凋亡率极显著低于AR组(P<0.01)。
2.7 不同产蛋水平肉种鸡卵巢功能相关基因表达差异
由图5可知,与AR组相比,HR组肉种鸡卵巢凋亡相关基因caspase 9、繁殖调控相关基因BMPR1B、GATA4和激素受体相关基因PRL-L表达水平显著或极显著上调(P<0.05或P<0.01),卵巢CYP19A1表达水平有上调的趋势(P=0.10)。
2.8 不同产蛋水平肉种鸡盲肠微生物区系16S rRNA序列分析
以97%的序列相似性测序高质量的16S rRNA序列得出,肉种鸡盲肠中有1 406 644个序列,平均每个样品有87 915个序列(77 256~95 053)。由图6可知,HR组盲肠微生物的丰富度(Chao1指数和ACE指数)、多样性(Shannon指数和Simpson指数)与AR组相比差异不显著(P>0.05),但OTU数量大于AR组。
2.9 不同产蛋水平肉种鸡盲肠微生物相对丰度差异
由表5可知,肉种鸡盲肠微生物优势菌门为拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),优势菌属为拟杆菌属(Bacteroides)。HR组肉种鸡盲肠微生物厚壁菌门和乳杆菌属(Lactobacillus)相对丰度厦显著高于AR组(P<0.05),拟杆菌门和螺旋体门(Spirochaetes)相对丰度显著低于AR组(P<0.05)。

①和②分别代表AR组和HR组十二指肠,③和④分别代表AR组和HR组空肠,⑤和⑥分别代表AR组和HR组回肠。
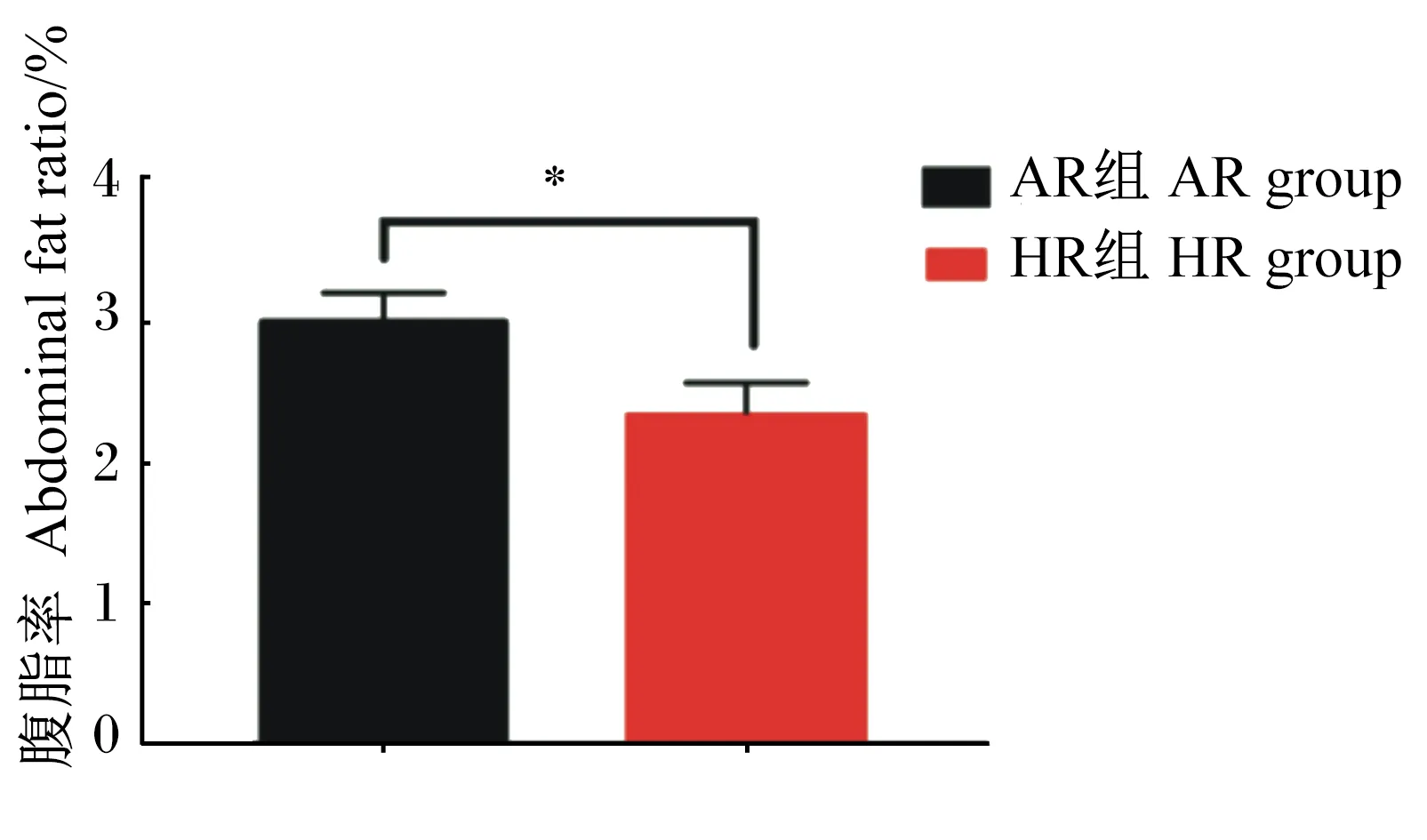
图3 不同产蛋水平肉种鸡腹脂率差异
2.10 不同产蛋水平肉种鸡盲肠微生物关联性分析
由图7可知,不同产蛋水平肉种鸡盲肠厚壁菌门相对丰度与卵巢BMPR1B、GATA4表达水平呈显著或极显著正相关(P<0.05或P<0.01),盲肠乳杆菌属相对丰度与卵巢caspase 9、BMPR1B、GATA4、PRL-L表达水平呈显著或极显著正相关(P<0.05或P<0.01),盲肠螺杆菌属(Helicobacter)相对丰度与卵巢GATA4表达水平呈极显著正相关(P<0.01);盲肠拟杆菌门相对丰度与卵巢BMPR1B、GATA4表达水平呈显著负相关(P<0.05),盲肠梭杆菌属(Fusobacterium)相对丰度与卵巢PRL-L表达水平呈显著负相关(P<0.05)。
3 讨 论
3.1 不同产蛋水平肉种鸡繁殖性能、肠道组织形态和微生物区系差异
本研究发现,HR组肉种鸡饲料转化效率和入孵蛋孵化率高于AR组,而二者采食量保持一致,表明HR组拥有更好的饲料利用效率,可能是由于HR组拥有更好的肠道组织形态和吸收功能。继而在本试验中发现,HR组肉种鸡十二指肠绒毛高度显著高于AR组,这与陈娜娜等[14]研究指出的高产蛋鸡的回肠绒毛高度高于低产蛋鸡的研究结果一致。但是本试验还发现在血清生化指标中,HR组肉种鸡血清ALT活性显著低于AR组,ALT主要参与体内转氨基作用,正常情况下,ALT主要存在于肝细胞中,而血清中活性很低,而当肝组织细胞受损或通透性增大能引起其浓度的升高,可能说明HR组肝脏健康优于AR组,并且熊立根[15]研究指出,血清ALT活性与蛋鸡产蛋率呈负相关,本试验和前人研究结果一致。

红色圆圈表示凋亡的卵巢细胞(褐色)。
肠道内微生物是环境依赖型[16],因此肠道内微生物会与宿主产生营养竞争。宿主盲肠微生物在降解宿主难以消化的碳水化合物中起到了重要的代谢作用[17],主要产生的丙酸被肝脏吸收,参与糖异生作用;丁酸参与糖异生、酮体生成及TG合成等,间接影响糖类和脂类代谢[18]。本研究发现,HR组肉种鸡盲肠微生物多样性和丰富度与AR组相比无显著差异,但是HR组盲肠厚壁菌门和乳杆菌属相对丰度显著高于AR组,盲肠拟杆菌门和螺旋体门相对丰度显著低于AR组。有研究指出肠道微生物和肠道神经内分泌功能有关[19],并且肠道微生物紊乱能够激发免疫系统进而使血清胰岛素和雄激素含量上升,紊乱卵巢功能[20]。Polansky等[21]研究指出,厚壁菌门移植到7日龄鸡盲肠中,满足了快速增长的幼鸡肠细胞对丁酸的需要,并且Stanley等[22]和Turnbaugh等[23]研究指出,在小鼠和人体中,厚壁菌门与拟杆菌门比例的增加与肥胖相关,这是由于厚壁菌门有强大的能量利用能力;不仅如此,Jumpertz等[24]研究指出,厚壁菌门能够增加宿主的营养吸收,但拟杆菌门会降低营养吸收,并且厚壁菌门中的乳酸杆菌和乳酸链球菌等具有调节肠道菌群的功能,可以提高动物生产性能和繁殖表现。同时,家禽肠道螺旋体病是我们熟知的在商品蛋鸡和肉鸡中出现的疾病,Stephens等[25]和Dwars等[26]研究指出肠道螺旋体菌能显著导致产蛋率下降,增加饲料消耗量。因此,本试验结果表明产蛋率更高的肉种鸡拥有更好的肠道形态以及更均衡的微生物区系,进而提高了肉种鸡对于饲料的利用效率。
3.2 不同产蛋水平肉种鸡卵巢功能差异
本研究发现,在2组肉种鸡采食量保持一致的情况下,HR组肉种鸡腹脂率显著低于AR组。前人研究表明,卵巢功能会随着腹部脂肪的增加而改变[27-31],体脂和繁殖力呈现负相关[32],本试验和前人研究一致。本研究还发现,与AR组相比,HR组肉种鸡卵巢细胞凋亡率极显著降低,卵巢BMPR1B、GATA4、PRL-L和caspase 9的表达水平显著提高。BMPR1B主要作用是和骨形成蛋白结合进行信号的传递[33],能够促进卵泡的生长发育和正常排卵。PRL-L是催乳素受体的一种功能性配体[34],PRL-L能够与垂体表达的催乳素基因在发育阶段可以以互补的方式影响卵巢发育[35]。GATA家族是一类主要位于卵泡颗粒细胞中的转录因子,主要参与调节卵泡的发育基因的表达和类固醇激素的合成,其低表达与卵泡闭锁有关,促性腺激素能够上调GATA4的表达[36]。所以BMPR1B、GATA4和PRL-L能够促进卵巢的发育,说明HR组可能是通过上调与卵泡发育相关基因的表达提高繁殖性能的。CYP19A1是芳香化酶的编码基因,芳香化酶能氧化脱去C19类固醇(雄烯二酮和T)的19甲基,将C19类固醇转变为C18雌激素(雌酮和E2),在体内雌激素合成过程中起重要作用[37]。研究发现,FSH能刺激GATA4与芳香酶启动子结合[38],本试验研究表明HR组显著上调的GATA4能够引起CYP19A1有趋势的上调,但是血清E2等激素含量却无显著性差异。李富贵等[39]研究指出,产蛋高峰期蛋鸡其生殖激素的含量会随着不同的时间点出现差异显著,如E2高峰期在06:00和18:00,FSH表达水平晚上高于白天,呈现周期性变化,本试验可能是由于采血时间为10:00,导致了HR组血清激素含量与AR组无显著性差异。Caspase 9参与细胞凋亡的胞内途径,细胞色素C从线粒体释放至胞浆,结合凋亡蛋白酶激活因子1再与前体caspase 9结合形成凋亡复合体,进而诱导caspase 9激活caspase 3、caspase 2来导致细胞凋亡[40],其表达的升高可能与细胞凋亡增加相关。然而,本试验中,HR组肉种鸡卵巢caspase 9表达水平较AR组显著升高,但卵巢细胞凋亡率却显著低于AR组。我们推测,其可能是由于参与细胞凋亡胞内途径的效应分子caspase 3和caspase 8没有变化,故仅仅caspase 9表达水平的升高并没有引起卵巢细胞凋亡率的升高,有关机制还需进一步的研究揭示。

PCNA:增殖细胞核抗原 proliferating cell nuclear antigen;caspase 3:半胱氨酸天冬氨酸蛋白酶3;caspase 8:半胱氨酸天冬氨酸蛋白酶8;caspase 9:半胱氨酸天冬氨酸蛋白酶9;Bax:B细胞淋巴瘤2关联X蛋白 B-cell lymphoma 2 associated X protein;Bcl2:B细胞淋巴瘤2蛋白 B-cell lymphoma 2 protein;PPARγ:过氧化物酶体增殖物激活受体γ peroxisome proliferator-activated receptor γ;FOXL2:叉头框转录因子L2 Forkhead box transcription factor L2;BMP15:骨形态发生蛋白15 bone morphogenetic protein 15;BMP15:骨形态发生蛋白受体2 bone morphogenetic protein receptor 2;BMPR1B:骨形态发生蛋白受体1B bone morphogenetic protein receptor 1B;OCLN:闭合蛋白 occludin;CYP11A1:细胞色素P450家族11亚家族A成员1 cytochrome P450 family 11 subfamily a member 1;StAR:类固醇生成急性调节蛋白 steroidogenic acute regulatory protein;CYP19A1:细胞色素P450家族19亚家族A成员1 cytochrome P450 family 19 subfamily a member 1;AR:雄性激素受体 androgen receptor;FSHR:卵泡刺激素受体 follicle stimulating hormone receptor;ESR1:雌激素受体1 estrogen receptor 1;PGR:孕激素受体 progesterone receptor;ACVR1:激活素受体1 activin receptor 1;AMH:抗缪勒氏管激素 anti-mullerian hormone;PRL-L:家鸡新型类催乳素 a novel prolactin-like protein in chickens。

图6 不同产蛋水平肉种鸡盲肠微生物alpha多样性分析
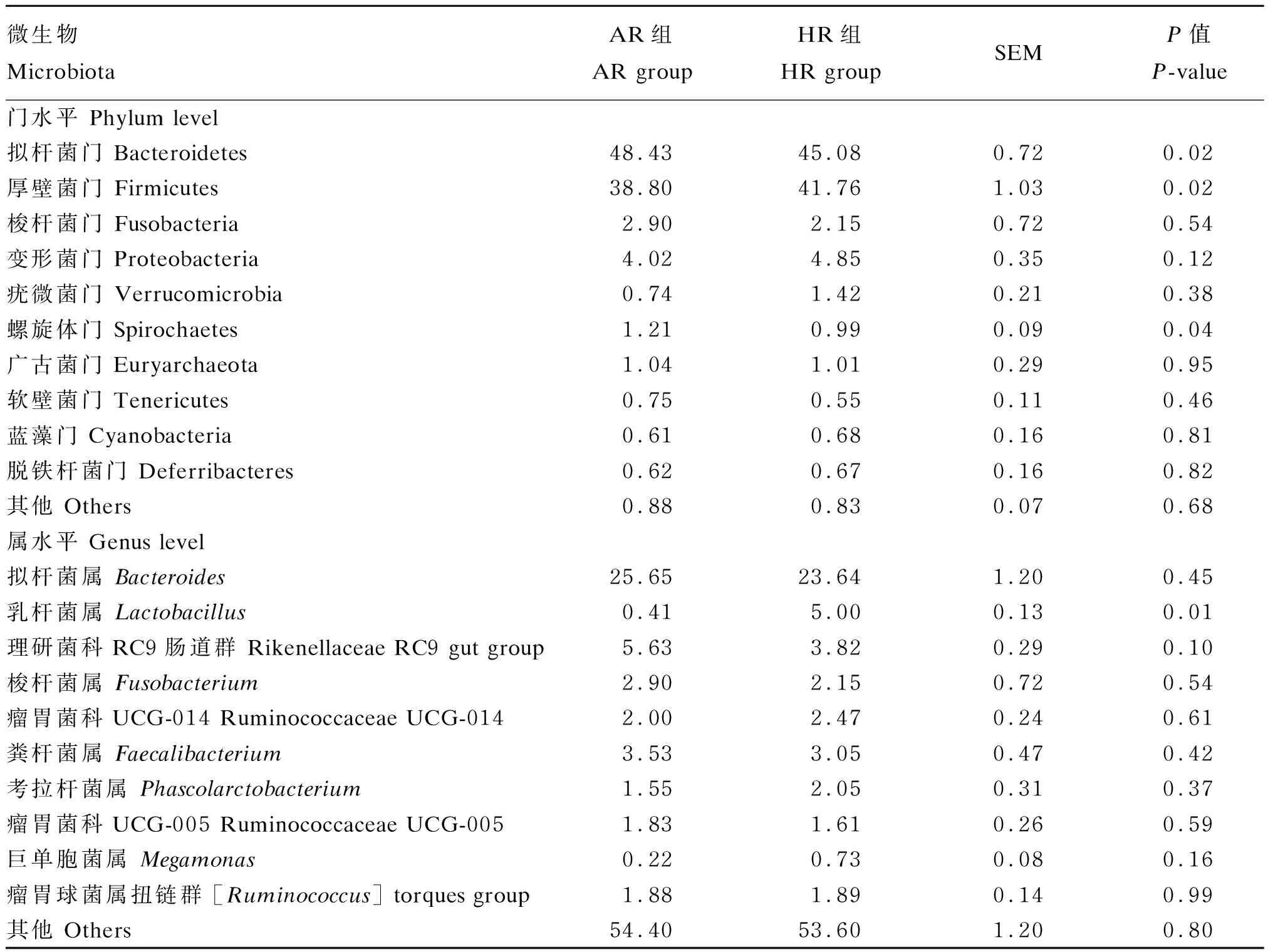
表5 不同产蛋水平肉种鸡盲肠微生物相对丰度差异(前10位)

Caspase 9:半胱氨酸天冬氨酸蛋白酶9;BMPR1B:骨形态发生蛋白受体1B bone morphogenetic protein receptor 1B;PRL-L:家鸡新型类催乳素 a novel prolactin-like protein in chickens;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Fusobacteria:梭杆菌门;Proteobacteria:变形菌门;Verrucomicrobia:疣微菌门;Spirochaetes:螺旋体门;Euryarchaeota:广古菌门;Tenericutes:软壁菌门;Cyanobacteria:蓝藻门;Deferribacteres:脱铁杆菌门;Actinobacteria:放线菌门;Synergistetes:互养菌门;Lentisphaerae:黏胶球形菌门;Gemmatimonadetes:芽单胞菌门;Acidobacteria:酸杆菌门;Elusimicrobia:迷踪菌门;Planctomycetes:浮霉菌门;Bacteroides:拟杆菌属;Lactobacillus:乳杆菌属;Rikenellaceae RC9 gut group:理研菌科RC9肠道群;Fusobacterium:梭杆菌属;Ruminococcaceae UCG-014:瘤胃菌科UCG-014;Faecalibacterium:粪杆菌属;Ruminococcaceae UCG-005:瘤胃菌科UCG-005;Megamonas:巨单胞菌属;[Ruminococcus] torques group:瘤胃球菌属扭链群;Desulfovibrio:脱硫弧菌属;Methanobrevibacter:甲烷短杆菌属;unidentified Ruminococcaceae:未鉴定的瘤胃菌科;Anaerotruncus:厌氧棍状菌属;Sutterella:萨特氏菌属;Butyricicoccus:丁酸球菌属;Phyllobacterium:叶杆菌属;Alloprevotella:拟普雷沃菌属;Coprococcus 1:粪球菌属1;Ruminiclostridium 9:瘤胃梭菌属9;Ruminiclostridium 5:瘤胃梭菌属5;Christensenellaceae R7 group:克里斯滕森菌科R7群;Ruminococcaceae NK4A214 group:瘤胃菌科NK4A214群;Helicobacter:螺杆菌属;unidentified chloroplast:未鉴定叶绿体;Oscillibacter:颤杆菌属;Ruminiclostridium:瘤胃梭菌属;[Eubacterium] coprostanoligenes group:真杆菌属coprostanoligenes群。
在盲肠微生物关联性分析中,本研究发现HR组盲肠厚壁菌门相对丰度与卵巢BMPR1B、GATA4表达水平呈显著正相关,盲肠拟杆菌门相对丰度与BMPR1B、GATA4表达水平呈显著负相关;盲肠乳杆菌属相对丰度与卵巢caspase 9、BMPR1B、GATA4、PRL-L表达水平呈显著正相关,盲肠梭杆菌属相对丰度与卵巢PRL-L表达水平成显著负相关。有研究指出肠道微生物和肠道神经内分泌功能有关[19],并且肠道微生物紊乱能够激发免疫系统进而使血清胰岛素和雄激素上升,紊乱卵巢功能[20]。
4 结 论
本试验结果表明,不同产蛋水平肉种鸡肠道组织形态、盲肠微生物区系和卵巢功能存在显著差异,盲肠厚壁菌门和乳杆菌属的相对丰度与高繁殖性能密切相关。
