乳腺癌锁骨上区不同放疗技术甲状腺剂量学比较及其对生存期和淋巴细胞亚群的影响
2021-02-07周湛明徐慆舒琦
周湛明,徐慆,舒琦
1.重庆医科大学附属第一医院内分泌乳腺外科,重庆400016;2.重庆市人民医院三院院区肿瘤科,重庆400013
前言
乳腺癌是妇科常见恶性肿瘤,好发于40~60岁绝经期前后女性,我国每年新发乳腺癌患者占全世界的12.2%,死亡占9.6%,且其发病率、死亡率呈逐年上升趋势[1]。在乳腺癌的综合治疗中,辅助性放射治疗扮演着重要角色,一方面有助于提高局部控制率,另一方面也是延长患者总生存期、降低复发转移风险的关键环节[2]。作为乳腺癌术后复发的常见部位,锁骨上区复发率可达40%,因此,对于高危复发风险的乳腺癌患者而言,应积极开展术后锁骨上区放射治疗[3]。然而,也有报道显示,乳腺癌根治术后放疗所致甲状腺功能减退发生率高达20%,射线所致血管损伤、细胞损伤和自身免疫反应是造成甲状腺功能减退的重要原因,同时,甲状腺照射剂量、体积和放疗剂量也是重要影响因素[4-5]。因此,选择合适的放疗技术以同时达到控制甲状腺受量、保证患者预后的目的,一直是临床关注的重点。本研究对比调强放疗(Intensity Modulated Radiation Therapy, IMRT)和三维适形放疗(Three Dimensional Conformal Radiation Therapy, 3D-CRT)两种技术的甲状腺剂量学及其对患者生存期、淋巴细胞亚群的影响,旨在为临床乳腺癌放疗技术的选择提供参考依据。
1 资料与方法
1.1 一般资料
以重庆医科大学附属第一医院2012年3月~2015年3月收治的71 例乳腺癌患者为研究对象,开展前瞻性研究。患者选取标准:(1)经病理组织学检查明确乳腺癌,于本院接受乳腺癌根治术治疗,手术达到R0 切除;(2)术后拟接受辅助放射治疗,放疗方案为IMRT 或3D-CRT;(3)本地居民,能够配合长期随访。排除标准:(1)既往有胸部放射治疗史;(2)双侧乳腺癌;(3)合并肿瘤远处转移;(4)合并免疫系统疾病。71 例患者中,37 例接受术后IMRT 治疗,纳入IMRT组,其余34 例接受3D-CRT 治疗,纳入3D-CRT 组,两组年龄、TNM 分期(均为M0期)、甲状腺体积、肿瘤位置比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究已征得本院医学伦理委员会批准(UT120108A),患者均知情同意并签署书面协议。

表1 两组患者一般临床资料比较Tab.1 Comparison of general clinical data between two groups
1.2 放疗方案
1.2.1 体位固定及扫描患者仰卧于定位床,上肢上举交叉抓杆,使用热塑体膜固定体位,使用Asteion4 CT(日本东芝公司)于患者平静状态下扫描,自环状软骨至乳腺褶皱或引流管口下2 cm 止,扫描层厚5 mm。扫描完毕后,将三维影像传输至Oncentra 治疗系统。
1.2.2 靶区勾画及处方剂量参照乳腺癌放疗靶区及剂量设计指引专家共识(2010年版)进行锁骨上区、正常器官及甲状腺勾画[6],计划靶区(Planning Target Volume, PTV)上下界由临床靶区(Clinical Target Volume, CTV)上下各外放1 cm、左右外放6 mm,锁骨上区放疗剂量50 Gy/25 f,5 f/周,甲状腺剂量限制参数V40<45%。IMRT计划采用5野调强:1野、2野根据肿瘤位置选择切肺组织最少的射野角度;3野、4野在1野和2野的基础上提高20°,射野角度包含在1野和2 野内;5 野与1 野、2 野形成90°夹角。3D-CRT 计划采用4野照射:PTV 划分为胸壁照射区和锁上淋巴引流照射区,胸壁照射区肿瘤位置选择切肺组织最少的射野角度;锁上淋巴引流照射区采用固定野对穿技术,肿瘤位于左侧者,对穿野选择345°,肿瘤位于右侧者,对穿野选择15°。
1.3 观察指标
比较两组患者计划靶区PTV 剂量、甲状腺受量,放疗前后淋巴细胞亚群变化,以及5年无病生存率、总生存率,比较两种放疗技术的甲状腺保护作用及其对患者预后的影响。PTV 剂量包括95%靶区接受剂量(D95%)、最大剂量(Dmax)、平均剂量(Dmean)、剂量均匀性指数(Homogeneity Index, HI)以及适形度指数(Conformal Index, CI),其中,HI=D5%/D95%,CI=(参考等剂量线所包绕的PTV 体积/PTV 实际体积)×(参考等剂量线所包绕的PTV体积/参考等剂量线所覆盖的总体积);HI 越接近1 表明靶区剂量越均匀,CI 范围0~1,越接近1 则表明靶区适形度越佳[7-8]。甲状腺受量包括V20、V30、V40、V50体积受量,以及Dmax、Dmin、Dmean。淋巴细胞亚群检测时点为放疗前、放疗后1 d,指标包括淋巴细胞总数及CD3+、CD4+、CD8+、B 淋巴细胞、自然杀伤细胞(Natural killer cell, NK)百分比。5年无病生存率、生存率通过随访结果判断。
1.4 统计学分析
数据采用SPSS18.0 进行分析,计数资料以%表示,并采用χ2检验,计量资料均符合正态分布,以均数±标准差表示,满足方差齐性则采用独立样本t检验,若方差不齐,则采用校正t检验,生存分析采用Kalpan-Meier曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 PTV剂量
IMRT 组Dmean、CI 高于3D-CRT 组,Dmax、HI 低于3D-CRT组,差异均有统计学意义(P<0.05,表2)。
表2 两组患者PTV剂量比较(± s)Tab.2 Dosimetric comparison of planning target volume between two groups(Mean±SD)

表2 两组患者PTV剂量比较(± s)Tab.2 Dosimetric comparison of planning target volume between two groups(Mean±SD)
组别IMRT组3D-CRT组P值n 37 34-D95%/cGy 5 042.2±22.6 5 049.5±18.9>0.05 Dmean/cGy 5 212.8±71.7 4 338.9±81.7<0.05 Dmax/cGy 5 482.6±59.1 5 883.7±152.6<0.05 HI 1.05±0.03 1.16±0.04<0.05 CI 0.79±0.08 0.62±0.07<0.05
2.2 甲状腺受量
IMRT 组甲状腺剂量体积V20、V30、V40均高于3D-CRT 组,其Dmin、Dmean也高于3D-CRT组,差异均有统计学意义(P<0.05,表3)。
表3 两组患者甲状腺受量比较(± s)Tab.3 Comparison of thyroid dose between two groups(Mean±SD)
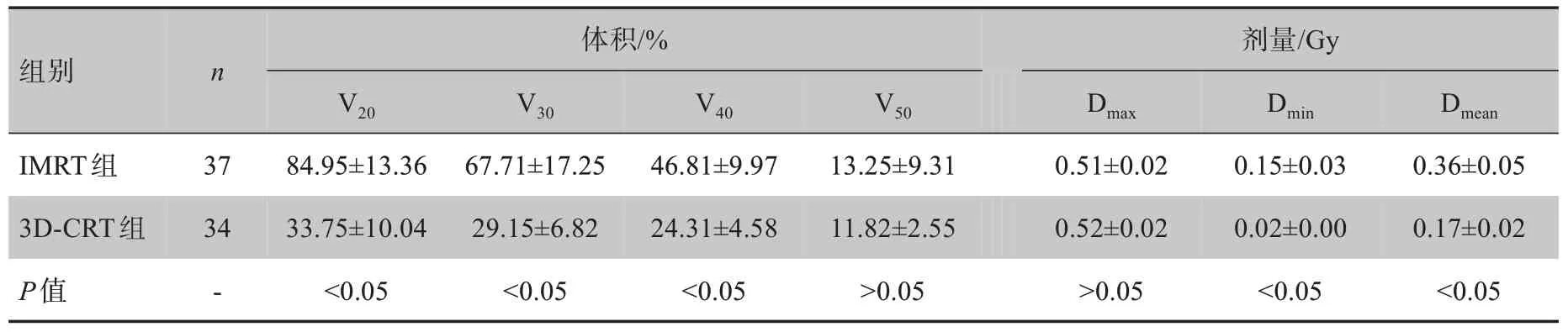
表3 两组患者甲状腺受量比较(± s)Tab.3 Comparison of thyroid dose between two groups(Mean±SD)
组别IMRT组3D-CRT组P值n 37 34-体积/%V20 84.95±13.36 33.75±10.04<0.05 V30 67.71±17.25 29.15±6.82<0.05 V40 46.81±9.97 24.31±4.58<0.05 V50 13.25±9.31 11.82±2.55>0.05剂量/Gy Dmax 0.51±0.02 0.52±0.02>0.05 Dmin 0.15±0.03 0.02±0.00<0.05 Dmean 0.36±0.05 0.17±0.02<0.05
2.3 淋巴细胞亚群
两组放疗后1 d 淋巴细胞总数、B 淋巴细胞百分比均较放疗前下降,CD3+、CD4+均较放疗前升高,3D-CRT 组放疗后1 d 淋巴细胞总数、B 淋巴细胞百分比、CD3+、CD4+均高于IMRT 组,差异有统计学意义(P<0.05)。见表4。
2.4 生存期分析
IMRT组失访3例、3D-CRT组失访1例,其余患者均获得有效随访,随访时间≥5年。IMRT组5年无病生存率、总生存率分别为47.06%(16/34)、73.53%(25/34),3D-CRT组分别为51.52%(17/33)、78.79%(26/33),两者指标比较差异无统计学意义(P>0.05)。
表4 两组患者淋巴细胞亚群变化比较(± s)Tab.4 Comparison of changes of lymphocyte subsets between two groups(Mean±SD)
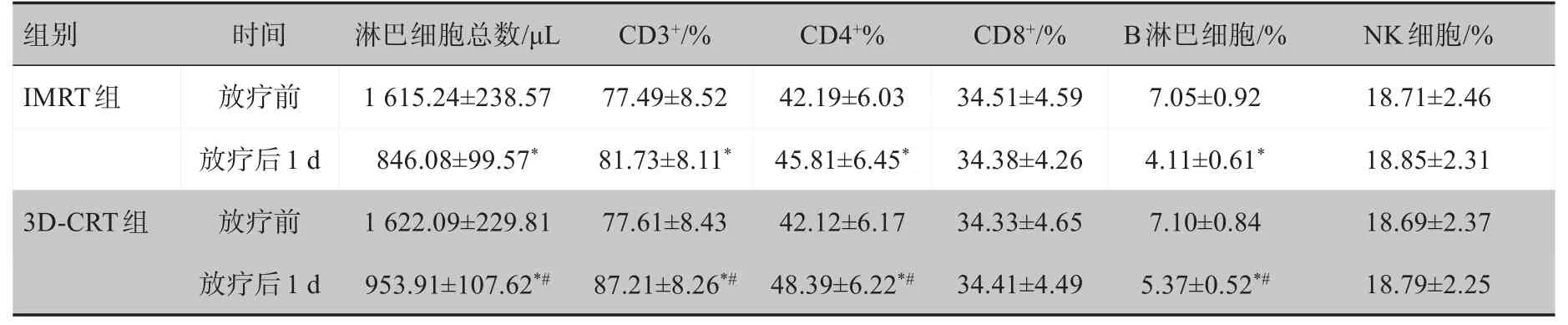
表4 两组患者淋巴细胞亚群变化比较(± s)Tab.4 Comparison of changes of lymphocyte subsets between two groups(Mean±SD)
*:与放疗前比较,P<0.05;#:与IMRT组同时期比较,P<0.05
组别IMRT组3D-CRT组时间放疗前放疗后1 d放疗前放疗后1 d淋巴细胞总数/μL 1 615.24±238.57 846.08±99.57*1 622.09±229.81 953.91±107.62*#CD3+/%77.49±8.52 81.73±8.11*77.61±8.43 87.21±8.26*#CD4+%42.19±6.03 45.81±6.45*42.12±6.17 48.39±6.22*#CD8+/%34.51±4.59 34.38±4.26 34.33±4.65 34.41±4.49 B淋巴细胞/%7.05±0.92 4.11±0.61*7.10±0.84 5.37±0.52*#NK细胞/%18.71±2.46 18.85±2.31 18.69±2.37 18.79±2.25
3 讨论
恶性肿瘤的放射治疗已进入精确放疗时代,要求靶区的定义、勾画必须准确,且能够更好地覆盖复发危险区域,并强调减少周围器官和正常组织的照射,从而在减少危及器官放疗并发症的前提下,降低肿瘤复发率,保证患者生存质量[9]。在这一理念指导下,近年来临床愈发重视乳腺癌术后放疗后甲状腺功能低下的预防,其原因为:甲状腺功能下降可导致乳腺癌复发风险上升,而纠正甲状腺功能低下对于提高手术和化疗效果也有着重要意义[10-11]。
放疗所致甲状腺功能损伤主要与垂体和甲状腺受照体积、放疗剂量有关,为寻求保证疗效剂量与保护甲状腺功能的平衡,降低甲状腺受照体积和剂量是唯一的解决方案[12]。当前,3D-CRT 是乳腺癌放疗首选方式,有学者认为,单独锁骨上野的双靶区放疗计划中,甲状腺V30指标已能够满足甲状腺剂量阈值要求[13],而单靶区放疗计划则导致甲状腺V30显著高于剂量阈值,往往导致患者甲状腺功能减退发生风险大幅上升[14]。同时,本研究就IMRT 放疗后甲状腺受量进行了分析与对比,结果显示,IMRT 组CI 较3D-CRT 组更高且HI 更低,说明IMRT 有着更为理想的靶区均匀性,而3D-CRT 组Dmean更低,说明该技术能够降低平均照射剂量,其优势包括:(1)3D-CRT 包括4个射野,即2个对穿野与1个斜野,且180°的射野能够在补足靶区后缘剂量的基础上满足靶区适形度要求,故可降低平均照射剂量;(2)对穿野采用多叶准直器全挡或部分挡住危及器官,对于降低危及器官受累也有着积极意义[15-16]。得益于上述优势,3DCRT 组甲状腺剂量体积V20、V30、V40,以及Dmin、Dmean均低于IMRT 组,说明3D-CRT 技术能够显著改善甲状腺剂量分布,降低甲状腺受照射剂量,主要得益于3D-CRT 技术将靶区分为胸壁照射区和锁骨上淋巴引流区,并且单独布野,故不仅能够保护甲状腺,还可降低肺组织照射剂量,降低放射性肺炎等并发症发生风险[17]。而使用IMRT 后,甲状腺体积受量增加,故在锁骨上区未见淋巴结转移的前提下,3D-CRT即可满足临床需求。
为进一步比较两种放疗技术对患者免疫功能的影响,此次研究就两组淋巴细胞亚群变化进行了对比,结果显示两组放疗后1 d 均经历了淋巴细胞降低,且CD3+、CD4+有所升高,说明机体抗肿瘤反应有所增强,而3D-CRT 组淋巴细胞降低更少,CD3+、CD4+升高更明显,说明3D-CRT对于激活全身抗肿瘤反应有着更为积极的作用,且对免疫功能的负面影响不及IMRT[18]。此外,通过比较两组患者5年无病生存率、总生存率,可以发现虽然3D-CRT 的靶区剂量均匀性不及IMRT,但两组5年生存质量无显著差异,进一步证明3D-CRT 技术在乳腺癌放疗中的应用前景。
综上所述,IMRT 的靶区剂量均匀性更佳,但甲状腺受量更高且患者放疗后淋巴细胞亚群变化更为明显;IMRT 与3D-CRT 对乳腺癌患者远期生存的影响无显著差异。对于需要甲状腺功能保护的患者而言,术后更建议选择3D-CRT 辅助放疗方案,以降低甲状腺功能低下等并发症发生风险。
